Врожденные пороки сердца (ВПС) – это возникшие внутриутробно (до рождения ребенка) анатомические дефекты сердца, его клапанного аппарата или его сосудов. Эти дефекты могут встречаться изолированно или в сочетании друг с другом.
ВПС может проявляться сразу после рождения ребенка или протекать скрыто. Встречаемость ВПС 6-8 случаев на каждую тысячу родов, что составляет 30% от всех пороков развития, и занимают первое место по смертности новорожденных и детей первого года жизни. После первого года жизни смертность резко снижается, и в период от 1 года до 15 лет погибают не более 5% детей. Понятно, что это большая и серьезная проблема [1,5].
Лечение ВПС возможно только хирургическим путем. Благодаря успехам кардиохирургии стали возможны сложные реконструктивные операции при ранее неоперабельных ВПС. В этих условиях основной задачей в организации помощи детям с ВПС является своевременная диагностика и оказание квалифицированной помощи в хирургической клинике.
Среди ВПС больше половины составляют пороки с гиперволемией малого круга кровообращения (МКК). Их естественное течение сопровождается поступлением дополнительного объема крови в систему малого круга кровообращения через патологические сообщения на уровне предсердий, желудочков либо магистральных сосудов и формированием осложнения - легочной гипертензии (ЛГ), встречающейся в 30-50% случаев [2-4,6].
Основным способом лечения ВПС является хирургическая коррекция, однако наличие ЛГ резко увеличивает госпитальную летальность и существенно влияет на качество отдаленных результатов операции [9,10].
В настоящее время не прекращается поиск новых методов диагностики, позволяющих определить резервные возможности сосудов малого круга кровообращения. В зависимости от преобладания функциональных или органических изменений легочных сосудов можно судить об обратимости или необратимости легочной гипертензии, и в связи с этим определить дальнейшую тактику лечения. Проводятся многочисленные исследования по различным методам лечения, по сочетанию и дозировкам препаратов, снижающих ЛГ при ВПС как в дооперационном периоде, так и воздействуя на резидуальную ЛГ в послеоперационном периоде [1,8,10,11].
В патогенезе заболевания следует выделить четыре основных патофизиологических феномена: вазоконстрикция; редукция легочного сосудистого русла; снижение эластичности легочных сосудов; облитерация легочных сосудов (тромбоз in situ, пролиферация гладкомышечных клеток).
До настоящего времени точно не установлены процессы, играющие пусковую роль в развитии патологических изменений в легочных сосудах при ЛГ. Современные теории патогенеза ЛГ фокусируются на дисфункции или повреждении эндотелия, приводящей к нарушению баланса между вазоконстриктивными и вазодилатирующими веществами и развитию вазоконстрикции. Освобождение неидентифицированных хемотаксических агентов из поврежденных клеток эндотелия вызывает миграцию гладкомышечных клеток в интиму легочных артериол. Секреция локально активных медиаторов с выраженным вазоконстрикторным действием способствует развитию тромбоза in situ, трансформируя состояние легочного сосудистого русла из обычного антикоагулянтного состояния (вследствие освобождения простациклина и ингибитора тканевого активатора плазминогена) в прокоагулянтное. В результате образуется порочный круг: повреждение эндотелия неуклонно прогрессирует и приводит к ремоделированию легочных сосудов, нарастанию сосудистой обструкции и облитерации. При этом патологические процессы затрагивают все слои сосудистой стенки, различные типы клеток - эндотелиальные, гладкомышечные, фибробласты. В адвентиции отмечается повышенная продукция экстрацеллюлярного матрикса, включая коллаген, эластин, фибронектин и тенасцин. Воспалительные клетки и тромбоциты также играют существенную роль в развитии ЛГ. В плазме крови больных с ЛГ повышены уровни провоспалительных цитокинов, в тромбоцитах нарушается метаболизм серотонина. При исследовании вазоактивных субстанций была показана повышенная продукция тромбоксана и мощного вазоконстрикторного пептида эндотелиального происхождения с митогенными свойствами в отношении гладкомышечных клеток - эндотелина-1, дефицит вазодилататора простациклина и оксида азота. У большинства больных с семейной ЛГ, а также у ряда больных со спорадическими случаями ЛГ- идиопатическая легочная гипертензия (ИЛГ) выявляется ассоциация с мутациями гена, локализующегося на 2 хромосоме и кодирующего рецептор типа II к протеину костного морфогенеза. Однако до сих пор не установлена патобиологическая взаимосвязь между генетическими нарушениями и развитием ЛГ. Обращает на себя внимание высокая частота ИЛГ и низкая пенетрация при семейной ЛГ (примерно 20% мутаций приводит к манифестации заболевания) указывают на то, что для развития заболевания необходимы дополнительные триггеры. Это может быть полиморфизм генов, кодирующих NO-синтазу, карбимил-фосфат синтазу, синтез переносчиков серотонина, или другие стимулы, ответственные за контроль роста легочных сосудистых клеток.
Таким образом, отдельные патобиологические процессы в клетках и тканях больных ЛГ установлены, однако взаимодействия этих механизмов в развитии и прогрессировании заболевания точно неизвестно.
Теоретически можно предположить, что наследственная пред-расположенность реализуется под воздействием факторов риска, что приводит к изменениям различных типов клеток (тромбоциты, гладкомышечные, эндотелиальные, воспалительные клетки), а также в экстрацеллюлярном матриксе микроциркуляторного русла легких. Дисбаланс между тромботическими, митогенными, провоспалительными, вазоконстриктивными факторами и механизмами обратного действия - антикоагулянтными, антимитогенными, вазодилатирующими, способ-ствует вазоконстрикции и тромбозам, пролиферативным и воспалительным изменениям в легочном микроциркуляторном русле. Именно эти механизмы ответственны за развитие и прогрессирование патологических обструктивных процессов в легочных сосудах при ЛГ, увеличению легочного сосудистого сопротивления, перегрузке и декомпенсации правого желудочка, гибели больных. Современные знания о механизмах ЛГ фокусируются на повреждении или дисфункции эндотелия сосудов малого круга кровообращения, что проявляется нарушением баланса между вазоконстриктивными и вазодилятирующими веществами [4,9]. Учитывая это, в последние годы интерес кардиологов вызывают ферменты из семейства фосфодиэстераз (ФДЭ), катализирующих гидролиз циклических нуклеозидов 3'5'-аденозинмонофосфата (цАМФ) и 3'5'-гуанозинмонофосфата (цГМФ) [12,13]. В настоящее время в зарубежных клиниках при лечении ЛГ у детей используют ингибитор фосфодиэстеразы - силденафил [14,16,17]. Силденафил - селективный ингибитор цГМФ-зависимой фосфодиэстеразы (тип 5), предотвращая деградацию цГМФ, повышает уровень эндогенного оксида азота, который является мощным вазодилятатором, селективно действующим на сосуды малого круга кровообращения [18-20].
В связи с этим представляется логичным использовать силденафилы для лечения ЛГ у детей с врожденными пороками сердца в дооперационном периоде и, таким образом, увеличить количество больных, подлежащих оперативному вмешательству [19,20].
Цель исследования - оценить результаты использования силденафилов в комплексном лечении легочной гипертензии у детей с врожденными пороками сердца в дооперационном периоде.
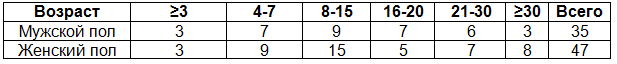
Материал и методы. В отделении хирургии врожденных пороков сердца РСЦХ им. акад. В.Вахидова за период 2006-2009 г. наблюдались 835 больных с ВПС, характеризующихся артерио-венозным сбросом. Из них-с ЛГ II-IVст.-198 больных. Все эти больные по предоперационной подготовке были распределены на 2 группы : 1-я группа-82 больных - контрольная (2006-2007гг), которые в предоперационном периоде в течение 14-20 дней получали общепринятую терапию (сердечные гликозиды, метаболиты, диуретики по показаниям). К моменту поступления средний возраст составлял 23,5±22,6 (1-46лет). Лиц женского пола 47 (57,3%), мужского 35 (42,7%). Соотношение 1.34:1, табл.1.
Таблица 1. Распределение больных по возрасту (контрольная группа)
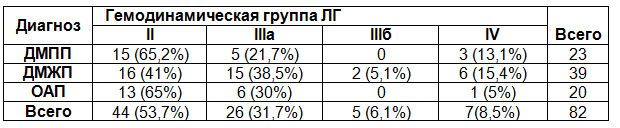
Все обследованные больные в зависимости от диагноза и степени ЛГ были распределены на 3 группы – с дефектом межпредсердной перегородки-23,с дефектом межжелудочковой перегородки-39,с открытым аортальным протоком-20, табл.2.
Таблица 2. Распределение больных по зависимости от диагноза и степени ЛГ (контрольная группа)
Уровень систолического артериального давления (САД) в правом желудочке, по данным эхокардиографии, у обследованных пациентов находился в пределах от 46 до 101 мм рт. ст. У 26(31,7%) пациентов данный показатель составил более 70% от системного САД, у 44(53,6%) больных от 50 до 70%, у12(14,6%) больных более 100%.
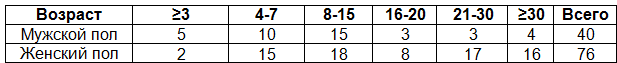
2-группа-116 больных –основная(2008-2009гг.).Из них пациенты с ЛГ II-IV ст. в предоперационном периоде в течении 20 дней помимо общепринятой терапии получали 2-х компонентную терапию: силденафилы в дозе 2,5-3мг/кг/сут. и ингибиторы АПФ-каптоприл в дозе 2,5-5мг 2 раз/ сут. К моменту поступления средний возраст составлял 25,6±23,1 (2-48 лет). Лиц женского пола-76 (65,5%), мужского-40 (34,5%). Соотношение 1,9:1, табл.3.
Таблица 3. Распределение больных по возрасту (основная группа)
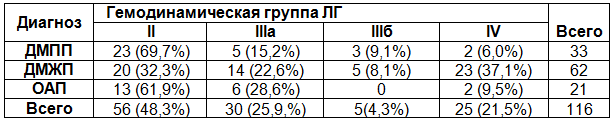
Все обследованные больные в зависимости от диагноза и степени ЛГ были распределены на 3 группы - с дефектом межпредсердной перегородкой-33, с дефектом межжелудочковой перегородкой-62, с открытым аортальным протоком-21, табл. 4.
Таблица 4. Распределение больных по зависимости от диагноза и степени ЛГ
Уровень систолического артериального давления (САД) в правом желудочке, по данным эхокардиографии, у обследованных пациентов находился в пределах от 46,5до 115 мм рт. ст. У 35(30,2%) пациентов оно составляло от 70 до 100% от системного САД, у 56(48,3%) больных от 50 до 70%,у 25(21,5%) больных более 100%.
Всем пациентам проводилась эхокардиография по общепринятой методике на ультразвуковой системе EnVisor CV и iE-33 (Philips, Япония). Больным с ЛГ II-IV ст. выполнялась катетеризация полостей сердца и проба с ингаляцией 100%-го кислорода в рентгеноперационных, оборудованных ангиографическими комплексами AXIOM Artis и Coroskop Plus/T.O.P. (Siemens, Германия). По методу Фика рассчитывались показатели, оценивающие состояние сосудов малого круга кровообращения (Qp/Qs, легочное сопротивление). Обследования проводились до начала лечения и непосредственно перед операцией (не менее 2 раз).
Полученные данные подвергались статистической обработке при помощи программы Statistica 6.0 for Windows. Количественные показатели представлены в виде Me (Q25%-Q75%), где Me - медианное значение показателя, а (Q25%-Q75%) - интерквартильный разброс. Проверку достоверности различий производили с использованием непараметрических критериев, поскольку распределение пациентов по возрасту и массе тела отличалось от нормального. Различия считали достоверными при p < 0,05.
Результаты и обсуждение. Исходно у всех пациентов основной группы систолическое артериальное давление (САД) было от 84 до 102 мм рт. ст., диастолическое артериальное давление (ДАД) от 52 до 69 мм рт. ст. После приема силденафила САД составляло от 85 до 108 мм рт. ст., ДАД от 50 до 78 мм рт. ст. Таким образом, у пациентов не зарегистрировано значимого снижения системного АД после приема силденафила, что свидетельствует об отсутствии влияния препарата на сосуды большого круга кровообращения, табл.5.
Таблица 5. Результаты лечения сильденафилами пациентов с ВПС, осложненными ЛГ
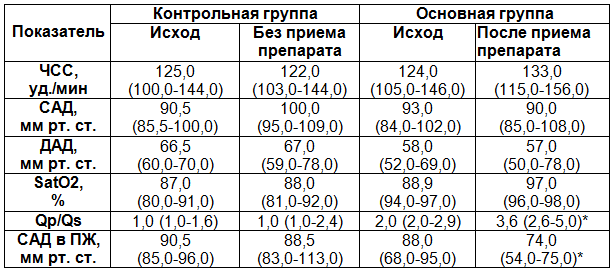
Также после приема силденафила не зафиксировано изменения ЧСС. Только у одной пациентки в возрасте 5 лет с дефектом межжелудочковой перегородки и исходным САД в правом желудочке 86 мм рт. ст. после приема силденафила было отмечено учащение ЧСС на 20% от исходного значения. Скорее всего, на пике действия препарата вазодилятация сосудов малого круга кровообращения способствовала увеличению сброса крови через дефект межжелудочковой перегородки в легочную артерию, и появившаяся тахикардия носила компенсаторный характер. Сочетание терапии силденафилами с препаратами ингибиторов АПФ позволяет уменьшить периферическое сопротивление сосудов и таким образом, снять симптомы, которые могут возникнуть при увеличении сброса крови через дефекты перегородок (такие как подъем АД, тахикардия.)
У пациентов основной группы САД в ПЖ составило 65-96 мм рт. ст., показатель Qp/Qs 1,0-2,9, после приема силденафила зарегистрировано САД в ПЖ 44-95 мм рт. ст. и Qp/Qs 1,0-5,0. У пациентов контрольной группы, которые получали общепринятую терапию не отмечается достоверного снижения показателей САД в ПЖ .
У всех пациентов по данным пробы с ингаляцией кислородом при катетеризации была отмечена реакция сосудов малого круга кровообращения - увеличение Qp/Qs, снижение легочного сопротивления после ингаляции кислорода по сравнению с исходными значениями. Положительная реакция сосудов малого круга кровообращения свидетельствовала о функциональном спазме легочных сосудов. В этом случае ЛГ считалась обратимой, а хирургическая коррекция врожденного порока сердца возможной. Всем пациентам с ЛГ III а ст. с положительной реакцией на кислородную пробу после лечения силденафилами проведено оперативное лечение порока, табл. 6.
Таблица 6. Результаты лечения силденафилами после кислородной пробы
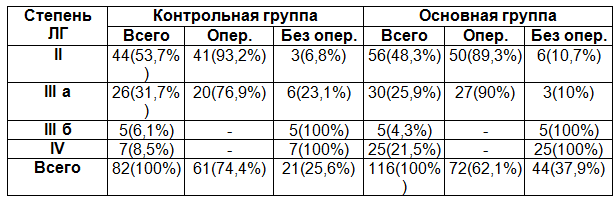
В контрольной группе из 44 пациентов с ЛГ II ст. оперировано 41(93,2%) пациента, не оперировано-3(6,8%) – отказ от операции. Из 26 пациентов с ЛГ IIIа ст. оперировано-20 (76,9%),не оперировано - 6(23,1%) из-за высокой ЛГ. Пациенты с ЛГ IIIб-IV ст. не оперированы. У 2 больных отмечался летальный исход на 2-3 сутки после оперативного вмешательства в следствии развившейся острой сердечно-сосудистой недостаточности по правожелудочковому типу (гипертензионный криз) на фоне резидуальной ЛГ.
В основной группе из 56(48,3%) пациентов с ЛГ II ст. оперировано 50(89,3%), 6(10,7%)-не оперированы, по причине отказа. Из 30(25,9%) пациентов с ЛГ III а ст. оперированы 27(90%),причем у 7 больных на первой катетеризации кислородная проба была отрицательная, на второй катетеризации - положительная, в связи с чем и эти больные подверглись оперативному вмешательству. Не оперированы 3(10%) больных из-за отрицательной кислородной пробы.
При отрицательной реакции отсутствие изменений легочной гемодинамики свидетельствовало о необратимой ЛГ. У 3 пациентов при катетеризации полостей сердца после ингаляции кислорода не зарегистрировано увеличения Qp/Qs и снижения легочного сопротивления по сравнению с исходными значениями. В данном случае хирургическое лечение ВПС было противопоказано. Пациенты с ЛГ III б-IV ст.- не оперированы, хотя и у некоторых из них давление в ПЖ снижается на 8-10%. У 1 больного по причине гипокоагуляционного кровотечения отмечался летальный исход.
Заключение. Суммируя полученные данные, лечение силденафилами в комплексном дооперационном лечении в основной группе выявило снижение легочного сопротивления и давления в ПЖ в среднем на 10-14%. Таким образом, расширяются показания к оперативному лечению, отмечается более благоприятное течение в послеоперационном периоде, улучшается общее состояние и удлиняется срок жизни больных, не подлежащих к оперативному вмешательству.
Исходя из вышеизложенного, силденафилы могут быть рекомендованы как основной препарат при лечении ЛГ в дооперационном периоде и как поддерживающая терапия у больных с врожденными пороками сердца, осложненных высокой легочной гипертензией. Объективность получаемой информации подтверждается данными повторной эхокардиографии и катетеризацией полостей сердца.
