На структуру возбудителей инфекций у иммунокомпрометированных больных могут оказывать воздействие различные факторы. Наиболее значимые из них – генетические, климатические, экологические. Кроме того, немаловажную роль играет и наличие госпитальной инфекции в стационарах, при которой чаще всего идентифицируются устойчивые к антибиотикам штаммы микроорганизмов [1,4,9]. Несмотря на большое количество научных исследований в данной области, таких исследований по структуре возбудителей инфекционных осложнений у больных острыми лейкозами в Узбекистане не проводились.
Наиболее широко используемыми препаратами для лечения инфекций у больных во время фебрильной нейтропении являются β-лактамные антибиотики, аминогликозиды и хинолоны [6,8]. Однако, в последние годы отчётливо прослеживается снижение эффективности лечения подобных инфекций, одной из причин которого является развитие резистентности к вышеуказанным группам препаратов. Развитие резистентности к антибиотикам чаще всего связано с неграмотным подбором антибактериальных препаратов, используемых для лечения и профилактики инфекционных осложнений [3,5]. В связи с этим, изучение микроорганизмов у иммунокомпрометированных больных имеет большое значение для лечения больных острыми лейкозами и является важной задачей онкогематологии.
Цель исследования: Изучить структуру возбудителей бактериемий у больных острыми лейкозами и оценить их чувствительность к антимикробным препаратам.
Материалы и методы. В исследование были включены 85 больных острыми лейкозами, медиана возраста 32,8±0,6 лет (58 больных острыми миелобластными лейкозами и 37 больных острыми лимфобластными лейкозами) в состоянии фебрильной нейтропении. Были проанализированы результаты 85 образцов крови.
Бактериемия у больных острыми миелобластными лейкозами определялась у 30 больных, у больных острыми лимфобластными лейкозами – у 11 больных.
Бактериологические исследования проводили общепринятыми методами [7]. Микробиологическое исследование крови из периферической вены осуществлялось на высоте лихорадки и/или при появлении первых признаков инфекции до назначения антибактериальной терапии. Посев осуществляли в коммерческую систему, представляющую собой флакон с двухфазной средой HiCombi (HiMedia, Индия), закрытой резиновой пробкой и завальцованный пластмассовым колпачком. Перед посевом проводилась тщательная обработка кожи над пунктируемой веной 70% спиртом, затем 5% йодной настойкой и снова 70% спиртом (экспозиция каждого антисептика 2 мин). Аналогичным способом обрабатывалась резиновая пробка флакона для посева крови. Посев крови осуществляли одноразовыми шприцами в стерильных перчатках непосредственно у постели больного. Для посева брали 5-7 мл крови на 50 мл среды. После взятия крови, иглу перед посевом во флакон заменяли над пламенем спиртовки на новую. Эти манипуляции позволяют исключить возможность контаминации посевов микрофлорой кожи.
Определение чувствительности выделенных штаммов к антибиотикам осуществляли в соответствии с методическими указаниями (МУК) 4.2.1890-04 «Определение чувствительности микроорганизмов к антибактериальным препаратам» диско-диффузионным методом с использованием коммерческих дисков зарубежного производства и среды Мюллер-Хинтона (HiMedia, Индия).
Статистический анализ результатов проведен с использованием пакета статистических программ "Microsoft Excel 2003" и «OpenEpi 2009, version 2.3». Полученные данные представлены в виде средней арифметической величины М и средней ошибки m: М±m. Рассчитывалось количество изучаемых признаков в группах (n). Достоверность различий сопоставляемых совокупностей осуществлялось с использованием t-критерия Стьюдента и показателя соответствия χ2; критический уровень достоверности нулевой статистической гипотезы (об отсутствии различий и влияний) принимали равным 0,05.
Результаты и обсуждение.
Проведен анализ структуры возбудителей бактериемий у больных острыми лейкозами. Грамположительная флора идентифицировалась в 58,5% случаев, грамотрицательная флора была определена в 41,5% случаев. Видовой состав микроорганизмов, выделенных из крови, представлен в табл. 1.
Среди грамположительных бактерий чаще встречались микроорганизмы семейства Staphylococcus, на долю которых пришлось 79,1%. На первом месте по распространённости стоит Staphylococcus epidermidis, который был выявлен в 11 случаях из 24, что составило 45,8%. В последние годы наблюдается значительное увеличение доли данного вида микробов, что возможно соответствует периоду широкого внедрения в гематологической клинике чрескожной катетеризации центральных вен.
Таблица 1. Видовой состав микроорганизмов, выделенных из крови

Этот факт даёт основание предположить, что введение центрального катетера в определённой мере влияет на этиологию бактериемий, как это отмечают и другие исследователи [2].
На втором месте по распространённости стоит Staphylococcus aureus, выявление которого составило 33,3%. В небольшом количестве случаев высеивались Enterococcus (16,7%) и Streptococcus haemolyticus (4,2%).
Среди грамотрицательных микроорганизмов (всего 17 штаммов) в большинстве случаев идентифицировались палочки семейства Enterobacteriaceae, их частота составила 82,3%. В остальных случаях высеивались Klepsiella pneumoniae, Pseudomonas aeroginosa и Escherichia coli. Таким образом, среди возбудителей бактериемий достоверно преобладали грамположительные микроорганизмы.
Далее нами была изучена чувствительность к антибактериальным препаратам штаммов, выделенных из крови больных острыми лейкозами в период нейтропении (табл. 2).
Установлено, что чувствительность выделенных культур к антибиотикам пенициллинового ряда достаточно низка и составляет 15% для амоксициллина и 47% для защищённых пенициллинов (амоксициллин/клавуланат, ампициллин/сульбактам).
Нами была установлена достаточно высокая устойчивость штаммов к антибиотикам фторхинолонового ряда, причём установлена обратная связь между поколением антибиотика и резистентностью к нему штаммов микроорганизмов. Так, например, устойчивость к ципрофлоксацину составила 63%, а к левофлоксацину – на 10% ниже (53%). Из антибиотиков аминогликозидового ряда наибольшая чувствительность была отмечена к амикацину (73%), что в 1,6 раз выше гентамицина (45%).
Результаты исследования показали, что в наибольшей степени исследованные культуры сохраняли чувствительность к цефалоспоринам третьего и четвёртого поколений – цефоперазону/сульбактаму и цефепиму (82% и 78% соответственно). Полученные данные натолкнули нас на мысль к более подробному изучению чувствительности микроорганизмов – возбудителей инфекций у больных острыми лейкозами к современным антибактериальным препаратам широкого спектра действия. Для проведения сравнительного исследования было выбрано 6 антибиотиков: цефалоспорины III поколения (цефтриаксон, цефоперазон, цефоперазон/сульбактам), IV поколения (цефепим), β-лактамный антибиотик из группы карбапенемов (меронем) и из группы аминогликозидов (амикацин) (табл. 3).
Таблица 2. Чувствительность к антибиотикам микробных штаммов, выделенных из крови
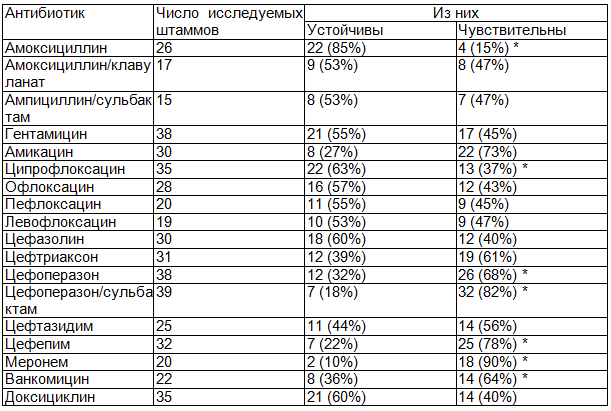
Примечание: * - р<0,05.
Таблица 3. Чувствительность к некоторым антибактериальным препаратам бактерий, выделенных из крови у больных острыми лейкозами (%)
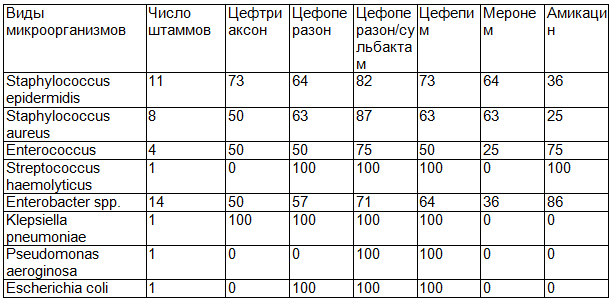
Наибольшей активностью к исследуемым штаммам микроорганизмов обладал цефалоспорин III поколения цефоперазон/сульбактам, который проявил активность как в отношении грамположительных, так и грамотрицательных бактерий. Так, эффективность цефоперазон/сульбактама против Staphylococcus epidermidis и Staphylococcus aureus составила 82% и 87% соответственно. В 75% случаев цефоперазон/сульбактам был эффективен против Enterococcus и в 71% - против Enterobacter spp.
В четырёх случаях бактериемий, возбудителями которых явились Streptococcus haemolyticus, Klepsiella pneumonia, Pseudomonas aeroginosa и Escherichia coli также наблюдалась высокая чувствительность к данному антибиотику.
Также активность против грамположительных и грамотрицательных микроорганизмов проявили и другие антибиотики из группы цефалоспоринов – цефтриаксон, цефоперазон и цефепим. Так их эффективность против стафилококков варьировала от 50% до 73%, против энтеробактерий – от 50% до 64%.
Достаточно высокой активностью в отношении исследуемых штаммов микроорганизмов обладал антибиотик из класса карбапенемов – меронем. Так, его эффективность была исследована в основном против стафилококков, которая составила 50-55%, против грамотрицательных палочек - 36%. Антибиотик из группы аминогликозидов – амикацин, учитывая спектр его активности, проявил высокую эффективность против грамотрицательных бактерий, которая составила 86%. Учитывая данный факт, не рекомендуется применение амикацина в качестве монотерапии для лечения инфекционных осложнений у больных острыми лейкозами во время нейтропении.
Выводы
- В структуре возбудителей бактериемий преобладают грамположительные микроорганизмы.
- Среди грамположительных микроорганизмов, выделенных из крови у больных острыми лейкозами, преобладают стафилококки, из которых наиболее часто идентифицируются условно-патогенные штаммы Staphylococcus epidermidis.
- Самыми эффективными антибактериальными препаратами для лечения бактериемий у больных острыми лейкозами во время нейтропении оказались цефалоспорины - цефоперазон/сульбактам и цефепим.
