Одна из наиболее важных проблем современной медицинской науки и практического здравоохранения – контроль внутрибольничных инфекций. Их возбудителями являются в основном условно-патогенные микроорганизмы, полирезистентные ко многим антибиотикам, антисептикам и дезинфектантам [1,4,6,7,8].
Широко распространенные в настоящее время антимикробные препараты, в том числе антибиотики, являются, как правило, неэффективными при лечении вирусных инфекций. Это, прежде всего, связано с отсутствием у вирусов собственных метаболических путей, ведущих к получению энергии и синтезу строительного материала. Поэтому химиопрепараты, блокирующие определенные жизненно важные для того или другого микроорганизма метаболические реакции, ферменты, катализирующие эти реакции, не оказывают ингибирующего действия на внеклеточные вирионы. В то же время различные вещества, являющиеся ингибиторами репликации ДНК или процессов транскрипции и трансляции информации на рибосомы, могут оказывать ингибирующее действие при репродукции вирусных частиц в клетке хозяина. Вследствие того, что многие из этих веществ подавляют жизнедеятельность самой клетки, их нельзя использовать в качестве химиотерапевтических средств [5,6,10,11]. Поэтому поиск новых противовирусных препаратов представляется весьма актуальным.
В связи с вышеизложенным, мы обратили внимание на ФарГАЛС, это новый биотехнологический препарат, который характеризуется антимикробной активностью. Однако в литературе имеются лишь ограниченные сведения о его антибактериальном и противогрибковом действии, но нет совсем сведений о противовирусной активности [3].
Целью настоящего исследования явилось изучение антимикробной активности нового биотехнологического препарата ФарГАЛС в отношении широкого ряда бактерий, грибов, а также вирусов гепатита B и C и определение перспектив его применения для профилактики и лечения нозокомиальных инфекций.
Материал и методы исследования
Препарат ФарГАЛС (FarGALS) входит в фармакотерапевтическую группу: «антисептические и ранозаживляющие средства», зарегистрирован Фармкомитетом Минздрава Республики Узбекистан и разрешен к клиническому применению. Он представляет собой стерильную водную вытяжку из среды культивирования автотрофных железоокисляющих бактерий и имеет вид красноватой жидкости с кислой реакцией (рН 3,0). Препарат не оказывает раздражающего действия на ткани и предназначен для наружного применения. Однако в настоящее время изучается возможность его использования внутрь (per os) [3].
Антимикробную активность препарата определяли методом диффузии в агар [1]. В качестве тест-культур использовали широкий спектр представителей гноеродной микрофлоры (табл. 1), штаммы возбудителя гастродуоденальных заболеваний Helicobacter pylori, а также грибы рода Candida. При тестировании микроорганизмов применяли соответствующие питательные среды: для бактерий – агар Мюллера-Хинтона, для грибов рода Candida – среду Сабуро, для H. pylori – кровяной сердечно-мозговой агар (производство “HiMedia”, Индия) [1, 2]. При этом чашки Петри с питательной средой засевали микробной взвесью суточной тест-культуры в физиологическом растворе с концентрацией 108 микробных тел/мл, подсушивали и вырезали в агаре лунки диаметром 7 мл и помещали в них по 0,01 мл препарата ФарГАЛС в 5 повторностях. Затем чашки инкубировали при 37° С в течение 24-48 ч. (H. pylori – 96 ч.). Учет полученных результатов заключался в измерении диаметров зон ингибиции роста тест-культур вокруг лунок. При зонах до 10 мм включительно культуры считали устойчивыми, при зонах 11-14 мм – умеренно-устойчивыми, при зонах 15 мм и выше - чувствительными [1].
В качестве объекта для исследования при изучении противовирусной активности ФарГАЛСа использовали образцы плазмы периферической крови. Забор крови проводили с помощью вакуумных пробирок, содержащих 3% раствор ЭДТА из расчета 1:20. Для получения плазмы пробирки с кровью центрифугировали в течение 20 мин при 1500 об/мин. Полученную плазму в объеме 1 мл переливали в пробирки объемом 1,5 мл и хранили при - 20º С.
Всего изучено 20 образцов плазмы крови. Из них 8 образцов содержали вирусы гепатита В, 8 - вирусы гепатита С, 4 образца не содержали маркеров вирусных гепатитов. Соотношение плазмы и препарата ФарГАЛС составляло 4:1, т.е. к 800 мкл образца добавляли по 200 мкл препарата. В качестве контроля использовали стерильный физиологический раствор, добавляемый к плазме в том же соотношении. Наличие РНК вируса гепатита С и ДНК вируса гепатита В в клиническом материале, проводили с помощью метода полимеразной цепной реакции (ПЦР) с гибридизационно-флуоресцентной детекцией в режиме «реального времени» (Real Time PCR) [9,10]. При тестировании образцов использовали наборы реагентов «АмплиСенс HCV-Монитор-FRT», «АмплиСенс HBV-Монитор-FRT» (ФГУН Центральный научно-исследовательский институт эпидемиологии, Москва, Россия) до обработки ФарГАЛСом и через 30 минут после обработки.
Клиническую эффективность ФарГАЛСа изучали при лечении взрослых пациентов (30 чел.) с послеоперационными гнойно-воспалительными процессами. В качестве контроля использовали больных с аналогичной патологией, леченных традиционными методами. Препарат применяли в виде апликаций (в нативном или разведенном дистиллированной водой в соотношении 1:1 виде), 1-2 раза в сутки. Продолжительность лечения составляла от 3 до 10 суток (в зависимости от площади поражения).
Результаты и обсуждение
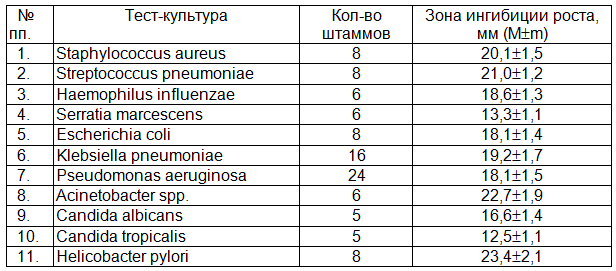
Результаты тестирования антимикробной активности ФарГАЛСа в отношении бактерий и грибов представлены в табл. 1.
Из таблицы следует, что препарат ФарГАЛС оказывал антимикробное действие на все испытанные микроорганизмы, однако выраженность этого действия была различной. В отношении большинства культур препарат демонстрировал высокую активность (зона ингибиции микробного роста больше 15 мм) и лишь в отношении S. marcescens и C. tropicalis активность оказалась умеренной (зона ингибиции меньше 15 мм). Необходимо отметить высокую чувствительность к препарату полирезистентных штаммов K. pneumoniaе и Ps. aeruginosa, являющихся наиболее проблемными возбудителями раневых инфекций в хирургической клинике. Обращает также на себя внимание высокая чувствительность к ФарГАЛСу H. pylori (возбудитель гастритов и язвенной болезни желудка и 12-перстной кишки), превышающая таковую других испытанных культур.
Таблица 1. Антимикробная активность препарата ФарГАЛС
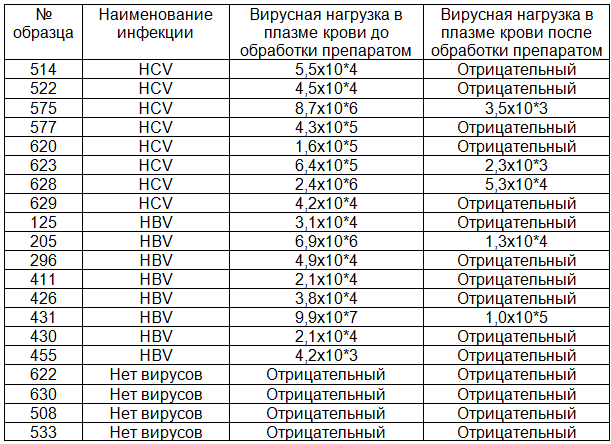
Результаты изучения противовирусной активности представлены в табл. 2. Из 8 проб с HCV в 5 (62,5%) вирусы отсутствовали, а в оставшихся 3 (37,5%) пробах вирусная нагрузка оказалась существенно (на 2-3 порядка) снижена по сравнению с исходным уровнем. Из 8 образцов с HBV в 6 (75,0%) вирусы не были обнаружены, а в остальных 2 (25,0%) пробах вирусная нагрузка была ниже исходного уровня на 2 порядка.
Действие препарата на плазму, не содержащую вирусные частицы, не отразилось в виде неспецифических проявлений и не ингибировало внутренний контроль, используемый с каждым образцом, в качестве «контроля качества» выделения нуклеиновых кислот (внутренний контроль входит в набор реагентов для ПЦР).
После контакта образцов плазмы с физиологическим раствором (контроль) вирусная нагрузка практически не изменялась.
Таблица 2. Результаты определения вирусной нагрузки в образцах плазмы крови до и после 30 минут контакта с препаратом ФарГАЛС
Указанные предварительные результаты свидетельствуют о наличии определенной противовирусной активности у ФарГАЛСа в отношении вирусов гепатита B и C, что обуславливает целесообразность продолжения исследований в этом направлении.
Использование ФарГАЛСа у больных при лечении раневых инфекций оказалось весьма эффективным. Улучшение в виде уменьшения отделяемого и очищения раны, отмечалось уже на 2-3 сутки применения препарата, тогда как при традиционной терапии аналогичные изменения наблюдались в основном на 3-5 сутки. Положительный результат зарегистрирован в отношении всех пролеченных больных. При этом данный препарат использовался в качестве монотерапии.
Наряду с клинической эффективностью важно отметить и высокую экономичность применения ФарГАЛСа по сравнению с традиционной терапией (снижение расходов в среднем на 30%).
Таким образом, препарат ФарГАЛС обладает выраженной антимикробной активностью против широкого спектра болезнетворных микроорганизмов, включая полирезистентные штаммы ведущих возбудителей нозокомиальных инфекций K.pneumoniaе и Ps.aeruginosa, а также H.pylori и грибы рода Candida. Представленные предварительные результаты свидетельствуют о достаточно высокой вирулоцидной активности ФарГАЛСа в отношении вирусов гепатита B и C, что обуславливает целесообразность продолжения исследований в этом направлении.
Антимикробная активность препарата коррелировала с его клинической эффективностью при лечении послеоперационных гнойных ран. Поэтому данный препарат может найти широкое применение в качестве антимикробного агента при лечении и профилактике различных гнойно-воспалительных процессов, микотических поражений и других инфекционных заболеваний. Высокая активность препарата против H. pylori обуславливает целесообразность его дальнейшего изучения для определения возможности использования при гастродуоденальных заболеваниях, ассоциированным с этим возбудителем.
Выводы
- Установлена высокая антимикробная активность нового биотехнологического препарат ФарГАЛС против широкого спектра болезнетворных микроорганизмов, включая полирезистентные штаммы K.pneumoniaе и Ps.aeruginosa, а также H. pylori и грибы рода Candida.
- Предварительные результаты свидетельствуют о достаточно высокой вирулоцидной активности ФарГАЛСа в отношении вирусов гепатита B и C, что обуславливает целесообразность продолжения исследований в этом направлении.
- Антимикробная активность препарата ФарГАЛС коррелирует с его клинической эффективностью при лечении послеоперационных гнойных ран.
- ФарГАЛС может найти применение при лечении и профилактике различных гнойно-воспалительных процессов, микотических поражений и других инфекционных заболеваний. Высокая активность препарата против H. pylori обуславливает целесообразность его дальнейшего изучения для использования при гастродуоденальных заболеваниях, ассоциированным с этим возбудителем.
