Актуальность. Ювенильный ревматоидный артрит (ЮРА) относится к числу наиболее тяжелых и социально значимых форм хронической патологии у детей. Высокая частота встречаемости по сравнению с другими ревматическими заболеваниями детского возраста, тенденция к ранней инвалидизации и возможность системных проявлений с вовлечением в патологический процесс внутренних органов диктуют необходимость более тщательного и комплексного обследования и подбора адекватной терапии. одно из наиболее частых и инвалидизирующих ревматических заболеваний у детей [3, 8]. Заболеваемость ЮРА составляет 2-16 случаев на 100000 детского населения в возрасте до 16 лет. По данным МЗ РФ распространенность ЮРА на территории у детей в возрасте до 18 лет составляет 62,3 на 100 тыс. детского населения [3, 8]. Смертность составляет 0,5-1%. Ультразвуковая оценка органов брюшной полости позволила выявить такие сопутствующие изменения, не являющиеся специфическими для данного заболевания, как дискинезии желчевыводящих путей, реактивные изменения паренхимы печени, селезенки и поджелудочной железы, жировую инфильтрацию печени, гастродуодениты [4]. Выявленные изменения со стороны органов пищеварения в основном были обусловлены противоревматической терапией. Гепатотоксичность используемых в ревматологии препаратов приводит с замедлению процессов биотрансформации экзо- и эндобиотиков, накоплению их в циркулирующей крови и развитию эндогенной интоксикации, что может привести к интенсификации перекисного окисления липидов (ПОЛ), усугублению патологического процесса и токсичности используемых препаратов [2, 10].
Цель исследования: выяснить клинико-биохимические проявления лекарственно-индуцируемых гепатитов (ЛИГ) и их связь с проявлениями эндогенной интоксикации у больных с ЮРА.
Материал и методы исследования. Обследован 91 больной с суставной формой ЮРА с олиго- (18 пациентов) и полиартритическим (73 детей) вариантами.
Из 91 больных 50 были мальчики и 41 девочки в возрасте от 4 до 16 лет. Продолжительность заболевания составляла от 1 года до 10 лет. Из анамнеза удалось выяснить, что у 64 (70,3%) детей, развитию ЮРА способствовали триггерные факторы, среди которых на первом месте стоят острые респираторные заболевания.
Отягощенный перинатальный анамнез выявлен у 70 (76,9%) детей и у 21 (23,1%) из всех больных имели отягощенный анамнез по ревматическим заболеваниям. Практически здоровыми до возникновения ЮРА считались 35 (38,5%) детей.
Диагноз ЛИГ устанавливали согласно Лос-Анджелской классификации [12], при этом у 59 детей выявлены ЛИГ (основная группа), а 32 детей с ЮРА без поражения печени составили группу сравнения.
Критериями включения были отсутствие ранее перенесенных заболеваний гепатобилиарной системы, отсутствие антител к вирусам гепатитов В и С, которые определяли иммуноферментным методом. Лечение ЮРА проводили с учетом тяжести воспалительного процесса, индивидуальными особенностями организма детей согласно стандартам лечения. Базисными средствами были нестероидные противовоспалительные препараты (НПВП), плаквинил, преднизолон и в тяжелых случаях назначали цитостатики - метотрексат.
Ультразвуковое исследование (УЗИ) гепатобилиарной системы проводили на аппарате SSD-630 “Aloka” (Япония).
Активность ферментов аланинаминотрансферазы (АлАТ), гамма-глутамилтрансферазы (ГГТ) и щелочной фосфатазы (ЩФ), содержание общего белка, альбуминов, билирубин и его фракции, общий холестерин, тимоловую пробу определяли на автоматизированном комбайне “Autohumolizer F1” (“Human”, Германия) c помощью специальных наборов реактивов.
Уровень малонового диальдегида (МДА) определяли по методу А.И. Андреевой и др. [1].
Степень эндогенной интоксикации оценивали по уровню молекул средней массы (МСМ) [9]. Статистическая обработка полученных данных проводилась на персональном компьютере с помощью пакета прикладных программ «Microsoft Office» и «Statistica 6.0».
Результаты исследования. Проведенные исследования показали, что из 91 больных у 59 (64,8%) выявлены поражения гепатобилиарной системы. Согласно классификации, острые медикаментозные гепатиты подразделяются на цитолитические, холестатические и смешанные формы, сочетающие признаки холестаза и цитолиза. Фактором, способствующим переходу гепатита в хронический, является длительный прием лекарств. Согласно данной классификации у 30 был выявлен реактивный гепатит, из них с признаками цитолиза у 16 (цитолитический), цитолиза и холестаза – 14 (смешанный), у 7 – холестатический вариант, у остальных 22 пациентов – признаки хронического гепатита. По данным ультразвуковой диагностики, у 8 из 13 детей наблюдалось увеличение размеров печени (+1-1,5 см), у 9 - небольшое повышение эхогенности паренхимы печени, и у 5 - усиление сосудистого рисунка. В основном поражения печени при УЗИ характеризовались диффузными изменениями паренхимы печени, повышенной эхогенностью, реактивным гепатитом и гепатомегалией. В редких случаях отмечались уплотнение печени с явлениями фиброза.
Биохимическими исследованиями установлено повышение аминотрансфераз у 9 (15,2%), ГГТ и ЩФ – у 21 (35,6%), гипербилирубинемия – у 38 (64,4%) и прямого билирубина – у 10 (16,9%). У 44 (74,6%) детей выявлены признаки гепатодепрессии, проявляющиеся гипоальбуминемией и частично (10, 16,9%) – гипопротеинемией. Повышение тимоловой пробы было отмечено у всех 59 (100%) больных, что свидетельствует о наличии признаков мезенхимального воспаления. Это совпадало с высокой частотой повышенной эхогенности при УЗИ печени, диффузными изменениями в паренхиме печени.
Анализ биохимических показателей сыворотки крови больных ЮРА без вовлечения в патологический процесс печени показал достоверное снижение уровня альбуминов в 1,17, повышение активности АлАТ в 1,17 раза на фоне сохранения нормативных величин активности ГГТ (табл. 1).
Уровень прямого билирубина достоверно возрос в 1,63 раза, на фоне сохраняющихся нормативных значений общего и непрямого билирубина. Особо следует отметить повышение тимоловой пробы в 1,58 раза.
Таблица 1. Биохимические показатели сыворотки крови больных ЮРА, M±m
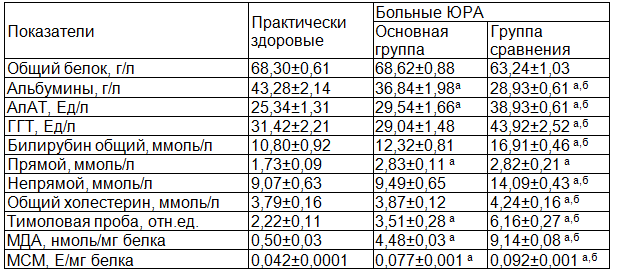
Примечания: а - различия между показателями практически здоровых лиц и ЮРА, достоверны, б – различия между показателями больных детей ЮРА без и с поражением печени достоверны.
В то же время у больных ЮРА с поражением печени отмечены более выраженные изменения биохимических показателей сыворотки крови. Так, содержание альбуминов достоверно снижалось в 1,5 и 1,27 раза, повышение АлАТ – в 1,54 и 1,32 раза, ГГТ – в 1,4 и 1,51 раза, соответственно значениям практически здоровых лиц и группы ЮРА без наличия поражений печени. При этом содержание общего, прямого и непрямого билирубина статистически значимо возрастало в 1,56; 1,63 и 1,55 раза относительно нормативных величин, общего и непрямого билирубина – в 1,37 и 1,55 раза относительно показателей группы детей с ЮРА без поражения печени. Резко возрастал показатель тимоловой пробы, превышая значения практически здоровых лиц и группы больных без поражения печени в 2,77 и 1,75 раза, соответственно.
Отмечался большой разброс исследуемых показателей, что, на наш взгляд, связано с широким спектром используемых препаратов. Наибольшие изменения были характерны для больных с использованием комплекса НПВП, преднизолона, плаквенила и метотрексата. Так, длительный прием НПВП приводит к идиосинкразическому типу поражения гепатоцитов [7]. Образующиеся метаболиты под действием микросомальных оксидаз, блокируют процессы переноса электронов по дыхательной цепи митохондрий, нарушая процессы окислительного фосфорилирования [5]. Нарушение процессов окислительного фосфорилирования и микросомального окисления приводят к активизации перекисного окисления липидов, дезорганизации мембран гепатоцитов и клеток желчных протоков [11]. Действие противомалярийных препаратов связано с образованием гиалиновых телец Мэллори в 3 зоне, обусловливая риск развития стеатоза, а длительный прием глюкокортикоидов вызывает макровезикулярный стеатоз [6].
Поражение печени при лечении метатрексатом обусловлено образованием в микросомах токсичного метаболита, который вызывает фиброз, поражая зону 1 [10]. Выраженность фиброза определяется дозой препарата и длительностью лечения.
Как видно из приведенных данных, по мере увеличения комбинаций препаратов возрастает риск развития ЛИГ. Для выяснения роли ПОЛ в развитии ЛИГ у детей с ЮРА, мы определили уровень МДА в сыворотке крови больных. Проведенные исследования показали повышение его уровня в 8,96 раза у больных с ЮРА без поражения печени, относительно значений практически здоровых детей. Наличие ЛИГ у детей с ЮРА еще больше интенсифицировало ПОЛ. Его значения статистически значимо возросли в 18,28 раза относительно показателей здоровых детей и в 2,04 раза – по сравнению с группой сравнения.
Следовательно, при наличии ЛИГ интенсивность ПОЛ у больных резко возрастает. Это приводит к повышению проницаемости клеточных мембран, вымыванию характерных для тканей соединений в циркулирующую кровь. С другой стороны, лабилизация митохондриальной и микросомальной мембран гепатоцитов под действием токсичных препаратов, приводит к замедлению детоксикации ксенобиотиков и развитию эндогенной интоксикации [10].
В связи с этим мы исследовали содержание МСМ в сыворотке крови больных с ЮРА. Проведенные исследования показали статистически значимое повышение в 1,83 раза уровня МСМ у детей с ЮРА без поражения печени. В группе детей с поражением печение, содержание МСМ достоверно возросло в 2,19 и 1,2 раза относительно значений практически здоровых детей и больных ЮРА без ЛИГ. Полученные нами данные совпадают с выраженностью клинических проявлений у детей с ЛИГ. Дети данной группы чаще жаловались на головные боли, недомогание, снижение аппетита, более четко проявлялся астеновегетативный синдром и др. с высокой частотой они выявлялись у детей, получавших сочетание нескольких препаратов, особенно в сочетании с цитостатиками.
На основании полученных данных можно сделать следующие выводы:
- Из 91 детей с ЮРА в 64,8% случаях развивается ЛИГ. В 24,2% случаев он проявляется признаками хронического гепатита, в 17,6% цитолитическим, в 7,7% - холестатическим и в 15,4% - смешанным вариантами острого ЛИГ. Во всех случаях выявлены признаки мезенхимального воспаления, 74,6% - гипоальбуминемия, 64,4% - гипербилирубинемия, 35,6% - холестаз и в 15,2% установлен цитолиз.
- У детей с ЮРА выявлена интенсификация ПОЛ. Без наличия ЛИГ уровень МДА возрастает в 8,96 раза, с наличием ЛИГ – в 18,28 раза. Выраженность липопероксидации зависит от тяжести поражения печени и комбинации использованных препаратов.
- У детей с ЮРА с и без наличия ЛИГ развивается эндогенная интоксикация, проявляющаяся повышением содержания МСМ в 1,83 и 2,19 раза, соответственно группам. Клинически они проявляются депрессией, головными болями, недомоганием, астенизацией и др., особенно у детей с поражением печени.
