Постменопаузальный остеопороз является системным метаболическим заболеванием, для которого характерно снижение плотности кости, приводящее к переломам. Большой интерес к этой проблеме в настоящее время вызван, прежде всего, высокой распространенностью среди населения, как самого заболевания, так и его последствий – переломов конечностей и позвоночника. Это приводит к временной и стойкой нетрудоспособности, к ограничению движения, к потере возможности самообслуживания и в целом снижению качества жизни, а также к повышенной смертности. Экономические затраты больного, его семьи и общества в целом огромны.
В костном ремоделировании запрограммирована определенная последовательность. Соотношение между резорбцией костной ткани и формированием новой регулируется ионами кальция, паратиреоидным гормоном, кальцитонином, метаболитами витамина Д, а также половыми и тиреоидными гормонами, глюкокортикостероидами, гормоном роста, инсулином, простагландинами и соответствующим местным действием цитокинов [4].
В патогенезе постменопаузального остеопороза пусковым фактором является эстрогенная недостаточность, вызывающее резкое ускорение потери костной массы. Точный механизм влияния гипоэстрогенемии на снижение массы кости еще не выяснен. Предполагается, что недостаток эстрогенов способствует снижению секреции кальцитонина и повышению чувствительности кости к резорбтивному действию паратиреоидного гормона [5].
Вместе с тем, в литературе отсутствуют сведения о роли печени в формировании остеопоретических поражений кости в постменопаузе. Недостаточно изучено особенности липидного спектра у женщин с остеопеническими нарушениями в постменопаузе.Исследованиями показана, что при болезнях печени снижается процесс образования костной ткани и увеличивается процесс ее резорбции, особенно выражены эти процессы при хронических заболеваниях печени с холестазом.
Исходя из вышеизложенного, целью данного исследования является изучение взаимосвязи между холестатической болезнью печени и уменьшением плотности минералов кости у женщин в постменопаузальном периоде.
Материал и методы. Обследовано 78 женщин в постменопаузальном периоде, которые на основе двухэнергетической рентгеновской абсорбциометрии (метод денситометрии) поясничного отдела позвоночника, были разделены на 3 группы:
1 группа (18 женщин) – с нормальной костной массой,
2 группа (34 женщин) – с остеопенией,
3 группа (26 женщин) – с остеопорозом не осложненной формы.
При формировании групп мы придерживались диагностических критерий ВОЗ по состоянию МПК тканей:
- снижение МПК в пределах I стандартного отклонения SD является нормой;
- остеопения – величина МПК снижена более 1, но менее 2,5 SD;
- остеопороз – величина МПК снижена на 2,5 и более SD.
Возраст пациенток составил 45–65 лет (55,2±4,73), длительность менопаузы от 2 до 14 лет (8,4±1,53). Группу контроля составили 12 практически здоровых лиц, сопоставимые по полу и возрасту.
Критериями исключения в основную группу были – сердечно- сосудистые заболевания, сахарный диабет, бронхиальная астма, почечная и онкологическая патология, вирусный гепатит.
У всех обследуемых содержание свободных жирных кислот в сыворотке крови определяли с помощью новой тест – системы NEFE FS фирмы «Dia Sys» (Германия) на автоматическом анализаторе фирмы «HUMAN», общую активность ферментов ГГТ, ЩФ, на автоматическом анализаторе фирмы «HOSPITAX», используемые наборы были фирмы «HUMAN». В качестве маркерных ферментов для митохондрий определяли малатдегидрогеназу (оптический метод Варбурга). Содержание 25 – гидроксихолекальциферола исследовали методом ИФА, с использованием наборов компании «IDS» поставляемой компанией «Био Хим Мак» (Россия). Содержание гиалуроновой кислоты определяли методом ИФА, с использованием наборов компании «BCM Diagnostic». Для определения альфа-глутатион- S-трансферазы – наборы фирмы «Biotrin», поставляемые компанией Био Хим Мак. Оптическую плотность образцов оценивали с помощью планшетного ридера при длине волны 450 нм. Липиды выделяли по Фолчу [6] и фракционировали модифицированным методом, позволяющим количественно определить уровень фосфолипидов в сыворотке крови.
Статистическую обработку данных осуществляли методом вариационной статистики, с применением t–критерия Стьюдента.
Результаты и их обсуждение. Как известно, синтез и секреция С–реактивного белка происходит в печени и регулируется провоспалительными цитокинами (ИЛ–6, ИЛ–1, ФНО 2 и др.). Уровень С–реактивного белка позволяет прогнозировать прогрессирование и исходы воспалительного процесса при развитии остеопороза. Поэтому С–реактивный белок называют белком острой фазы воспаления, или маркером костного метаболизма [1, 2]. Как видно из представленных результатов исследования (табл. 1) повышение концентрации С–реактивного белка у обследуемых наблюдается в группе с остеопенией и особенно высокие значения отмечены при остеопорозе.
Таблица 1. Биохимические показатели крови у женщин с посменопаузальным остеопорозом
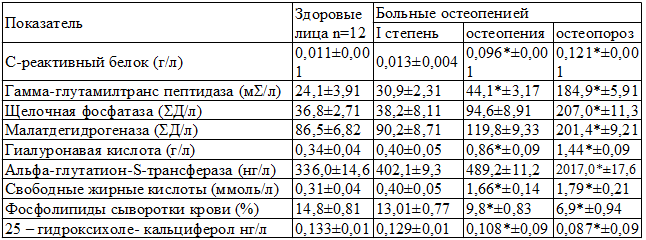
Примечание: * - достоверность различий P<0,05
В последние годы в клинической химии подобающее место заняло определение активности гамма – глутамил транспептидазы. Последний содержится основном в мембранах эпителиальных клеток выстилающих желчные пути, печеночных канальцах итд. Поэтому наиболее частая причина повышения активности ГГТ в сыворотке крови, это патология печени. Более выраженное повышение активности фермента связано с внепеченочной и внутрипеченочной обструкцией. Анализ полученных результатов показал на достоверный рост активности ГГТ, в группе женщин с остеопорозом, в среднем 7,7 раз (P<0,05), что в свою очередь указывает на нарушение желчеобразовательной и желчевыделительной функции печени.
Активность щелочной фосфатазы в сыворотке крови часто повышена при обструктивных заболеваниях желчевыводящих протоков. Наблюдаемое 2–3 кратное повышение активности ЩФ в крови у женщин с остеопенией, видимо обусловлено внутрипеченочной обструкцией желчных путей, а в группе с остеопорозом активность фермента повышается 5,5 раз, что видимо, обусловлено активным остеопорозом и последующей остеомаляцией.
Следовательно, у женщин с постменопаузальным остеопорозом мы наблюдаем повышение в плазме крови ГГТ и ЩФ, обусловленной активацией желчными кислотами синтеза и экстракцию фермента с плазматической мембраны гепатоцитов, и тем самым поступление фермента в циркуляцию, что указывает на внутрипеченочный и внепеченочный холестаз. Последнее связано с нарушением целостности клеток желчных канальцев.
Сравнительный анализ количественных характеристик свободных жирных кислот в сыворотке крови у обследуемых лиц, с таковыми у здоровых лиц показало достоверные различия выраженные при остеопенических нарушениях и особенно при остеопорозе. Как известно, попадая в системный кровоток свободные жирные кислоты способствуют усилению состояния инсулинорезистентности, подавляют процесс гликолиза [3]. Последний приводит компенсаторной активации пентозофосфатного цикла и процесса глюконеогенеза, т.е. при этом малат используется для синтеза глюкозы и жирных кислот. Как видно из полученных результатов исследования, у женщин с постменопаузальным остеопорозом мы наблюдаем повышение активности малатдегидрогеназы в сыворотке крови в 2,3 раза, что видимо обусловлено нарушением структуры митохондрий гепатоцитов и выходом в кровь митохондриального фермента.
Известно, что гиалуроновая кислота, являясь гликозаминогликаном, выполняет структурную функцию в соединительнотканном матриксе. У здоровых лиц гиалуроновая кислота через лимфатическую систему переходит в плазму и разрушается ферментом гиалуронидазой синусоидальными эндотелиальными клетками печени. При хронических заболеваниях печени механизм нарушается, что приводит к возрастанию уровня гиалуроновой кислоты в крови. В наших исследованиях мы наблюдали повышение уровня гиалуроновой кислоты в сыворотке крови у женщин с остеопенией в 2,5 раза, с остеопорозом в 4 раз по сравнению со здоровой группой, что указывает на патологические изменения в синусоидальных эндотелиальных клетках печени.
На поражение гепатоцитов при постменопаузальном остеопорозе указывало также повышение активности цитоплазматического фермента – альфа глутатион–S–трансферазы в 6 раз (P<0,05).
В процесс костеобразования (кальцификации) вовлечен клеточный продукт – везикулы внутриклеточного матрица. Последние содержат в больших концентрациях фосфолипиды и щелочную фосфатазу. Везикулы попав во внеклеточное пространство начинают аккумулировать кальций и фосфор. При этом кальций связывается с кислыми фосфолипидами и гликозаминогликанами, тогда как фосфор аккумулируется за счет воздействия щелочной фосфатазы на пирофосфаты. Вслед за этим внутри везикул образовывается аморфный фосфат кальция, подвергающийся последовательной модификации в оксиапатит. Следовательно, фосфолипиды и гликозаминогликаны являются своего рода затравкой для пролиферации оксиапатита.
Анализ полученных результатов исследования показал на достоверное снижение содержания общего фосфолипида в сыворотке крови соответственно на 34% при остеопении и в 2 раза при постменопаузальном остеопорозе. Следовательно, у женщин с постменопаузальным остеопорозом наблюдается не только холестатический синдром, но также и нарушение липидного и углеводного обмена.
Необходимо отметить, что функция митохондрий гепатоцитов не заканчивается процессом образования энергии. В ней совместно с микросомальным ферментом (25 – гидроксилаза) преобразуется витамин Д3 в 25 – гидрокси витамин Д3. Как видно из результатов исследования, содержание предшественника активного витамина Д – 25-ОН Д3 у обследуемых женщин снижается, особенно у женщин с постменопаузальным остеопорозом, что указывает на субклинический дефицит витамина Д, что является одной из причин нарушения обмена кальция и фосфора.
Выводы
1. У женщин с постменопаузальным остеопорозом и остеопеническими нарушениями отмечено нарушение функционального состояния печени, выражающиеся холестатическим синдромом.
2. В развитии постменопаузального остеопороза немаловажную роль играют нарушение липидного, углеводного обмена и синтеза активного витамина Д.
