Несмотря на многолетний опыт хирургического лечения диффузного токсического зоба (ДТЗ), оперативное вмешательство при этом виде патологии может привести к развитию тяжелых послеоперационных осложнений. Особое место среди них по частоте, тяжести проявления и сложности профилактики занимает послеоперационный гипопаратиреоз [6]. В механизме возникновения этого осложнения большое значение придают операционной травме паращитовидной железы а также отеку, нейрососудистым и микроциркуляторным дисфункциям, как проявлению повреждения питающих сосудов. В редких случаях причиной гипопаратиреоза может быть некроз околощитовидных желез в результате сдавления их рубцами в позднем послеоперационном периоде [13].
Повреждение возвратных гортанных нервов - другое распространенное осложнение при оперативном лечении ДТЗ. Достаточно часто травма нерва не бывает связана с его пересечением, а вызывается посттравматическим воспалением его оболочек или сдавлением рубцами в послеоперационном периоде. В большинстве случаев эти явления сопровождаются парезом гортани [11]. Формирование послеоперационного воспаления усиливается под влиянием IL-1 и других провоспалительных цитокинов и хемокинов. Цитокины определяют завершение воспалительного процесса. Развитие грубых рубцов, связанное с повышенным образованием грануляционной ткани, контролируется несколькими факторами роста (трансформирующим фактором роста - TGF-ß; эпидермальным фактором роста; кислым и основным факторами роста фибробластов; инсулиноподобным фактором роста 1; кератиноцитарным фактором роста) [7].
Применяемые в настоящее время меры профилактики осложнений при хирургическом лечении ДТЗ направлены главным образом на предупреждение тромботических осложнений и не могут препятствовать остальным факторам риска, приводящим к послеоперационному гипопаратиреозу или парезу гортани. Следовательно, важную профилактическую роль, наряду с предотвращением воспалительного отека тканей в зоне вмешательства и тромбоза сосудов, питающих паращитовидные железы, играет уменьшение продукции провоспалительных цитокинов и факторов роста. Такими свойствами обладает системная энзимотерапия (СЭТ) [3,8,15,12,14]. Препарат СЭТ «Флогэнзим»® содержит протеолитические ферменты растительного и животного происхождения, которые уменьшают отек, снижают явления агрегации тромбоцитов, связывают цитокины, ускоряют репаративные процессы [4]. Таким образом, СЭТ способствует уменьшению воспалительного процесса на всех его стадиях [14,15]. При непосредственном участии энзимов, входящих в состав флогензима снижается выраженность медиаторной атаки в зоне воспаления и уменьшается степень повреждения тканей. Под влиянием его компонента рутина стабилизируется проницаемость сосудистой стенки, что в свою очередь обеспечивает восстановление микроциркуляции и ликвидацию отёка [16] .
Цель работы: Исследовать уровень провоспалительных цитокинов (IL-1ß; IL-6; IL-8) и трансформирующего фактора роста (TGF-ß) в сыворотке периферической крови в до- и послеоперационном периоде у пациентов с ДТЗ и ДТЗ с узлами. Оценить влияние препарата СЭТ (флогэнзим) на изменение уровня провоспалительных интерлейкинов и трансформирующего фактора роста в послеоперационном периоде у этой категории больных.
Материалы и методы: Под наблюдением на отделении эндокринной хирургии СЗОМЦ РФ СПб находилось 58 пациентов, которым была выполнена ТЭ по поводу ДТЗ или ДТЗ с узловой трансформацией. Из них женщин 53 (91,4%), мужчин 5 (8,6%). Возраст больных колебался от 19 до 65 лет. Все пациенты были разделены на 2 группы: основная группа 31 человек, которые на следующие сутки после операции принимали «Флогэнзим»® в дозировке по 3 таблетки 3 раза в день в течение 7 дней. Контрольная группа составила 27 человек. Пациенты основной и контрольной групп не различались по возрасту и полу. Иммунологические исследования проводили накануне выполнения операции и на 1 и 7 сутки после вмешательства. Изучение уровней IL-1ß, IL-6, IL-8, в сыворотке проводили количественным твердофазным иммуноферментным методом с использованием тест-систем для цитокинов человека ООО «Цитокин» (Санкт-Петербург) согласно инструкции производителя. Трансформирующий фактор роста (TGF-ß) определяли методом иммуноферментного анализа с помощью оригинальных наборов (R&D Sistems, Inc. США).
Общеизвестно, что основным признаком любого вида воспаления является повышение температуры тканей в зоне его возникновения, а величина гипертермии отражает степень развития воспаления, поэтому для регистрации воспалительных изменений в зоне оперативного вмешательства использована неинвазивная методика термографии (тепловизионного исследования) [2,9]. В обеих группах на 3 и 5 сутки после операции проводили тепловизионную диагностику операционной раны путем измерения температуры кожного покрова в зоне проведения операции, с помощью аппарата - тепловизор i60, компании FLIR Systems. Тепловизионные фотографии обработаны с помощью программы FLIR QuickReport 1.2.SP2.
Статистические расчеты проводили при помощи пакета Statistika V. 6.0 (StatSoft inc.). Рассчитывали средние величины, стандартное отклонение, их средние стандартные ошибки с оценкой различий для независимых выборок по критерию Манна-Уитни, для зависимых выборок при анализе повторных изменений использовался критерий Вилкоксона. Для оценки динамики интерлейкинов в каждой группе использовали ранговый дисперсионный анализ (Кэндалл) по χ2. Температурные значения тепловизионной диагностики для зависимых выборок оценивали по парному критерию Стьюдента, для независимых – по 2-х выборочному критерию Стьюдента.
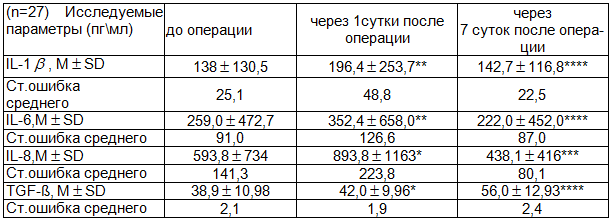
Результаты и обсуждение. Концентрация провоспалительных интерлейкинов до операции в обеих группах превышала норму в 3-10 раз. Это обусловлено тем, что провоспалительные цитокины играют важную роль в развитии аутоиммунных заболеваний щитовидной железы. Так наряду с - интерфероном они участвуют в регуляции продукции аутоантител, стимулируют пролиферацию антигенспецифических Т- и В-лимфоцитов, образующих клоны к различным антигенным эпитопам, а также стимулируют синтез гикозаминогликанов в ретроорбитальных фибробластах и модулируют экспрессию на них рецептора к ТТГ, способствуя развитию офтальмопатии при ДТЗ [1]. Статистически значимых различий в обеих группах до оперативного вмешательства выявлено не было (р>0,05), за исключением IL-6 в контрольной группе, где сывороточный уровень его был незначительно выше чем в основной группе (р<0,05). Межгрупповые различия уровней провоспалительных цитокинов до операции были незначительны и, вероятно, обусловлены индивидуальными различиями. Динамика интерлейкинов в послеоперационном периоде в обеих обследованных группах была различна. На 1 сутки после операции наблюдали значительное увеличение концентраций IL-8 и TGF-ß в контрольной группе (р<0,05; р<0,05 соответственно) и IL-1 и IL-6 в основной группе (р<0,05; р<0,05 соответственно) табл.1. В контрольной группе концентрации IL-1 и IL-6 были также повышены по сравнению с исходными значениями, но эти изменения не были статистически значимы (р>0,05) табл.3. На 7 сутки в контрольной группе сывороточный уровень IL-1 и IL-6 оставался высоким по сравнению с показателями основной группы (р<0,05; р<0,05) табл.1. Концентрация IL-8 в контрольной группе на 7 сутки уменьшилась в 2 раза по сравнению с 1 сутками (р˃0,05), но оставалась выше чем в основной группе, однако это повышение не было статистически значимо (р>0,05) табл.1. Сывороточный уровень TGF-ß к 7 суткам в контрольной группе увеличился в 1,3 раза по сравнению с 1 сутками (р<0,05) табл.3. В основной группе отмечено повышение IL-8 и TGF-ß в 1 сутки после операции, но оно не было статистически достоверным (р>0,05) табл.2. В то же время, концентрация IL-8 на 7 сутки после приема «Флогэнзим»® снизилась в 3 раза и статистически значимо отличалась от концентрации в 1 сутки (р<0,05) табл. 2. На 7-е сутки после операции в группе пациентов, получавших «Флогэнзим»® сывороточный уровень IL-1 также уменьшился в 3 раза, а IL-6 в 8 раз (р<0,05; р<0,05 соответственно) табл.2. Повышение уровня TGF- в основной группе к 7-м суткам не выявлено. В процессе проведения энзимотерапии уже через 1 сутки от начала лечения отмечено значительное уменьшение отека, гиперемии и других клинических признаков воспаления, заметно улучшилось состояние и самочувствие больных.
Таблица 1. Динамика уровня IL и TGF в основной и контрольной группах в до и послеоперационном периоде
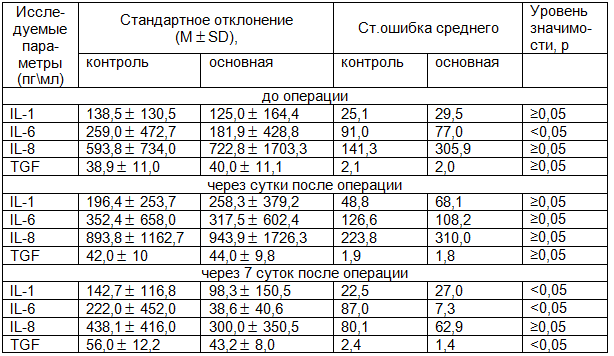
Таблица 2. Уровень IL и TGF в сыворотке больных после операции в основной группе до- и после операции (n=31)
Примечания: здесь и далее *р<0,05 по критерию Вилкоксона (через 1 сутки после операции); **р≥0,05 по критерию Вилкоксона (через 1 сутки после операции); ***р<0,05 по критерию Вилкоксона (на 7-е сутки после операции); ****р≥0,05 -7по критерию Вилкоксона (на 7-е сутки после операции).
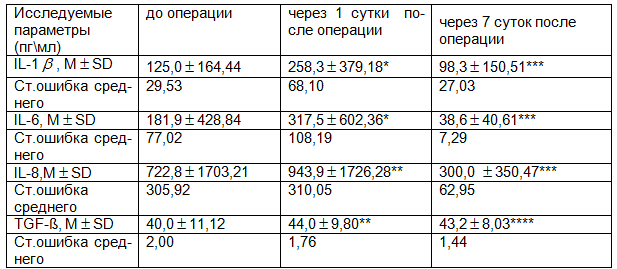
Таблица 3. Уровень IL и TGF в сыворотке крови больных контрольной группы, до- и после операции (n=27)
Из представленных в табл. 1-3 данных следует, что уровень провоспалительных цитокинов (IL-1β, IL-6) в основной группе на 7-е сутки после приема «Флогэнзим»® был значительно меньше чем в контрольной группе (р<0,05; р<0,05). В то же время, в основной группе не наблюдалось статистически значимого повышения TGF-ß на 7-е сутки по сравнению с контрольной группой (р<0,05).
Действие препарата «Флогэнзим»® на течение воспалительного процесса оценивали не только по изменению уровня провоспалительных цитокинов и фактора TGF-ß в сыворотке крови.
Для регистрации воспалительных изменений в зоне оперативного вмешательства использована неинвазивная методика термографии (тепловизионного исследования). В основной группе на 3-и сутки после операции средняя температура кожного покрова в зоне оперативного вмешательства составила 34,17 С. На 5-е сутки после операции значимых изменений температуры не установлено (р>0,05) табл.4.
У больных в контрольной группе средняя температура кожного покрова в зоне операции на 3-и сутки была выше, чем в основной группе и составила 35,3С. На 5-е сутки после операции средняя температура кожного покрова у больных в контрольной группе снизилась, что подтверждено математическими расчетами (р<0,05), но по сравнению с показателем в основной группе оставалась более высокой и составила 34,9С (табл.4).
При статистической оценки изменения динамики температуры кожного покрова в зоне операции в основной и контрольной группах установлено, что в основной группе средняя температура кожных покровов в области проведения операции спустя 3 дня была в среднем на 1,1С (р<0,05) меньше, чем в контрольной группе (табл. 4). На 5-е сутки разница средней температуры кожных покровов в обеих группах уменьшилась и составила всего 0,6С (р<0,05). Это соотносится с литературными данными о том, что явления воспаления, вызванные операционной травмой, постепенно стихают к 5–7 суткам после оперативного вмешательства.
Таким образом, иммунологические и термографические исследования показывают, что применение СЭТ у больных после оперативного лечения ДТЗ существенно снижает уровень воспалительной реакции в зоне оперативного вмешательства. Это может активно влиять на уменьшение уровня послеоперационных осложнений, связанных с воспалительными изменениями и рубцовым процессом в зоне проведения оперативного вмешательства, хотя в группах обследованных нами больных послеоперационных осложнений отмечено не было.
Таблица 4. Динамика изменения температуры кожного покрова в зоне операции у больных в обеих сравниваемых группах
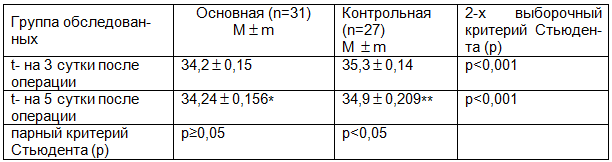
Примечание: *- р>0,05 (динамика температуры в основной группе); **- p<0,05 (динамика температуры в контрольной группе).
Следует отметить, что в связи с проведением оперативного лечения на базе специализированного отделения эндокринной хирургии клинически значимых осложнений в обеих группах не выявлено.
Таким образом, включение СЭТ в комплекс лечебных мероприятий в послеоперационном периоде у больных оперированных по поводу ДТЗ и ДТЗ с узлами снижает уровень провоспалительных цитокинов и трансформирующего фактора, что, вероятно, будет способствовать уменьшению риска послеоперационных осложнений, вызванных посттравматическим воспалительным отеком тканей в зоне оперативного вмешательства.
Выводы
- Применение СЭТ уменьшает уровень провоспалительных интерлейкинов и трансформирующего фактора роста у больных с ДТЗ в послеоперационном периоде.
- Уменьшение уровня TGF-ß под действием СЭТ может способствовать снижению развития рубцовых изменений в зоне оперативного вмешательства после хирургического лечения ДТЗ.
- Установленные противоотечный и противовоспалительный эффекты СЭТ после хирургического лечения ДТЗ, подтверждают целесообразность применения СЭТ в послеоперационном периоде у этой категории больных для уменьшения количества послеоперационных осложнений, связанных с травматическим отеком и развитием рубцового процесса в зоне расположения возвратных гортанных нервов и паращитовидных желез.
