Сахарный диабет (СД) представляет собой наиболее распространённое заболевание органов эндокринной системы, сопровождающееся развитием хронических осложнений: ангио- и нейропатии, – влияющих на качество жизни больных, их социальную адаптацию и часто приводящих к стойкой утрате нетрудоспособности [4, 5, 11].
Роль активации процессов апоптоза, стимулирования перекисного окисления липидов (ПОЛ), низкой эффективности антиоксидантной системы (АОС) в развитии СД 2 типа и его осложнений не вызывают сомнений [2, 3, 5, 8, 13, 20, 24]. Персистенция предиабетических нарушений углеводного обмена ведёт к диагностике хронических осложнений СД уже на этапе его выявления [5, 11].
Наиболее частым хроническим осложнением СД 2 типа является диабетическая полинейропатия (ДПН) [4-6, 11]. По современным представлениям, клинические проявления ДПН наблюдаются более чем у половины больных СД. Частота поражения нервной системы зависит как от степени компенсации углеводного обмена, так и степени оксидативного стресса (ОС) [2, 7, 9, 21, 22].
В развитии ДПН можно выделить 6 основных патогенетических концепций: сосудистая гипотеза (повреждение vasa nervorum), активация полиолового шунта с недостаточностью миоинозитола, роль конечных продуктов гликирования, ОС, дефицит факторов роста нервов, иммунологическая гипотеза [3, 5, 8, 9, 13, 21, 21].
В условиях длительной гипергликемии происходит гликирование альдозоредуктазы, что приводит к повышению её активности и инициированию сорбитолового пути метаболизма глюкозы, сопровождаясь накоплением сорбитола и истощением пула миоинозитола. Процессы гликирования протеинов повышают активность оксидативных факторов и снижают уровень NO [1, 9, 15, 19, 24]. Кроме того, гликированные белки и полинасыщенные жиры склонны к аутоокислению, что ещё в большей мере стимулирует ОС. Угнетение активности супероксиддисмутазы (СОД) приводит к лавинообразному взаимодействию NO с супероксид-анионом, что сопровождается увеличением пероксинитрита, способствующего дальнейшему прогрессированию дисфункции аксонов нейронов и эндотелия [7-9, 15, 19, 21]. Дефицит внеклеточного NO в условиях ОС приводит к вазоконстрикции, усугубляя гипоксию аксонов. Оксидативные реакции ингибируют действие нейрональных факторов роста, а также снижают инсулинопосредованное воздействие на факторы роста нервов, что комплексно усиливает аксональную дегенерацию и демиелинизацию нервных волокон [3, 6, 9, 11, 13, 21]. Известно, что эскалация продуктов ПОЛ, прежде всего, окисленных липопротеинов выявляется на субклинической стадии СД 2 типа и МС, и влияет на формирование ещё недиагностируемых неврологических и сосудистых осложнений [15, 17]. Одним из универсальных путей развития ДПН, одновременно объединяющим все остальные патогенетические звенья этого хронического осложнения СД 2 типа, является ОС. Окислительный стресс – это дисбаланс в организме между прооксидантами и АОС, который в различной степени выраженности сопровождает дисфункцию β-клеток или инсулинорезистентность и ведёт к прогрессированию неврологических осложнений СД 2 типа [6, 13, 21, 22, 24].
Действие различных метаболических корректоров с антиоксидантными свойствами, таких как цитофлавин, направлено на усиление митохондриального окисления глюкозы, ингибирование β-окисления жирных кислот и опосредованное окисление глюкозы, что увеличивает синтез АТФ и нейтрализацию свободных радикалов, продукция которых в условиях тканевой гипоксии возрастает [21, 24].
Таким образом, изучение применения цитофлавина в комплексном лечении больных СД 2 типа, осложнённого ДПН, в условиях активных оксидативных реакций представляется весьма перспективным. В связи с этим, целью исследования явилось изучение эффективности цитофлавина в коррекции ОС при ДПН у больных СД 2 типа в сочетании с артериальной гипертензией (АГ).
Материалы и методы исследования. Под наблюдением на базе эндокринологического центра МУЗ ГО г. Воронеж ГКБ СМП №10 находилось 56 человек с диагнозом: СД 2 типа, средней степени тяжести, стадия суб- и декомпенсации, диабетическая ретинопатия (ДР) 1 стадия, ДПН нижних конечностей, дистальный симметричный тип, сенсорная форма, диабетическая нефропатия (ДН) 0-1 стадия, АГ 2 стадия, 1-2 степень, риск ССО 4 степени. Степень ДР устанавливалась согласно общепринятой классификации [4, 5, 16]. У больных исследовалась суточная экскреция альбумина с мочой, скорость клубочковой фильтрации оценивалась по формуле Кокрофта-Голта, ранжирование стадий хронического осложнения осуществлялось согласно принятой в России классификации ДН [4, 5, 18]. Для исследования ДПН применяли стандартные методы [5, 11]: оценка неврологических симптомов по шкале нейропатического симптоматического счета (NSS) и интенсивности их выраженности по шкале общего симптоматического счета (TSS), тактильной чувствительности 10 г монофиламентом Semmes-Weinstein 5.07; порога болевой чувствительности при помощи ручки Neuropen; температурной чувствительности с помощью термического прибора Thip-term; порога вибрационной чувствительности градуированным неврологическим камертоном Rydel-Syfel 128 Гц; ахиллова и коленного рефлексов неврологическим молоточком. Чувствительность определялась в зонах согласно протоколу расчёта шкалы невропатического дисфункционального счета (NDS) с последующим вычислением индекса NDS и индекса нейропатической боли по шкале DN4 [10]. ДПН классифицировалась по стадиям (0, 1, 2, 3) согласно P.J. Dyck (1988), P.K. Thomas (1997) [12, 23]. Диагностика АГ проводилась согласно рекомендациям ВНОК стандартными методами с учётом анамнеза заболевания, неоднократного измерения АД, ЭКГ.
Критериями включения больных в исследование были: возраст 40-60 лет, длительность СД 2 типа не менее 1,5 лет и не более 10 лет, средняя степень тяжести СД 2 типа, суб- или декомпенсация без кетоза, 1-2 стадия и степень АГ, 1 или 2 стадия ДПН длительностью не более 10 лет. Из исследования исключались больные СД 2 типа тяжёлой формы или длительностью более 10 лет, синдромом диабетической стопы, ангиопатией нижних конечностей с хронической артериальной ишемией 2 стадии и выше по Фонтейну-Покровскому [14], с острым нарушением мозгового кровообращения или острым инфарктом миокарда в анамнезе. Также из исследования исключались больные, получавшие терапию другими антиоксидантами длительно или в течение месяца до госпитализации.
Все пациенты получали комбинированную гипогликемизирующую терапию производными сульфанилмочевины в сочетании с метформином в режиме титрации доз в сочетании с комбинированной антигипертензивной терапией до достижения целевых показателей, рекомендуемых для больных СД 2 типа согласно национальным рекомендациям [4].
В исследование было включено 56 человек, из них женщин – 25 (45%), мужчин – 31 (55%). Средний возраст пациентов составил 52,8±0,6 лет, средняя длительность СД 2 типа – 5,7±0,3 лет, ДПН – 5,0±0,3 лет, АГ – 6,2±0,2 лет. В зависимости от вида аддитивной терапии больные были разделены на две группы: пациенты первой (n=27) составили группу контроля, второй (n=29) – дополнительно получали в/в 10 мл цитофлавина, растворённого в 200 мл 0,9% раствора хлорида натрия в течение 14 дней, пролонгируемую пероральным приёмом цитофлавина по 2 таблетки 2 раза в день в течение 6-8 недель. Обе группы были сопоставимы по полу, возрасту, длительности СД, ДПН, АГ.
Лабораторные методы исследования крови проводились по общепринятым методикам при поступлении и на 14 сутки нахождения в стационаре. При оценке биохимических параметров за основу брались физиологические нормы, соответствующие международной системе единиц в клинических исследованиях.
У больных изучали следующие параметры ОС: общую окислительную способность сыворотки крови (ТОС), общую антиокислительную способность сыворотки крови (ТАС), уровень антител IgG к окисленным ЛПНП.
TOC и TAC сыворотки крови определялась с использованием реактивов «CanAg Diagnostics AB» (Швеция) методом твердотельного иммуноферментного анализа на ИФА-ридере «Униплан» («Пикон», (Россия)).
Исследование уровня антител IgG к окисленным ЛПНП (MDA-LDLс IgG) проводилось методом твердотельного иммуноферментного анализа ELISA с использованием реактивов «Biomedica» (Германия) на ИФА-ридере «Униплан» («Пикон», (Россия)).
Дополнительно вычисляли индекс окислительного стресса (OSI) по формуле [20]:
OSI = TOC / TAC × 100,
где TOC – общая оксидативная способность, TAC – общая антиоксидантная способность.
Статистическая обработка выполнена с помощью программ Excel 2010 (Microsoft) и Statistica 8.0 (StatSoft, Inc.), тип распределения выборки оценивали с помощью критерия Колмогорова-Смирнова, исследуемые показатели приведены в виде M±m, для внутригруппового сравнения использовали критерий Вилкоксона (W), для межгруппового – критерий Манна-Уитни (U), критический уровень значимости (p) принимали равным 0,05.
Результаты исследования и их обсуждение. В наблюдаемой группе развитие АГ предшествовало возникновению СД 2 типа от 8 до 12 мес. Первые жалобы, характерные для ДПН нижних конечностей выявлялись в течение 14 мес от верификации СД.
У всех пациентов до начала лечения отмечалось повышение ТОС и уровня MDA-LDLс IgG на фоне сниженного показателя ТАС крови и неудовлетворительного состояния углеводного обмена как на момент исследования, так и в течение предшествующих 10-12 нед, о чем свидетельствовал высокий уровень HbA1c. Индекс ОС был повышен на фоне снижения АОС [13, 21, 24].
Значения индексов нейропатического статуса (НС) (NSS, TSS, NDS, DN4) у больных СД 2 типа соответствовали умеренной и выраженной степени полинейропатии (табл. 1).
Таблица 1. Общая характеристика наблюдаемой группы больных сахарным диабетом 2 типа с диабетической полинейропатией и артериальной гипертензией до начала лечения
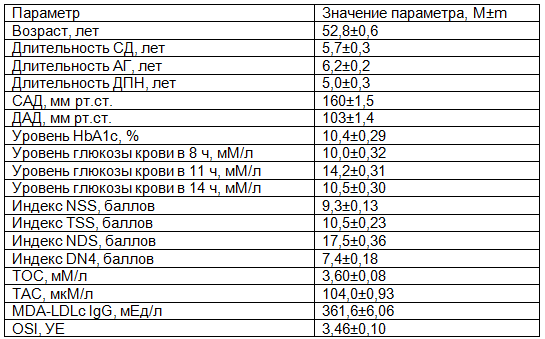
Исследование корреляционных взаимосвязей выявило высокую корреляционную зависимость длительности СД 2 типа и ДПН со степенью выраженности нейропатических проявлений по вычисленным индексам НС r (коэффициент ранговой корреляции Спирмена) от +0,56 до +0,77 (p<0,01). Уровень как САД, так и ДАД коррелировал с субъективными и инструментальными параметрами НС, r от +0,34 до +0,67 (p<0,05). Значения ТОС и уровня MDA-LDLс IgG обнаруживали сильную взаимосвязь с величиной АД, индексами шкал НС, r от +0,49 до +0,83 (p<0,01). Была найдена отрицательная корреляционная взаимосвязь между ТАС и степенью выраженности ДПН и АГ, r от -0,35 до -0,57 (p<0,05). Уровень постпрандиальной гликемии коррелировал умеренно со значениями индексов шкал НС, r=0,26 (p=0,07).
Анализ исследуемых параметров у больных СД 2 типа с ДПН в группе контроля показал, что традиционная гипогликемизирующая и антигипертензивная терапия лишь частично эффективна в коррекции ОС и ингибировании прооксидантной системы и недостаточно эффективна в профилактике и лечении ДПН. Так у пациентов этой группы отмечалось снижение ТОС на 1,4%, MDA-LDLc IgG на 1,9%, OSI на 3,2%, рост ТАС на 4,7%. Изменение величин индексов НС характеризовалось уменьшением NSS на 8,7%, TSS – 4,9%, NDS – 2,9%, DN4 – 12,3%. Базисная терапия способствовала достоверному снижению уровня пре- и постпрандиальной гликемии по завершении стационарного периода наблюдения: гликемии в 8 часов на 23,5%, в 11 часов на 26,7%, в 14 часов на 13,9%, гликогемоглобина на 1,9% соответственно (табл. 2).
Таблица 2. Состояние исследуемых параметров у пациентов группы контроля до и после традиционного лечения
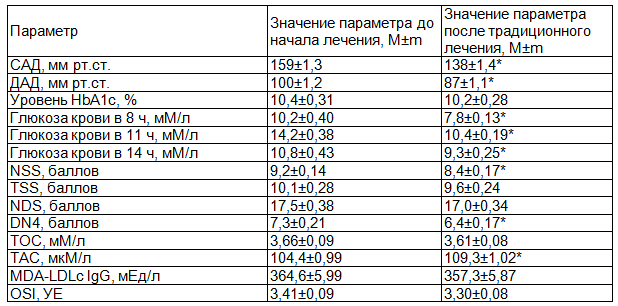
Примечание: здесь и далее * - уровень значимости p<0,05 при использовании критерия Уилкоксона (W).
Применение цитофлавина у больных основной группы, благодаря его антигипоксическому и антиоксидантному действию, позволяет снизить активность ОС, способствуя регенерации АОС и стимулируя поглощение глюкозы клетками и включение её в цепь синтеза макроэргов, что положительно сказывается на выраженности клинических проявлений ДПН. Изменения значений индексов НС характеризовались уменьшением NSS на 15,9%, TSS – 17,6%, NDS – 10,4%, DN4 – 24%.
У пациентов основной группы достоверно корригировался как уровень глюкозы крови натощак и в 14 часов, а также и спустя 2 часа после приёма пищи: значение гликемии снижалось на 31,3%, 32,6% и 25,8% соответственно. Величина HbA1c значимо уменьшалась среди больных этой группы на 5,8% (табл. 3). Изучение параметров гликемического статуса и HbA1c двух групп показало, что сочетание цитофлавина с базисной гипогликемизирующей терапией оказывало более благоприятное влияние на уровень препрандиальной в 8 и 14 часов и постпрандиальной гликемии в 11 часов, а также гликогемоглобина в сравнении с соответствующими параметрами у больных группы контроля (рис. 1, 2). У больных основной группы после окончания стационарного этапа лечения величина гликемии в 8, 11 и 14 часов по отношению к аналогичным параметрам в контрольной группе на базисной терапии была ниже на 12,8%, 8,7% и 19,4%, а HbA1c – на 4,9% соответственно.
Таблица 3. Состояние исследуемых параметров у пациентов основной группы до и после традиционного лечения в сочетании с применением цитофлавина
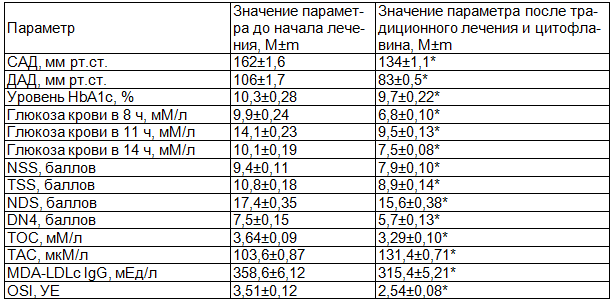
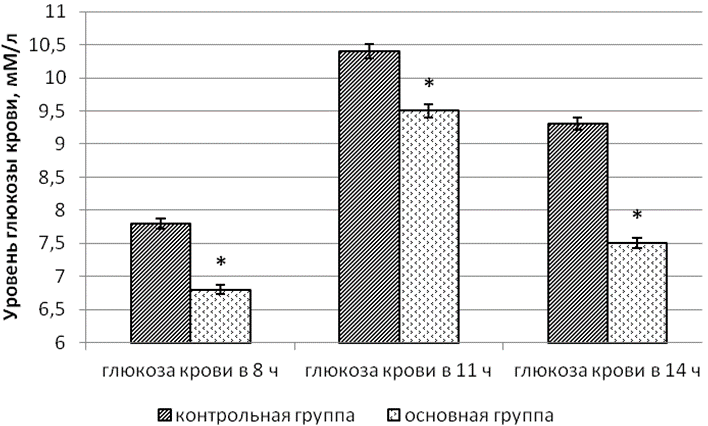
Рис. 1. Параметры гликемического профиля пациентов контрольной и основной группы после окончания стационарного этапа терапии: * - уровень значимости p<0,05 при использовании критерия Манна-Уитни (U).
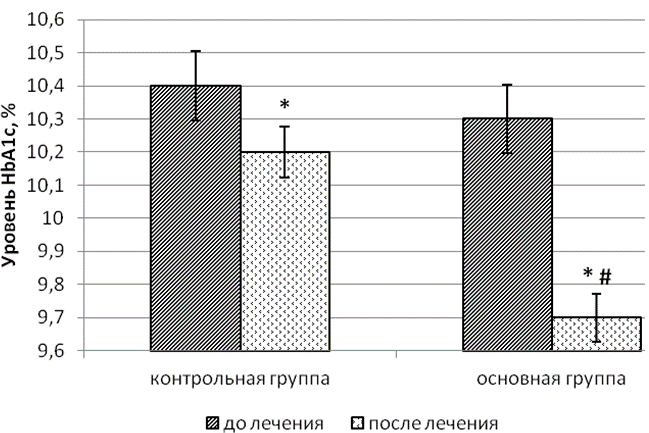
Рис. 2. Уровень гликированного гемоглобина у больных контрольной и основной группы до и после проведенного лечения: * – уровень значимости p<0,05 при внутригрупповом сравнении с использованием критерия Уилкоксона (W); # – уровень значимости p=0,103 при межгрупповом сравнении параметра с использованием критерия Манна-Уитни (U) после окончания стационарного этапа лечения.
Терапия цитофлавином способствовала существенному изменению параметров, характеризующих ПОЛ: у больных было выявлено снижение ТОС, MDA-LDLс IgG и увеличение ТАС, что сопровождалось падением интегрального индекса ОС в основной группе. Так уменьшение ТОС составило 9,6%, MDA-LDLc IgG – 12,1%, OSI – 27,6%, прирост ТАС – 26,8% (рис. 3).
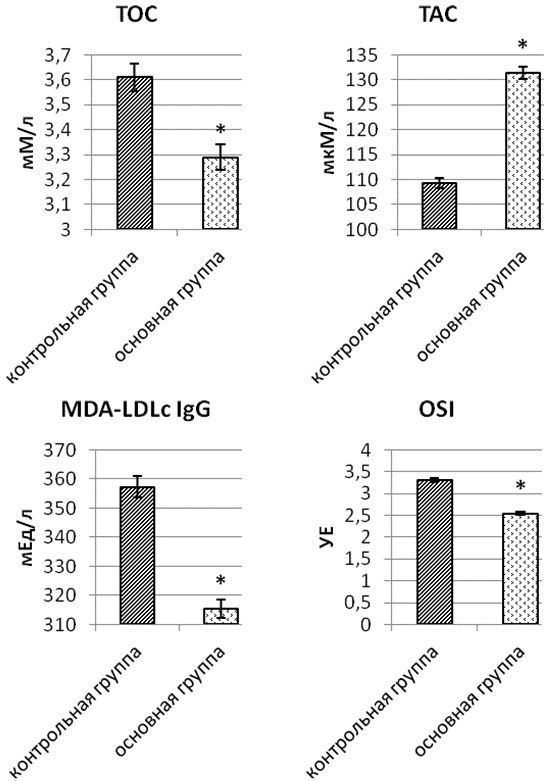
Рис. 3. Параметры про- и антиоксидантных систем, характеризующих состояние окислительного стресса, у больных сахарным диабетом 2 типа в сочетании с диабетической полинейропатией и артериальной гипертензией в контрольной и основной группе после окончания стационарного этапа терапии: * - уровень значимости p<0,05 при использовании критерия Манна-Уитни (U); TOC – общая оксидативная способность, TAC – общая антиоксидантная способность, MDA-LDLс IgG – антитела класса IgG к окисленным ЛПНП, OSI – индекс окислительного стресса.
Активация микросомального окисления глюкозы, улучшение утилизации кислорода клетками, снижение эскалации свободных радикалов позволяет уменьшить активность ОС при ДПН и её клинические проявления у больных СД 2 типа с АГ. При сравнении параметров ОС по окончании стационарного этапа лечения в контрольной и основной группах, выявлено существенное преимущество базисной гипогликемизирующей и антигипертензивной терапии модифицированной включением цитофлавина. Так снижение величины TOC, MDA-LDLc IgG и OSI было на 8,9%, 11,7% и 23%, а увеличение TAC на 20,2% больше в группе пациентов дополнительно получавших цитофлавин, что отражалось на субъективных и объективных проявлениях ДПН.
Таким образом, применение аддитивной терапии цитофлавином подавляет активность прооксидантной ферментной системы и потенцирует АОС, уменьшает напряжённость ОС, что подтверждается снижением интегрального индекса ОС и лимитированием накопления антител класса IgG к окисленным ЛПНП. Ограничение оксидативных реакций, стимулирование внутриклеточного поступления глюкозы со стабилизацией энергообеспечения клеточных структур оказывают благоприятное воздействие на течение ДПН, проявляющееся уменьшением значений индексов нейропатического статуса (TSS, NDS), что позволяет использовать цитофлавин в комплексной терапии больных диабетом.
