Введение
Cреди населения старше 30 лет распространенность метаболического синдрома составляет от 10 до 30% [1]. Ведущим звеном развития и прогрессирования метаболического синдрома является инсулинорезистентность (ИР). В большинстве исследований показано, что второй по значимости составляющей метаболического синдрома является ожирение[2]. Жировая ткань выполняет не только энергетическую и термоизоляционную функцию, но и является эндокринным органом. Выделяют несколько видов жировой ткани. Считается, что висцеральная жировая ткань обладает большей эндокринной активностью и поэтому в большей степени, чем периферический жир, оказывает влияние на прогрессирование инсулинорезистентности и развитие сердечно-сосудистых заболеваний сахарного диабета 2 типа [3, 4].
Традиционно развитие метаболического синдрома и атеросклеротического поражения сосудов, патогенетически связанного с сердечно-сосудистой патологией, ассоциируется с более старшей возрастной группой. Высказано мнение, что в современных условиях с возрастом прогрессирует инсулинорезистентность и висцеральное ожирение, провоцируя каскад патологических процессов, приводящих к развитию атеросклероза [5]. При этом отмечается, что у мужчин связанные с ИР изменения выявляются раньше, чем у женщин.
Не смотря на многолетнее внимание к проблеме возникновения метаболического синдрома, до настоящего времени остается неразрешенной задача влияние на формирование заболеваний сердца и сосудов, начальные признаки которых могут возникать в молодом возрасте.
Целью настоящего исследования является изучение особенностей углеводного и липидного обменов, и их влияние на появление начальных признаков атеросклероза, как раннего маркера сердечно-сосудистых заболеваний у мужчин и женщин среднего возраста без клинически выраженного ожирения.
Материалы и методы исследования
В исследуемую группу было включено 150 клинически здоровых мужчин и женщин (69 и 81 человек соответственно) в возрасте от 30 до 60 лет, не предъявляющих жалоб и обратившихся в клинику ОАО «Медицина» для проведения диспансеризации.
Методы обследования включали в себя сбор анамнеза, измерение антропометрических показателей: рост, масса тела, окружность талии (ОТ), исследование некоторых показателей углеводного и липидного обменов, проведение ультразвуковой допплерографии магистральных артерий головы (УЗДГ МАГ).
При оценке антропометрических показателей производился расчет индекса массы тела (ИМТ) по формуле (ИМТ= вес/рост (кг/м2)). Лица ИМТ которых равнялся или превышал 30 кг/м2 (I степень ожирения и более по ВОЗ), исключались из исследования. Окружность талии оценивался по критериям EGIR - критическое значение ОТ для диагностики висцерального ожирения составляет для мужчин 94 см, а для женщин - 80 см [6].
Для изучения углеводного обмена измеряли концентрацию глюкозы венозной крови и иммунореактивного инсулина натощак. Инсулинорезистентность диагностировали при помощи модели оценки гомеостаза (Homeostasis Model Asessment) – HOMA-IR, которая вычислялась по формуле (HOMA-IR = (глюкоза х инсулин)/22,5).
Оценка показателей липидного обмена проводилась путем измерения в плазме венозной крови уровней общего холестерина (ОХ), триглицеридов (ТГ), холестерина липопротеинов высокой плотности (ХС ЛПВП), аполипопротеинов А1 и В (Апо А1 и Апо В). Холестерин липопротеинов низкой плотности (ХС ЛПНП) рассчитывался по формуле Фридвальда [7]: ХС ЛПНП = ОХ – ХС ЛПВП – ТГ/2,2. При этом уровень ТГ у обследуемых пациентов не превышал 4,5 ммоль/л.
В качестве оценки начальных признаков атеросклероза использовалось измерение толщины комплекса интима-медиа (ТИМ) на сонных артериях при ультразвуковом исследовании.
Обработка данных проводилась с использованием стандартного программного статистического пакета PASW Statistics 18. Количественные показатели были представлены ввиде среднего значения и стандартной ошибки среднего. Достоверность определялась с использованием t-критерия Стьюдента. При сравнении, результаты считались достоверными при значении р<0,05.
Результаты исследования и их обсуждение
Для достижения поставленной цели пациенты были разделены по половому признаку. Средний возраст у мужчин достоверно не отличался от женщин и составлял 41,06±0,91 лет и 43,14±0,95 лет соответственно (р=0,119), при этом ИМТ у мужчин был достоверно больше - 25,70±0,30 кг/м2 против 23,50±0,37 кг/м2 у женщин (р<0,001). Среднее значение ОТ также оказалось больше у мужчин, чем у женщин - 94,35±0,92 см и 77,93±1,22 см (р<0,001). При этом доля пациентов с превышением критического значения EGIR достоверно не различалась в исследуемых группах и составляла 55,6% и 43,8% соответственно (χ2=1,86, р=0,23).
Уровень глюкозы не превышал нормативные показатели, но был достоверно выше в группе мужчин по сравнению с представителями женского пола (5,50±0,17 ммоль/л и 5,11±0,1 ммоль/л соответственно, р=0,048), при исследовании концентрации иммунореактивного инсулина (ИРИ) достоверных различий в исследуемых группах получено не было, при этом уровень ИРИ в группах мужчин был также выше и составил 8,51±0,73 мкМЕ/мл против 7,1±0,55 мкМЕ/мл в женской группе, р=0,126). Индекс HOMA-IR также был достоверно выше в мужской группе (2,53±,25 и 1,75±0,13 соответственно, р=0,007).
При изучении показателей липидного обмена в группах мужчин и женщин были получены достоверные различия по концентрациям ОХ (5,70±0,15 ммоль/л против 5,12±0,11 ммоль/л; р=0,002); ТГ (1,69±0,13 ммоль/л против 0,96±0,10 ммоль/л; р<0,001); ХС ЛПВП (1,28±0,03 ммоль/л против 1,51±0,04 ммоль/л; р<0,001); ХС ЛПНП (3,69±0,13 ммоль/л против 3,16±0 ммоль/л; р=0,001) в исследуемых группах соответственно. Недостоверные различия получены при измерении уровней Апо А1 (1,62±0,04 г/л и 1,67±0,03 г/л; р=0,32) и Апо В (1,31±0,05 г/л и 1,27±0,04 г/л; р=0,51) в группе мужчин и женщин соответственно.
При оценке толщины комплекса интима-медиа каротидных артерий выявлено, что в группе женщин данный показатель был достоверно ниже, чем в группе мужчин и составил 0,8316±0,03 мм против 0,7585±0,02 мм в изучаемых группах соответственно (р=0,024).
С целью изучения влияния ИР на исследуемые показатели в группах предварительно разделенных по гендерному признаку, в дальнейшей работе мы проводили исследование с учетом нсулиночувствительности пациентов. В настоящее время нет убедительных данных о пороговых значениях индекса HOMA-IR, которые бы однозначно свидетельствовали о наличии инсулинорезистентности. В нашей работе были использованы верхние две квартили распределения, полученные по результатам исследований с участием 5511 взрослых не страдающих сахарным диабетом пациентов[8].
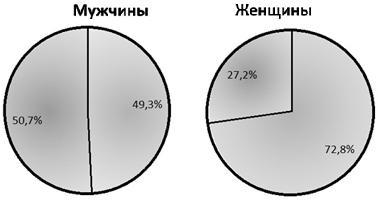
Рис. 1. Доля инсулинорезистентных пациентов в группах мужчин и женщин.
При этом пороговое значение HOMA-IR составило 2,00. Таким образом, ИР предполагалась при величине HOMA-IR больше 2,00, а значение HOMA-IR менее или равное 2,00 предполагалось у инсулиночувствительных (ИЧ) субъектов. С учетом данных показателей доля ИР мужчин оказалась достоверно больше и составила 50,7% по сравнению 27,2% в группе женщин (χ2=8,78, р=0,004) (рис.1).
Группы инсулинорезистентных (n=35) и инсулиночувствительных (n=34) мужчин были сопоставимы по возрасту (41,86±1,44 лет и 40,24±1,10 лет соответственно, р=0,38). Показатели ИМТ и ОТ были выше в группе ИР мужчин по сравнению с ИЧ пациентами и составили - 26,47±0,42 кг/м2 против 25,02±0,41 кг/м2 (р=0,015) и 96,52±1,38 против 92,25±1,12 см (р=0,02) в исследуемых группах соответственно. Средние показатели уровней глюкозы и ИРИ с высокой степенью достоверности преобладали в группе ИР (6,04±3,56 и 5,1±0,1, р=0,017) и (13,15±1,1 и 5,1±0,39, р<0,001) соответственно.
При оценке липидного профиля отмечены достоверно большие значения ОХ и ТГ: 6,16±0,22 ммоль/л против 5,23±0,18 ммоль/л, р=0,02 и 2,10±0,18 ммоль/л против 1,27± 0,13 ммоль/л р<0,001 в группе ИР по сравнению с ИЧ мужчинами соответственно.
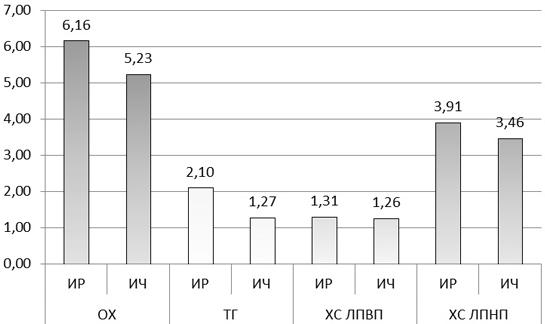
Рис. 2. Сравнение уровней ОХ и его фракций у ИР и ИЧ мужчин.
При изучении средних значений ХС ЛПНП достоверных различий не выявлено, однако, в ИР группе отмечены более высокие показатели: 3,91±0,20 ммоль/л по сравнению с 3,46±0,15 ммоль/л у ИЧ пациентов, р=0,085 (рис. 2). Зарегистрировать достоверных различий по средним значениям ХС ЛПВП (1,31±0,04 ммоль/л против 1,26±0,04 ммоль/л, р=0,426), апопротеина В (1,35±0,07 г/л против 1,27±0,06 г/л, р=0,39) и апопротеина А1 (1,63±0,06 г/л и 1,60±0,05 г/л, р=0,711) в изучаемых группах не удалось.
При изучении ТИМ отмечено, что в группе ИР мужчин величина комплекса интима-медиа достоверно превышала значения, полученные при исследовании ИЧ-группы и составила 0,90±0,04 мм против 0,76±0,02 мм соответственно (р=0,012) (рис 3).
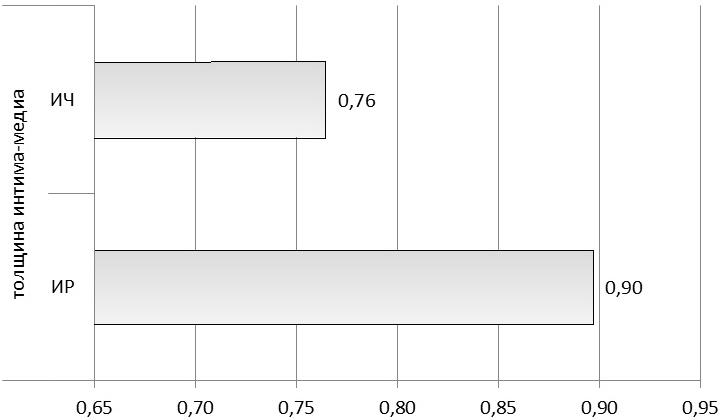
Рис. 3. Сравнение толщины комплекса интима-медиа у ИР и ИЧ мужчин.
Группы ИР и ИЧ женщин также были сопоставимы по возрасту (45,32±2,058 лет и 42,32±1,043 лет соответственно, р=0,161) и имели схожие изменения по антропометрическим показателям: более высокие значения по ИМТ (25,19±0,71 кг/м2 и 22,90±0,40 кг/м2, р=0,009) и ОТ (84,00±2,56 см и 75,64±1,25 см, р=0,006) в ИР-группе по сравнению с ИЧ женщинами соответственно.
Исследуемые параметры углеводного обмена у представительниц женского пола – глюкоза и ИРИ - также были достоверно выше в группе инсулинорезистентных пациенток - 5,62±0,18 ммоль/л против 4,93±0,09 ммоль/л (р=0,002) и 12,70±0,96 мкМЕ/мл против 5,09±0,28 мкМЕ/мл (р<0,001) в исследуемых группах соответственно.
Также как и у инсулинорезистентных мужчин, у ИР женщин наблюдались изменения в липидограмме, которые можно трактовать как тенденцию к появлению атерогенной дислипидемии, но они носили иной характер – в ИР группе по сравнению с ИЧ пациентками отмечен более высокие средние показатели ХС ЛПНП (3,47±0,16 ммоль/л и 3,05±0,11 ммоль/л соответственно, р=0,039) и низкий уровень ХС ЛПВП (1,36±0,06 ммоль/л и 1,57±0,05 ммоль/л соответственно р=0,016). Уровни ОХ (5,42±0,20 ммоль/л и 5,02±0,13 ммоль/л) и ТГ (1,20±0,19 ммоль/л и 0,87±0,05 ммоль/л) в изучаемых группах достоверно не различались (р=0,099 и р=0,107 соотвественно (рис. 4).
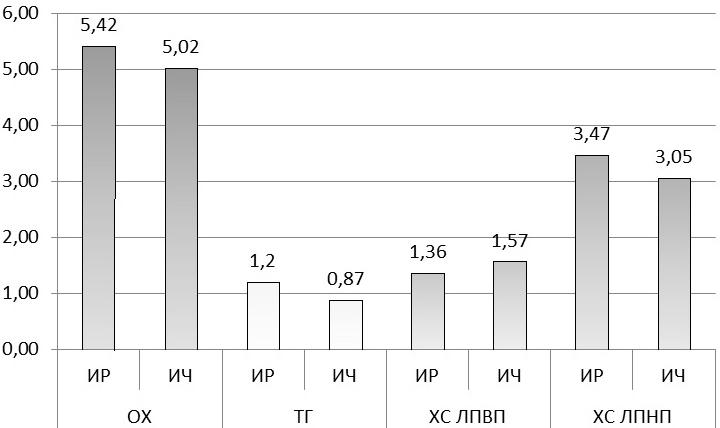
Рис. 4. Сравнение уровней ОХ и его фракций у ИР и ИЧ женщин.
При оценке ранних проявлений атеросклеротического поражения сосудов по величине ТИМ достоверных различий в изучаемых группах также получено не было (0,77±0,03 и 0,75±0,02 мм у ИР и ИЧ пациенток соответственно, р=0,672).
В ряде работ показано, что частота встречаемости инсулинорезистентности в женской популяции среднего возраста приблизительно в 2 раза меньше, чем у мужчин этой же возрастной группы [1]. Наше исследование подтверждает это на примере частоты встречаемости инсулинорезистентности в исследуемой группе, где количество мужчин и женщин с нарушенной чувствительностью к инсулину составило 50,7% и 27,2% соответственно.
Исследуемая группа была однородна по возрасту. При сравнительной оценке антропометрических показателей выявлено, что в группе инсулинорезистентных пациентов мужского и женского пола без ожирения ИМТ и ОТ были достоверно выше, чем в группах с сохраненной чувствительностью к инсулину. При этом превышение пороговых значений выявлено только по окружности талии в группе ИР мужчин и женщин. Полученные результаты подтверждают научные наблюдения, указывающие на решающую роль увеличения ОТ, как маркера выраженности абдоминального ожирения за счет висцеральной жировой ткани, в формировании метаболических нарушений у пациентов без ожирения, диагностированного по ИМТ [10].
Важным и неизменным компонентом классического метаболического синдрома является атерогенная дислипидемия. Нарушение физиологического метаболизма жиров, превращение его в патологический субстрат, способствует повреждению сосудистой стенки, ее воспалению и накапливанию в интима-медиа эфиров холестерина. Основное изменение липидного состава плазмы крови, характерное для синдрома ИР, связано с повышением насыщенных ТГ липопротеидов и снижением ХС ЛПВП. Также отмечено, что уровень ХС ЛПНП при ИР часто сопоставим с уровнем ХС ЛПНП в общей популяции, однако гиперинсулинемия способствует увеличению доли наиболее атерогенных маленьких плотных частиц в общем количестве ХС ЛПНП. Это вносит основной вклад в формирование атеросклероза, начальные признаки которого в проведенном нами исследовании определяются у инсулинорезистентных мужчин [1].
В популяции женщин, благодаря более высокому уровню эстрогенов, изменения липидного профиля, ассоциированные с ИР происходят несколько по-иному: снижается уровень ХС ЛПВП и повышается ХС ЛПНП. По результатам нашей работы не видно достоверных различий между уровнями ОХ и ТГ в группах ИР и ИЧ женщин, что также является результатом защитного влияния повышенного уровня эстрогенов наряду с их вазопротективным эффектом отсутствие преобладания ТИМ у инсулинорезистентных женщин [9].
Заключение
Таким образом, подводя итоги выполненной работы, можно отметить, что наше исследование показало возможность развития метаболических нарушений в группе пациентов среднего возраста без ожирения, которые традиционно не подходят под классические представления о метаболическом синдроме, у мужчин в большей степени, чем у женщин. При использовании общепринятых подходов к наблюдению за пациентами без клинических жалоб и ожирения данной возрастной группой не всегда удается выявить характерные для этой категории лиц факторы риска развития сердечно-сосудистых заболеваний и определить группу, требующую дополнительного наблюдения и использования индивидуальных программ профилактики развития заболевания сердечно-сосудистой системы. Данный факт не может не оказать отрицательного влияния на уровень инвалидизации и смертности трудоспособной и экономически активной части населения и потребовать разработку более эффективных профилактических мер.
