На сегодняшний день актуальность гиперкортицизма без специфических клинических симптомов и признаков вышла за рамки теоретической и имеет непосредственное клиническое значение.
После того, как неоднократно было показано, что распространенность клинически скрытого синдрома гиперкортицизма (СГ) значительно выше в популяции пациентов с сахарным диабетом (СД) 2 типа, ожирением по сравнению с общей [1-4], был поднят вопрос о необходимости проведения скрининга клинически скрытого СГ в этих специфических популяциях.
Как известно, показанием к проведению скрининга манифестного СГ является наличие таких специфических признаков, как характерные фиолетовые стрии более 1 см в ширину, слабость проксимальных мышц конечностей, нетравматичное образование кровоподтеков, плетора лица. В случае же с клинически скрытым СГ показания к скринингу будет определять врач, основываясь исключительно на своем клиническом опыте и мышлении. Это, в свою очередь, придаст процедуре скрининге крайне субъективный характер со всеми вытекающими последствиями.
Во-вторых, даже если рассматривать наличие СД 2 типа и/или ожирения, как симптомы клинически скрытого СГ, то скрининг такой многомиллионной популяции не только экономически не выгоден, но и может повысить процент ятрогении. Поскольку на сегодняшний день окончательно не известно, какова должна быть оптимальная диагностика клинически скрытого СГ.
Таким образом, поиск потенциальных возможностей оптимизации скрининга гиперкортицизма без специфических клинических симптомов и признаков в популяции пациентов с СД 2 типа и/или ожирением является крайне актуальной задачей.
Цель. Разработка математической модели оценки риска наличия гиперкортицизма без специфических клинических симптомов и признаков.
Материалы и методы. В исследование вошли 188 пациентов. Критериями включения во фрагмент исследования по изучению больных с СД явились наличие СД 2 типа, повышенная масса тела, а по изучению пациентов с ожирением – индекс массы тела более 30 кг/м2. Общими критериями исключения было наличие специфических симптомов гиперкортицизма (нетравматичное образование кровоподтёков, плетора лица, проксимальная мышечная слабость, характерные стрии). Таким образом, было обследовано 128 пациентов с СД 2 типа и 60 пациентов с ожирением. Для реализации поставленной цели, было сформировано 3 этапа исследования. Задача первого этапа стояла в определении распространённости клинически скрытого СГ в популяции пациентов с СД 2 типа и в популяции с ожирением. Для этого всем пациентам была выполнена последовательная трёхступенчатая диагностика клинически скрытого СГ. Изначально всем был выполнен супрессивный тест с 1 мг дексаметазона (СТД 1 мг). Если уровень кортизола плазмы в 08-00 на следующий день после теста превышал 50 нмоль/л, определяли кортизол плазмы в 08-00 и 24-00 для расчёта циркадного ритма секреции и свободный кортизол в суточной моче. В случае, если хотя бы один результат был выше нормы, определяли уровень АКТГ в 08-00 и проводили супрессивный теста с 8 мг дексаметазона (СТД 8 мг) с дальнейшим выполнением CКТ надпочечников, либо МРТ головного мозга. Задача второго этапа заключалась в выявлении взаимосвязи между наличием клинически скрытого гиперкортицизма и показателями метаболического профиля. Для этого был выполнен дискриминантный анализ следующих показателей: возраст, стаж диабета, возрастной дебют диабета, индекс массы тела (ИМТ), окружность талии (ОТ), уровень общего холестерина (ОХС), триглицеридов (ТГ), липопротеидов низкой плотности (ЛПНП), уровень глюкозы плазмы натощак, значения систолического артериального давления (САД) и диастолического артериального давления (ДАД), также гликированный гемоглобин (HbA1c) только для группы СД 2 типа и уровень глюкозы плазмы спустя 2 часа после орального глюкозотолерантного теста (ОГТТ) с 75 г глюкозы, индексы инсулинорезистентности Caro и Homa для пациентов с ожирением без СД 2 типа. Задача третьего этапа исследования состояла в разработке математической модели оценки риска наличия гиперкортицизма с помощью использования метода логит-регрессии.
Результаты и их обсуждение. В ходе первого этапа исследования были получены следующие результаты: среди пациентов с СД 2 типа диагностировано 3 болезни Кушинга и 1 кортикостерома, среди пациентов с ожирением - 1 болезнь Кушинга и 1 кортикостерома. Таким образом, распространённость клинически скрытого СГ в группе пациентов с СД 2 типа составила 3,13% [ 95% CI 0,86 – 7,81%], в группе пациентов с ожирением без СД 2 типа - 3,33% [ 95% CI 0,41 – 11,53%]. Принимая во внимание полученную распространённость клинически скрытого СГ, а также конкордантность результатов нашего исследования с данными зарубежных работ [1, 2, 3, 5], можно резюмировать, что оптимизация скрининга гиперкортицизма без специфических клинических симптомов и признаков в популяции пациентов с СД 2 типа и/или ожирением является крайне актуальным вопросом.
Для реализации второго этапа исследования, а именно, выявления взаимосвязи между наличием клинически скрытого гиперкортицизма и показателями метаболического профиля в группе СД 2 типа, а также в группе пациентов с ожирением, был выполнен дискриминантный анализ, результаты которого представлены в табл. 1.
Как видно из представленных данных, для всех показателей наблюдаются малые значения критерия Fisher (менее заданного уровня в 1,9) и соответственно большие значения уровней значимости. Следовательно, ни один из этих показателей не обладает дискриминантной функцией и не может выступать в качестве предиктора наличия гиперкортицизма. Таким образом, создание модели по оценке риска наличия гиперкортицизма для больных с СД 2 типа на основании данных исследования не представляется возможным.
Подробные результаты аналогичного анализа в группе пациентов с ожирением без СД 2 типа представлены в табл. 2 и 3.
Таблица 1. Оценка дискриминантной функции показателей метаболического профиля

Таблица 2. Показатели, которые не вошли в анализ, согласно уровню значимости р
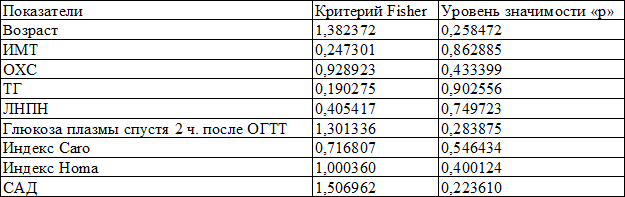
Таблица 3. Итоги пошаговой процедуры отбора предикторов
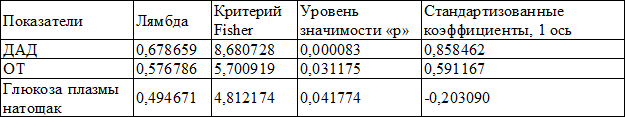
Как видно из табл. 3, такие показатели, как уровень диастолического АД, окружность талии, уровень глюкозы натощак обладают дискриминантной функцией, что наглядно продемонстрировано на рис. 1.
На графике представлено распределение наблюдений групп пациентов с и без гиперкортицизма в осях 1 и 2-й дискриминантных функций. Видно, что оба пациента с гиперкортицизмом имеют отдельную локализацию по 1-й оси, в то время как наблюдения пациентов без гиперкортицизма перемешаны.
Таким образом, в результате дискриминантного анализа была выявлена взаимосвязь между показателями ДАД, ОТ, уровнем глюкозы плазмы натощак и наличием гиперкортицизма, что свидетельствует в пользу возможного создания модели по оценке риска наличия гиперкортицизма для пациентов с ожирением без диабета.
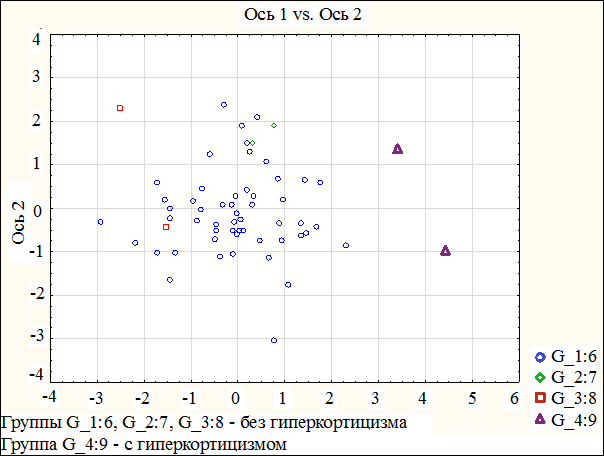
Рис. 1. Результаты дискриминантного анализа
Для реализации задачи третьего этапа исследования был использован такой метод статистического анализа, как логистическая регрессия. Выбор именно этого метода обусловлен тем, что он позволяет оценивать параметры уравнения регрессии, с помощью которого производится прогноз вероятности принадлежности конкретного объекта к тому или иному состоянию. В нашем случае речь шла о создании уравнения, с помощью которого возможно было определить вероятность наличия клинически скрытого СГ у пациента с ожирением на основании показателей метаболического профиля.
Для построения логистических уравнений были использованы данные пациентов с ожирением, а также всех пациентов, у кого был диагностирован гиперкортицизм. Поскольку для группы пациентов с СД 2 типа не были выявлены показатели с дискриминантной функцией, создание модели по оценке риска наличия гиперкортицизма для больных с СД 2 типа на основании данных нашего исследования было невозможным. Однако, учитывая, что все пациенты с СД 2 типа имели ожирение, мы посчитали возможным и целесообразным объединение наблюдений всех пациентов с клинически скрытым СГ для дальнейшего анализа. Таким образом, после объединения, для построения логит-регрессии были использованы данные 6 пациентов с клинически скрытым гиперкортицизмом.
В качестве потенциальных предикторов были выбраны возраст, ИМТ, ОТ, ОХС, ТГ, ЛПНП, глюкоза плазмы натощак, САД, ДАД, наличие гипертензии.
Пошаговый порядок исключения отобранных предикторов с указанием процента верного предсказания на каждом шаге также отражен на рис. 2 и в табл. 4, по которой можно проследить динамику предсказательной ценности предикторов.
В итоге осталось 3 предиктора, которые вошли в уравнение регрессии, представленное в табл. 5.
Таблица 4. Результаты пошагового исключения предикторов
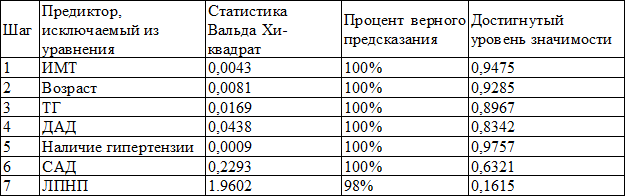
Таблица 5. Уравнение регрессии
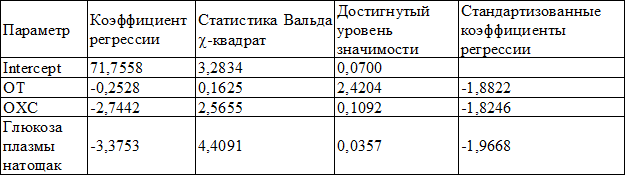
Как видно из значений в последнем столбце, все 3 параметра примерно равны. Из чего следует примерное равенство интенсивности влияния этих предикторов на различие групп сравнения. Стоит напомнить, что два показателя (ОТ, глюкоза плазмы натощак), обладали дискриминантной функцией, согласно дискриминантному анализу, что подтверждает надёжность полученных результатов.
ROC-кривая для рассчитанного уравнения представлена на рис. 2, значение AUC (Area Under the Curve) 0,99 соответствует “отличному”, согласно условной шкале качества прогноза в зависимости от AUC.
Процент согласия составил 98,8%. Т.е. в 98,8% случаев уравнение логит-регрессии правильно предсказывает, из какой группы пациент. Сила связи факта и предсказания по коэффициенту D-Зомера составила 0,975 (0, полное несовпадение, до 1, полное совпадение).
Проверка гипотезы адекватности фактических и предсказанных значений с помощью критерия Хосмера-Лемешова даёт уровень значимости равный 1,000, т.е. имеет место адекватная модель.
Переклассификация наблюдений пациентов с гиперкортицизмом посредством использования разработанного уравнения логит-регрессии показала следующее (табл. 6).
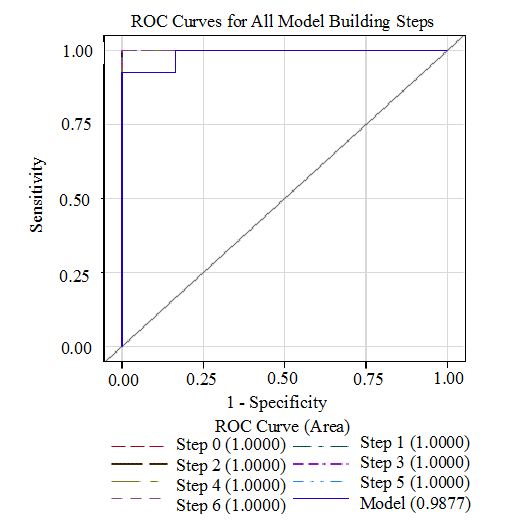
Рис. 2. ROC-кривая уравнения логит-регрессии
Таблица 6. Переклассификация наблюдений с использованием уравнения логит-регрессии

Как видно, это уравнение логит-регрессии даёт следующие результаты: лишь один пациент имеет очень малую вероятность относиться в группу без гиперкортицизма, тогда как остальные 5 пациентов с высокой вероятностью отнесены в свою группу.
Переклассификация наблюдений пациентов с ожирением без гиперкортицизма посредством использования разработанного уравнения логит-регрессии показала следующее:
- 50 пациентов имели вероятность менее 7% отнесения к группе гиперкортицизма.
- 4 пациента имели вероятность не более 38% отнесения к группе гиперкортицизма.
Учитывая, что для скрининговой модели приоритетнее меньшее количество ложноотрицательных результатов, чем ложноположительных, пороговым значением, при привышении которого показан скрининг, вероятно, должно быть 7%.
Использование разработанной модели не требует какого-либо специфического статистического софта. Как видно из табл. 7, необходимо внести значения трёх показателей и в последней колонке будет автоматически произведён расчёт вероятности наличия гиперкортицизма, на основе которой врач принимает решение о проведении диагностических тестов.
Таблица 7. Использование модели
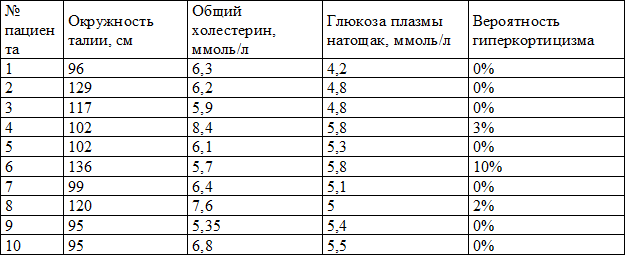
На настоящий момент разработанная модель проходит клиническую апробацию. Для формирования окончательных и надёжных выводов по использованию модели необходимо провести апробацию на выборке в размере не менее 100 пациентов.
Такого рода математические модели оценки риска наличия заболевания хорошо зарекомендовали себя в других областях медицины [6]. Большими преимуществами подобного рода моделей являются, во-первых, объективизация отбора пациентов, во-вторых, возможность повсеместного и беспрепятственного применения, и, в третьих, отсутствие необходимости в дополнительных финансовых затратах для их использования.
Выводы
1) Распространённость клинически скрытого СГ в группе пациентов с СД 2 типа составила 3,13% [95% CI 0,86 – 7,81%], в группе пациентов с ожирением без СД 2 типа 3,33% [95% CI 0,41 – 11,53%]. Принимая во внимание полученную распространённость клинически скрытого СГ, а также конкордантность результатов нашего исследования с данными зарубежных работ, можно резюмировать, что оптимизация скрининга гиперкортицизма без специфических клинических симптомов и признаков в популяции пациентов с СД 2 типа и/или ожирением является крайне актуальным вопросом.
2) Скрининг клинически скрытого гиперкортицизма не может быть основан на специфических симптомах гиперкортицизма и поэтому требует разработки принципиально иного подхода.
3) Возможным решением оптимизации скрининга, на наш взгляд, является разработка математических моделей, оценивающих риск наличия того или иного заболевания.
4) В рамках настоящего исследования была разработана модель оценки риска наличия клинически скрытого гиперкортицизма у пациентов с ожирением “отличного” качества, требующая масштабной клинической апробации прежде чем быть рекомендованной к широкому использованию.
