На сегодняшний день сахарный диабет (СД) является одной из важной медико-социальной проблемой современного здравоохранения, ввиду его высокой распространенности, высокой смертности и ранней инвалидизации больных. Так, согласно IDF 2011 г. данной патологией страдают 366 млн. человек, а к 2030 г. их количество вырастет до 552 млн. человек [1]. Достижение и поддержание целевых значений гликемии у таких пациентов во многом определяют прогноз заболевания. При этом, несмотря на высокий уровень современной медицины, одним из ведущих методов лечения пациентов с СД любого типа до сих пор остается инсулинотерапия [2]. Однако было замечено, что частые инъекции в одни и те же участки кожи могут приводить к уплотнению подкожно жировой клетчатки, получившему название «липогипертрофия» [3]. Это достаточно частый побочный эффект подкожной инсулинотерапии, возникающий у более 50% пациентов с сахарным диабетом 1 типа (СД 1 типа). Известно, что липогипертрофии (ЛГ) могут обнаруживаться в любом возрасте, при любой длительности инсулинотерапии, в любом месте, куда делается инъекция инсулина и быть любых размеров. Очевидно, что абсорбция инсулина из участков ЛГ происходит неконтролируемо, вследствие чего у пациентов возникают трудности с достижением компенсации углеводного обмена [4]. Следовательно, патологически измененная подкожно-жировая клетчатка, за счет нарушения всасывания инсулина, становится непригодной для дальнейших инъекций. Учитывая ограниченное количество зон, доступных для инсулинотерапии (наружная поверхность плеч, передняя поверхность живота, передняя поверхность бедер и ягодицы), потеря даже нескольких участков доставляет немало трудностей в контроле уровня глюкозы крови.
Ранее ЛГ определялись на основании визуальной оценки мест инъекций. Основным критерием неизмененной подкожно-жировой клетчатки являлись отсутствие возвышений и впадин в типичных зонах инъекций. Другой способ предусматривает исследование на теле человека типичных зон, используемых для инъекций инсулина, с помощью пальпаторного метода. При отсутствии уплотнений в типичных зонах инъекции инсулина, данные места определяют как разрешенные для инъекций [5]. Однако на сегодняшний день возникли сложности в верификации патологических участков ЛГ. Они заключаются в том, что внешние проявления, связанные с развитием ЛГ, сильно претерпели изменения и практически не видны невооруженным глазом, вероятно, из-за более высокого качества современных инсулинов и повышении его концентрации. В 2012 г. нами был разработан и внедрен в практику новый метод диагностики ЛГ (патент № 2438585 «Способ определения мест инъекций инсулина»), посредствам проведения ультразвукового исследования (УЗИ) подкожно-жировой клетчатки (ПЖК) мест инъекций. Основным критерием ЛГ является наличие округлых аваскулярных образований, различных размеров, без капсулы, гиперэхогенных гомогенных по структуре [6, 7].
Несмотря на наличие различных доступных методов диагностики ЛГ, достаточно большого количества исследований, посвященных изучению этой проблемы, причины возникновения патологических изменений ПЖК в местах инъекций инсулина до сих пор остаются неясными. Поэтому огромное значение в профилактике развития ЛГ приобретает установление вклада различных факторов риска (ФР) ЛГ и их коррекция. Следует отметить, что на настоящий момент существуют крайне противоречивые данные не только о роли различных ФР ЛГ, но и ставятся под сомнение известные ФР и появляются новые. Так, ряд авторов к ФР развития патологически измененной ПЖК отнесли возраст [8, 9], редкую смену мест инъекций [8, 10, 11], частоту смены игл [11], количество инъекций в день [11], стаж инсулинотерапии [9, 12], дозу вводимого инсулина [12], уровень знаний пациента о заболевании [9, 11] и даже тип сахарного диабета [9, 10]. Однако, другие исследователи это не подтверждают. Наибольшие споры возникли вокруг индекса массы тела и половой принадлежности [8-10, 12].
Таким образом, несмотря на несомненную актуальность обсуждаемой проблемы она далека от завершения. Перспективным видится уточнение роли известных ФР ЛГ и на основании этого разработка алгоритма диагностики ЛГ.
Цель исследования:
1. Определение частоты встречаемости ЛГ у пациентов с СД, получающих инсулинотерапию, согласно современным методам диагностики.
2. Изучение вклада различных факторов риска в развитие ЛГ.
Материал и методы. В исследование включено 140 пациентов с СД 1 и 2 типов, получавших инсулинотерапию, среди них 89 женщин и 51 мужчина. Больных СД 1 типа 100 человек (71,4%), и с СД 2 типа – 40 больных (28,6%). Все пациенты получали инсулин в базис-болюсном режиме, т.е. совершали инъекции короткого, либо ультракороткого инсулина перед основными приемами пищи, а продленный инсулин – перед сном. При этом длительность инсулинотерапии составила 8±1,9 лет. Для инъекций пациенты использовали как человеческие инсулины, так и его аналоги. Для верификации ЛГ всем больным проводили осмотр и пальпацию типичных для введения инсулина зон согласно национальным рекомендациям по технике инъекций при лечении сахарного диабета: параумбиликальная область с радиусом 2 см, латеральные поверхности бедер, плеч и области ягодиц. В местах ЛГ отмечались уплотнения подкожно-жировой клетчатки, в связи с чем кожу над данными участками нельзя было ущипнуть [13]. После чего выполнялось УЗИ подкожно-жировой клетчатки (ПЖК) мест инъекций. Исследование типичных зон проводилось с помощью универсального ультразвукового сканирующего прибора (Caris Plus) (ТУ 9442-001-07509215-2004), изготовленного Уральским приборостроительным заводом с использованием линейного датчика с частотой 7,5 МГц, через стандартный ультразвуковой гель. Места, где лоцировались округлые аваскулярные образования, различных размеров, без капсулы, гиперэхогенные гомогенные по структуре, нами были расценены как зоны ЛГ. При выявлении патологически измененной ПЖК с пациентом проводилась беседа о технике инъекций, и указывались места, разрешенные для введения инсулина.
Поскольку в современной литературе описано большое количество факторов риска развития ЛГ, то в ходе работы мы разделили их следующим образом. В первую группу вошли ФР, установленные различные авторами в ходе проведение научных исследований и считающиеся «установленными». К ним отнесли возраст [8, 9], индекс массы тела (ИМТ) [8-10, 12], редкую смену мест инъекций [8, 10, 11], пол [9,10], тип сахарного диабета [9, 10], доза вводимого инсулина [12], уровень знаний пациента [9, 11], количество инъекций одной иглой [11], стаж инсулинотерапии [9, 12], а также места инъекций [9].
Вторую группу составили ФР, которые потенциально способны вызвать развитие ЛГ, названные нами «дополнительными». Так, мы определяли длительность сахарного диабета, показатели гликемии натощак и через 2 часа после еды (глюкозооксидазный методом в плазме капиллярной крови); уровень гликозилированного гемоглобина (НвА1с) – методом боратного аффинного анализа на анализаторе «NycoCard Reader II» (Axis-Shield, Норвегия), схема инсулинотерапии, устройства для введения инсулина, тип вводимого инсулина, смена длины игл в течение заболевания, условие хранения открытого флакона инсулина, длина игл, воздействие на место инъекции, удержание иглы в коже после инъекции, капля на конце иглы после инъекции, а также болезненность инъекций. Для оценки всех вышеуказанных факторов риска был разработан опросник, в основе которого легла анкета по оценке техники инъекции Эндокринологического научного центра г. Москвы [13]. Таким образом, суммарно в работе было проанализировано 28 факторов.
Исследование проводили на базе «Городского эндокринологического центра» МБУЗ «Городская больница №4» г. Ростова-на-Дону (городской эндокринологический центр). Статистическая обработка результатов была выполнена при помощи программы Statistica 7.0 (StatSoft, США) с использованием метода корреляционного анализа (коэффициент Спирмена, Кендалла τ, Gamma). Данные считались достоверными при р<0,05. Полученные результаты были оценены при помощи ROC (Receiver Operator Characteristic) – анализа и численного показателя площади под кривой AUC (Area Under Curve) [14].
Результаты и обсуждение. На первом этапе, всем больным с сахарным диабетом, получающих инсулинотерапию были выполнены осмотр и пальпация типичных зон введения инсулина. При наличии уплотнений в данных местах, верифицировались ЛГ [15]. Оказалось, что на основании пальпаторных данных патологически измененная ПЖК была обнаружена у 27 пациентов (19,3%) (рис. 1), в то время как у 113 больных (80,7%) уплотнений в данных участках выявлено не было, что позволяло продолжить инъекций инсулина в эти места (рис. 2). Однако, на следующем этапе всем пациентам, включая и 113 пациентов, у которых не было обнаружено клинически ЛГ, выполнили УЗИ ПЖК мест инъекций инсулина. И ЛГ были обнаружены у 117 пациентов (83,6%) (рис. 3), включая тех 27 больных с пальпаторными изменениями (рис. 4). Далее, нами была оценена локализация патологически измененной ПЖК у больных, с верифицированными ЛГ. Интересно, что чаще всего они встречались в параумбиликальной области – 86 пациентов (61,4%), что можно объяснить частотой использования этой области для введения инсулина из-за удобства ее расположения. В тоже время, достаточно часто ЛГ обнаруживались одновременно в параумбиликальной области и латеральной поверхности бедер – 21 человека (15%), что возможно вызвано необходимостью введения человеческого инсулина короткого действия в живот, а инсулина продленного действия в бедро, с целью достижения наилучшей скорости всасывания препарата.
Рис. 1. Пальпаторные изменения подкожно-жировой клетчатки.
Рис. 2. Нормальная подкожно-жировая клетчатка.
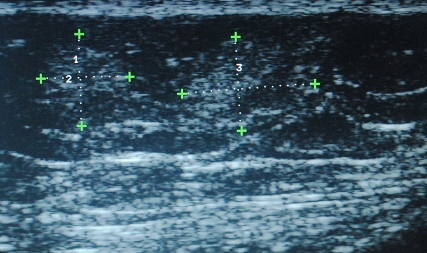
Рис. 3. Липогипертрофии, неопределяемые при пальпации подкожно-жировой клетчатки.
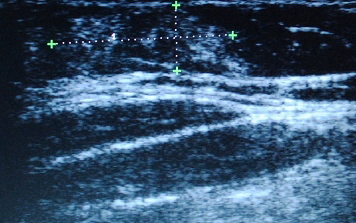
Рис. 4. Липогипертрофии, выявленные при пальпации подкожно-жировой клетчатки.
На следующем этапе все рассматриваемые ФР, которые являются как количественными, так и качественными признаками, были проанализированы с помощью метода корреляционного анализа с использованием коэффициентов ранговой корреляции, в ходе которого установлена различная теснота связи ЛГ с некоторыми показателями. В результате чего, нами были отобраны 10 ФР возникновения ЛГ, обладающие статистически значимой теснотой связи с ЛГ (p<0.05): отсутствие обучения в Школе диабета, ИМТ, использование человеческого инсулина, смена мест инъекций, количество инъекций одной иглой, наличие капли на конце после инъекции, болезненность инъекции инсулина, длительность заболевания СД и инсулинотерапии, а так же использование игл различной длины. Далее, с целью оценки их влияния на развитие ЛГ были подвергнуты ROC-анализу, а также для каждого из них был вычислен показатель AUC. Результаты ROC-анализа представлены на рис. 5 и 6.
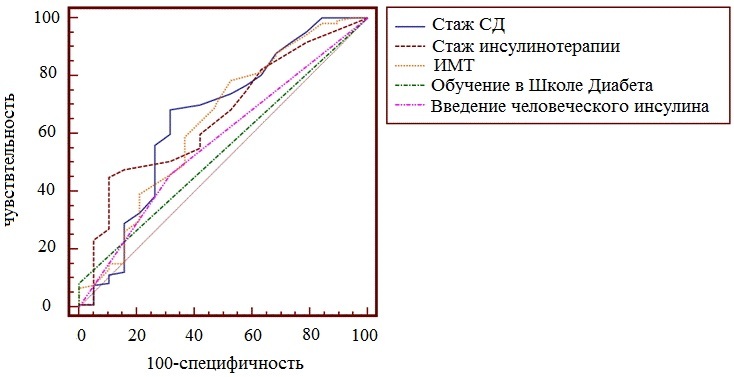
Рис. 5. Показатель AUC для исследуемых факторов риска.
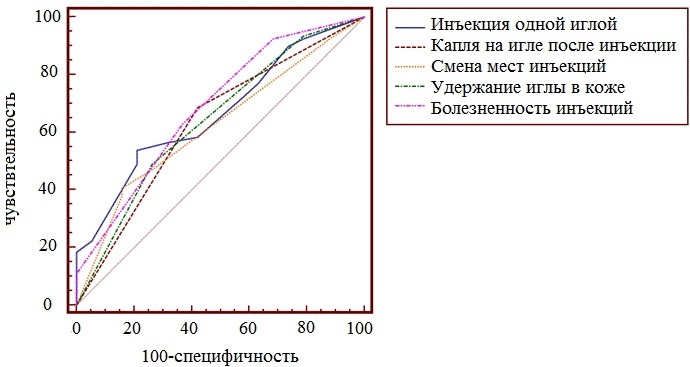
Рис. 6. Показатель AUC для исследуемых факторов риска.
Стоит отметить, что для идеального классификатора график ROC-кривой проходит через верхний левый угол, где доля истинно положительных случаев составляет 100% (идеальная чувствительность). Поэтому чем ближе кривая к верхнему левому углу графика, тем выше предсказательная способность ФР. Чем ближе кривая расположена к диагональной прямой, тем менее эффективен выбранный показатель, поскольку диагональная линия соответствует «бесполезному» классификатору, т.е. полной неразличимости двух классов.
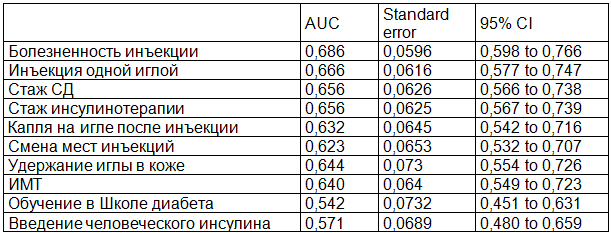
В тоже время, по данным показателей AUC полученные 10 ФР имели статистически значимое влияние на развитие ЛГ. Подробные результаты вычисления AUC представлены в табл. 1.
Таблица 1. Результаты вычисления AUC
Выводы
1. На сегодняшний день проблема ЛГ не только не утратила своей актуальности, но и видоизменилась. Ввиду более высокого качества современных инсулинов и повышения их концентрации ЛГ претерпели ряд изменений, и в большинстве случаев не видны невооруженным глазом, что приводит к созданию иллюзии об их отсутствии. Как показало наше исследование, пальпаторно ЛГ были выявлены у 19,3% пациентов, в то время как по данным УЗИ патологически измененная ПЖК встречалась у 83,6%. Таким образом, можно говорить о том, что проведение УЗИ подкожно-жировой клетчатки всем пациентам, получающим инсулинотерапию, позволит своевременно выявлять ЛГ, что поможет в достижении компенсации углеводного обмена.
2. При изучении вклада различных ФР в возникновение патологически измененной подкожно-жировой клетчатки оказалось, что наибольшее значение в развитии ЛГ у больных СД, получающих инсулинотерапию имеют 10 факторов: отсутствие обучения в Школе диабета, ИМТ, использование человеческого инсулина, смена мест инъекций, количество инъекций одной иглой, наличие капли на конце после инъекции, болезненность инъекции инсулина, длительность заболевания СД и инсулинотерапии, а так же использование игл различной длины. Таким образом, коррекция данных ФР, вероятно, может как снизить риск развития, так и уменьшить прогрессирование уже имеющихся ЛГ.
3. Проблема ЛГ требует дальнейшего изучения с целью формирования групп риска для проведения эффективной первичной и вторичной профилактики.
