Ожирение, особенно абдоминальное (внутрибрюшное), ассоциировано с повышением уровня триацилглицеридов, низкой концентрацией холестерина липопротеидов высокой плотности и увеличением концентрации холестерина липопротеидов низкой плотности, который является основным фактором способствующим формированию атеросклероза.
Большинство данных указывает на то, что при избыточной массе тела и ожирении увеличивается концентрация в сыворотке общего холестерина и холестерина низкой плотности. Данные Национального института здоровья США показали, что с увеличением цифр индекса массы тела (ИМТ) у мужчин прогрессивно увеличивается концентрация холестерина в крови (содержание общего холестерина >240 мг/дл или 6,21 ммоль/л), в то время как у женщин распространенность увеличенного уровня холестерина была самой высокой при ИМТ 25 кг/м2 и 27 кг/м2, и не увеличивалась с дальнейшим ростом цифр ИМТ. Патологическое изменение концентрации липидов (жиров) в сыворотке при ожирении является клинически важным показателем, так как связано с увеличением риска развития системного атеросклероза.
В нашем исследовании приняли участие 70 человек. 30 обследуемых составили контрольную группу, так называемых практически здоровых лиц, без повышенной массы тела из них 14 мужского пола и 16 женского. Средний показатель ИМТ данной группы составил 21,36±0,4 кг/м2, средний возраст – 20,67±0,18 лет.
В группу сравнения вошли 26 обследуемых с повышенной массой тела или ожирением, из них 11 мужского пола и 15 женского. Средний показатель ИМТ данной группы составил 31,48±0,56 кг/м2, средний возраст – 22,38±0,76 лет. Основную группу – 14 обследуемых, составили лица, страдающие сахарным диабетом 2 типа (СД2), из них 7 мужского пола и 7 женского пола. Средний показатель ИМТ данной группы составил 31,12±1,11 кг/м2, средний возраст – 46,15±3,61 лет.
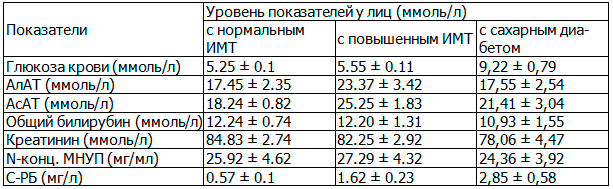
Из исследования исключались лица с вредными привычками (курение и злоупотребление алкоголем) и с грубой дисфункцией органов и систем (тиреотоксикоз, хроническая болезнь почек, печеночная недостаточность, застойная сердечная недостаточность). У всех обследуемых определялись основные биохимические показатели сыворотки крови, такие как аланинаминотраснфераза (АлАТ), аспартатаминотрансфераза (АсАТ), N-концевой мозговой натрий уретический пептид (N-конц. МНУП), С-реактивный белок (С-РБ), и были получены данные, приведенные в табл. 1.
Таблица 1. Биохимические показатели у обследованных лиц
Определялись показатели липидного спектра у обследуемых, такие как общий холестерин (ОХС), липопротеиды высокой плотности (ЛПВП), липопротеиды низкой плотности (ЛПНП), липопротеиды очень низкой плотности (ЛПОНП), триацилглицериды (ТАГ), и индекс атерогенности (ИАГ) (табл. 2).
Таблица 2. Показатели липидного спектра у обследованных лиц
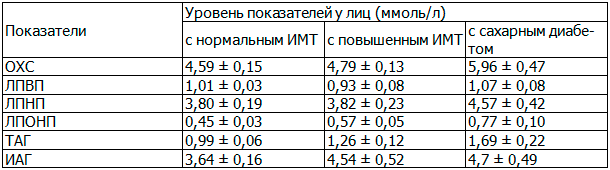
Согласно полученным данным у лиц, имеющих повышенную массу тела или ожирение, а особенно у пациентов, страдающих СД2, наблюдается повышенные концентрации как ОХС, так и атерогенных фракций (ОХС ЛПНП, ОХС ЛПОНП и ТАГ), а соответственно и ИАГ плазмы крови по сравнению с практически здоровыми лицами.
Взаимосвязь ожирения с нарушениями липидного обмена, как в сочетании с СД2, так и без него представляет большой интерес прежде всего в связи с необходимостью разработки эффективных подходов к профилактике поражения органов-мишеней – сердечно-сосудистой системы и почек, тем более что сегодня уже можно с уверенностью говорить о наличии общих механизмов формирования сердечно-сосудистых осложнений и нефропатий метаболической природы.
Изучение взаимосвязей хронической болезни почек с метаболическим синдромом позволяет утверждать, что высокая распространенность снижения скорости клубочковой фильтрации (СКФ) в общей популяции определяется главным образом нефропатиями обменной природы - диабетической, уратной, ассоциированной с ожирением, а также гипертоническим нефроангиосклерозом.
В последние годы становится очевидным, что в общей популяции ожирение является одним из существенных факторов риска ухудшения функции почек. С ростом ИМТ на 10 % вероятность снижения СКФ до уровня, позволяющего диагностировать хроническую болезнь почек, увеличивается почти в 1,3 раза. То обстоятельство, что нарастающие протеинурия и почечная недостаточность могут формироваться при ожирении и в отсутствие нарушений углеводного обмена, артериальной гипертензии и гиперурикемии, позволяет предположить участие факторов, не связанных непосредственно с обменными нарушениями, в развитии поражения почек у этой категории больных [2].
Не вызывает сомнения, что ожирение предрасполагает к формированию нарушений обмена липопротеидов, артериальной гипертонии, гиперурикемии. Проблема патологических метаболических последствий ожирения приобретает особую актуальность в связи с неуклонным увеличением его распространенности, начиная с детского возраста, как в развитых, так и в развивающихся странах.
Абдоминальное ожирение особенно прогностически неблагоприятно и с точки зрения почечных осложнений. Аргументы в пользу существования связи между ожирением, в том числе абдоминальным, микроальбуминурией (МАУ) и почечной недостаточностью имеют в настоящее время убедительное клиническое и патогенетическое обоснование. Доказательством этого, может быть так называемый метаболический путь развития гломерулосклероза. Ведущим фактором повреждающего действия липидов на почки является обусловленное гиперлипидемией отложение липидов в структурах почки. Особое значение придается отложению в почках липопротеидов низкой плотности и аполипротеинов В и Е, часто обнаруживаемых при гломерулонефрите. Так же как и пенистые клетки, основной причиной образования которых считается гиперхолестеринемия, депозиты аполипротеинов являются маркерами липоидоза почечной ткани. Внутриклубочковые пенистые клетки появляются в результате захвата ЛПНП мезангиальными клетками или макрофагами моноцитарного происхождения. Интерстициальные пенистые клетки могут образовываться из эпителия канальцев путем захвата избытка фильтрующихся из крови липидов эпителиальными клетками и проникновения последних в интерстиций, где они фагоцитируются гистиоцитами.
Структурное сходство мезангиальных клеток с гладкомышечными клетками артерий позволяет сблизить гломерулосклероз с атеросклерозом и предположить, что накопление липидов в почечной ткани, как и при атеросклерозе, индуцирует склерозирование.
Диагностика ранних стадий хронической болезни почек (ХБП) базируется на выявлении аномалий состава мочи. Наиболее ранним признаком поражения гломерулярного барьера принято считать развитие МАУ - выделение с мочой минимальных количеств альбумина (в пределах 30-300 мг/сут). Однако появление МАУ является следствием нарушения баланса между процессами клубочковой фильтрации и канальцевой реабсорбции белка [5], т.е. МАУ следует рассматривать как результат повреждения всего нефрона, при этом нарушение реабсорбционной способности канальцев является основным компонентом нарастания альбуминурии.
В последние годы в центре внимания исследователей оказались не клубочковые, а интерстициальные изменения почечной ткани и их роль в прогрессировании нефропатии. По данным ряда авторов, снижение почечных функций более тесно коррелирует с тубулоинтерстициальным фиброзом, чем со степенью повреждения клубочков [4,6].
Важная патогенетическая роль в процессе формирования тубулоинтерстициального фиброза принадлежит эпителиальным клеткам канальцев. Тубулярный эпителий подвергается воздействию как факторов первичного повреждения (гипоксия, гипергликемия), так и вторичных факторов, происходящих из гломерулярного ультрафильтрата (протеинурия, хемокины и цитокины, глюкоза, токсины и др.) [8]. Наиболее выраженное повреждающее действие на канальцевый эпителий оказывает протеинурия (липиды, связанные с альбумином, компоненты активированного комплемента, трансферрин) [7]. Указанные компоненты протеинурии действуют со стороны апикальной поверхности на проксимальные тубулярные клетки и вызывают активацию ядерного фактора транскрипции - NFkB, что приводит к синтезу хемотаксических цитокинов (хемокинов), секреции их через базолатеральные отделы тубулярных клеток и диффузии в интерстиций. Повреждение клеток приводит к продукции ими провоспалительных цитокинов и факторов роста, способствует формированию воспалительного инфильтрата из моноцитов и лимфоцитов, появлению интерстициальных миофибробластов и развитию фиброза [9].
Ранее выявление повреждения канальцевого аппарата почек, можно выявить посредством определения повышенных концентраций в моче ферментов, локализованных в плазматических мембранах, лизосомах или цитозоле клеток проксимальных канальцев [3]. В практическом здравоохранении данные методы используются не часто, хотя многие авторы указывают на их высокую чувствительность.
В зависимости от глубины повреждения в мочу выделяются ферменты, имеющие различную субклеточную локализацию. При незначительном повреждении почечной ткани в моче возрастает активность ферментов, связанных преимущественно с плазматической мембраной, при выраженном повреждении повышается активность цитоплазматических и лизосомальных ферментов, при некрозе клеток увеличивается активность митохондриальных ферментов [1].
Наибольший интерес заслуживает определение активности в моче ферментов, имеющих исключительно почечное происхождение, поскольку их концентрация меняется уже при незначительном, обратимом повреждении почечной ткани. Данными ферментами являются нейтральная α-глюкозидаза (Н-α-гл), изменение концентрации которого непосредственно связано с высвобождением данного фермента из поврежденных клеток и коррелирует со степенью поражения почек, и фермент Л-аланинаминопетидаза (ЛАП). В нормальной моче активность ЛАП незначительна, однако при заболеваниях почек значительно возрастает.
В связи с чем, в нашем исследовании была также оценена степень различия ферментурии в вышеописанных группах.
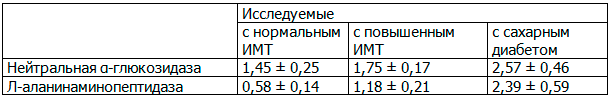
В результате исследования были получены следующие данные (в нкат/1 ммоль креатинина) (табл.3):
Таблица 3. Активность органоспецифичных ферментов у обследуемых лиц
Выводы
- У молодых лиц в возрасте до 25 лет, у которых уже имеется повышение ИМТ выше 25 кг/м2, выявляются нарушения липидного обмена на ранних, доклинических стадиях.
- У пациентов, страдающих сахарным диабетом, наблюдается более выраженное нарушение липидного обмена как за счет повышения концентрации общего холестерина, так и атерогенных фракций по сравнению с практически здоровыми лицами.
- Активность почечных органоспецифичных ферментов: нейтральной α-глюкозидазы и L-аланинаминопептидазы в моче у лиц с ожирением выше, чем в контрольной группе, что вероятно может быть начальным этапом нарушения кровоснабжения ткани почек с последующей повышенной десквамацией эпителия проксимальных почечных канальцев, клинически никак себя не проявляющим на данном этапе.
- Повышение концентрации нейтральной α-глюкозидазы и L-аланинаминопептидазы в моче у лиц с сахарным диабетом, по сравнению с практически здоровыми лицами, может свидетельствовать о значительном разрушении эпителия почечных канальцев, что может являться признаком развития и прогрессирования диабетической нефропатии.
