Актуальность. Ожирение представляет собой эпидемию XXI века. Четверть населения экономически развитых стран мира имеют массу тела, превышающую норму. Согласно прогнозам Всемирной Организации Здравоохранения (ВОЗ), к 2015 г. примерно 2,3 млрд. взрослых людей будут иметь избыточную массу тела и более чем у 700 млн. будет наблюдаться ожирение. Ни у кого нет сомнений, что ожирение – это заболевание, которое требует активного лечения. Причем коррекцией массы тела лучше начинать заниматься в как можно раньше, пока нет серьезных сопутствующих заболеваний [5]. К сожалению, эффективность различных методов снижения массы тела остается невысокой, что подтверждает сложность патогенеза заболевания. Известно, что гормональные и, в частности, нейроэндокринные нарушения наряду с генетическими факторами, индивидуальными особенностями питания могут играть определенную роль в развитии ожирения [2]. Процессы питания и пищевого поведения организма контролируются сложной системой, центральным звеном которой является гуморальная система [8]. В настоящее время известны две основные группы гормонов, регулирующих пищевое поведение: оказывающие орексиогенный эффект и обладающие анорексиогенным действием [1]. Поэтому необходимо к немедикаментозным методам лечения добавлять лекарственные препараты, снижающие вес. В современных национальных рекомендациях разрешено к применению только два лекарственных препарата. Одним из них является сибутрамин – ингибитор обратного захвата серотонина и норадреналина. Сибутрамин пролонгирует действие нейротрансмиттеров мозга, регуляторов аппетита, а с другой стороны, препарат увеличивает скорость метаболизма, индуцируя термогенез. [7]. Результатом накопления серотонина в межнейрональной щели является усиление и пролонгирование чувства насыщения и, как следствие, уменьшение объема потребляемой пищи [6]. Это один из механизмов действия препарата, способствующий снижению аппетита и формированию правильного пищевого поведения пациента. Начальной целью терапии ожирения является снижение массы тела на 5-10% от исходного веса.
Целью нашей работы явилось изучение уровня основных орексиогенных гормонов и их динамика во время снижения массы тела при применении сибутрамина.
Материалы и методы исследования. Критериями включения в исследование служили: женщины в возрасте от 18 до 65 лет, индекс массы тела (ИМТ) более 30 кг/м² или более 27 кг/м² с двумя факторами риска, согласие пациента. Критериями исключения считали органические причины ожирения, сердечная и дыхательная недостаточность, нарушения ритма сердца, ишемическая болезнь сердца (ИБС), психические заболевания, тяжелые нарушения функции печени, почек.
Всего было включено 56 женщин в возрасте 42,9±9,5 лет, с ИМТ 34,6±6,1 кг/м2. Всем пациенткам исходно и после 6 месячного курса приема сибутрамина проводилось общеклиническое, лабораторное и инструментальное обследование. В зависимости от снижения массы тела, было сформировано 3 группы: группа 1 состояла из 26 женщин, снизивших вес менее 5%. Группу 2 составили 18 человек с динамикой веса от 5% до 10%, группа 3 сформирована из 12 пациенток, достигших клинически значимого снижения массы тела ≥ 10%.
Гормональное исследование иммуноферментным анализом включало: определение серотонина (норма 50-220 нг/мл), лептина (1,1-11 нг/мл) грелина (0,04-25,0 нг/мл), адипонектина (5,3-22,5), эндотелина-1 (0,02-10 фмоль/мл), гормона роста (0-12,5 нг/мл).
Статистическую обработку данных проводили с помощью пакета программ «Statistica 6.0». Достоверность различий независимых переменных оценивалась по статистическому критерию Манна-Уитни для непараметрических данных. Для проведения корреляционного анализа был использован критерий Спирмана. Статистически значимыми считались различия при p<0,05. Для нормально распределенных показателей данные представлены в виде Ме - медиана.
Результаты и обсуждение. Пациентки третьей группы были несколько моложе и исходно имели значимо меньшую массу тела, окружность талии, соотношение окружности талии к окружности бедер, чем в первой и второй группах.
После 6-месячного лечения средняя потеря массы тела составила 7,6±6,1 кг, однако динамика веса была различной - от 1 кг до 15 кг.
У пациенток 1 группы среднее снижение веса составило 2% (р=0,004) и варьировало от 1 до 4 кг, с уменьшением ОТ на 2,7±3,5 см (р=0,0001).
Женщины с хорошим эффектом снижения массы тела через 6 месяцев приема сибутрамина снизили вес в среднем на 5,4±5,6 кг, ИМТ с 34,5±7,0 кг/м2 до 31,9±6,5 кг/м2 (р=0,000..). Произошло уменьшение ОТ с 101,3±11,5 до 96,8±12,0 см (р=0,000..). Динамика ИМТ отразилась в перераспределении женщин с увеличением их доли в группе избыточной массы тела и 1 степени ожирения (рис. 1).
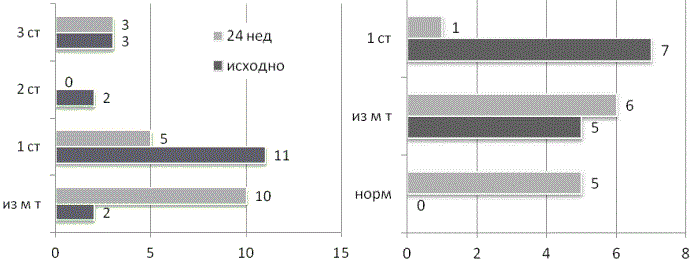
Рис. 1. Динамика ИМТ пациенток снизивших массу тела на 5-9,9%.
Наибольшую эффективность показали женщины с невысокой степенью ожирения со средним снижением массы тела на 13,0±4,6 кг (p=0,002). Изменение ИМТ было с 29,6±2,4 до 26,1±2,1 кг/м2 (р=0,002), а уменьшение окружности талии - с 91,4±5,3 см до 83,1±4,2 (р=0,000.., рис. 2).
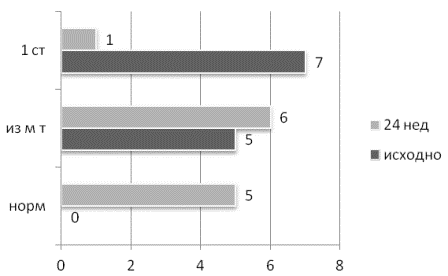
Рис. 2. Динамика ИМТ пациенток, снизивших вес на ≥10%.
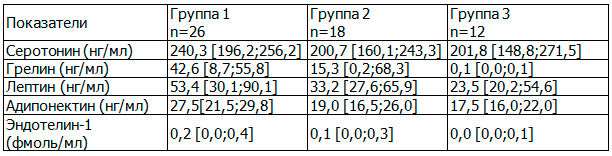
Исходные показатели серотонина, грелина, адипонектина, гормона роста в группе 3 были достоверно ниже, чем в других (табл. 1). Уровень эндотелина-1 по группам не различался.
Таблица 1. Исходное содержание гормонов у женщин с ожирением в группах [Ме [25; 75]
![Таблица 1. Исходное содержание гормонов у женщин с ожирением в группах [Ме [25; 75]](/images/articles/2015/3.2/15113/t1.png)
Группа с «удовлетворительным» снижением массы тела характеризовались наиболее высоким уровнем серотонина, грелина, лептина, адипонектина.
Нами выявлены однонаправленные корреляции массы тела и значения ОТ с грелином (R=0,8, p=0,000..), лептином (R=0,4, p=0,03), эндотелином-1 (R=0,4, p=0,02) во всех группах.
Во всех группах прослеживались четкие взаимоотношения уровня лептина с серотонином (R=0,5, p=0,01), с грелином (R=0,6, p=0,000.), с эндотелином-1 (R=0,5, p=0,008), а также содержание грелина с уровнем эндотелина -1 (R=0,8, p=0,000..), кроме того увеличение веса, индекса массы тела (ИМТ) сопровождалось снижением уровня адипонектина (R=-0,6, p=0,003).
Наряду со снижением массы тела при терапии сибутрамином, произошло изменение гормональных показателей. Как следует из данных табл. 2, это проявлялось достоверным уменьшением уровня лептина, грелина, серотонина, эндотелина-1, и повышением адипонектина в первой группе, что привело к исчезновению достоверных различий по группам.
Таблица 2. Содержание гормонов в сыворотке крови на фоне приема сибутрамина, [Ме [25;75]
Снижение уровня серотонина, практически до его нормализации было достигнуто во второй и третьей группах. Уровень лептина до нормы не уменьшился ни в одной группе.
В процессе лечения отмечалось значительное снижение уровня грелина до нормализации этого показателя в 3 группе.
Проводимая терапия сопровождалась значимым возрастанием низкого уровня адипонектина в третьей группе, содержание которого через 6 месяцев приема сибутрамина увеличилось на 35% (рис. 3). В первой и второй группах имелась тенденция к снижению серотонина, лептина, грелина, эндотелина-1. Общие корреляции свидетельствовали о том, что снижение массы тела сопряжено со снижением уровней серотонина, грелина, лептина, эндотелина-1.

Рис. 3. Динамика гормонов после приема сибутрамина по группам (%).
Произошла значительная динамика изучаемых показателей у больных.
Известно, что снижение уровня грелина происходит после еды, сопровождается чувством сытости. По-видимому, стимуляция секреции грелина вызвано центральными влияниями, а его торможение - постпрандиальными воздействиями из желудка. Примечательно, что при ожирении, в отличии от лиц с нормальным весом, уровень грелина после еды не снижается [10]. Возможно, в этом заключается причина того, что у больных с ожирением не возникает постпрандиального чувства сытости и они соответственно употребляют повышенное количество пищи. Есть исследования, в которых выявлено постсинаптическое деполяризующее действие грелина на серотонинергические нейроны [13]. У наших пациенток уровень грелина достоверно снизился только в группе 3.
Недавно полученные данные, что лептин действует на компоненты серотонинергической системы, не прямо, а опосредованно [14]. Кроме того его уровень может свидетельствовать о лептинрезистентности и характеризовать модуль пациента, резистентного к снижению массы тела [4]. Фармакодинамика сибутрамина предполагает увеличение содержания серотонина, за счет чего, регулируется аппетит, и снижение массы тела.
Однако наши данные свидетельствуют о том, что в крови больных с ожирением имеется достаточно высокий уровень серотонина. Более того, динамика серотонина с приближением к нормативным показателям отмечена только у женщин снизивших вес≥10%. Мы можем предположить наличие серотонинрезистентности, по аналогии с инсулинрезистентностью и лептинрезистентностью у больных с ожирением, и в связи с этим, недостаточный результат применения сибутрамина.
Известно, что содержание адипонектина может являться показателем сосудистого риска [11], а эндотелин-1 считается надежным маркером эндотелиальной дисфункции [3]. В нашей работе показано, что при любом уменьшении веса возникает положительная динамика этих маркеров, а следовательно мы может обсуждать снижение сосудистого риска.
Выводы
- У пациенток с ожирением, отмечается исходно высокий уровень серотонина крови, что, вероятно, связано с серотонинрезистентностью и объясняет недостаточный эффект.
- Отличного эффекта по снижению массы тела добиваются пациентки, имеющие невысокие уровни серотонина, лептина, грелина, эндотелина-1 с последующим их уменьшением.
- Любое снижение массы тела благоприятно отражается на снижение сосудистого риска восстановлении эндотелиальной дисфункции.
Работа выполнена при поддержке ГРАНТа РФФ и 14-04-96027.
