Введение. По данным Всемирной организации здравоохранения (ВОЗ), в 2015 г. 46% женского населения мира будут составлять лица старше 45 лет. Население планеты стареет, продолжительность жизни увеличивается, и современная женщина более трети жизни проводит в постменопаузе. В настоящее время сохранение качества жизни - приоритетное направление здравоохранения [1].
По данным денситометрии распространенность остеопороза в России составляет 30,5-33,1% женщин в возрасте 50 лет и старше. Причем женщины с возрастом могут терять до 50% губчатой и 35% компактной кости [2].
Постменопаузальный остеопороз (ПМОП) представляет собой одну из основных проблем здравоохранения в развитых странах. Приблизительно у каждой третьей женщины после 65 лет наблюдается как минимум один остеопоротический перелом костей [3].
Остеопороз - заболевание скелета, для которого характерны снижение прочности кости и повышение риска переломов [2].
С наступлением менопаузы более чем у 50% женщин наблюдается увеличение массы тела, причем ожирение либо выявляется впервые, либо отмечается его прогрессирование. Гормональная перестройка организма вследствие возрастной инволюции репродуктивной системы сопровождается изменением композиционного состава тела, способствует формированию постменопаузального метаболического синдрома [4].
Остеопороз и ожирение являются широко распространенными заболеваниями у людей после 50 лет и связаны с изменениями строения и состава тела. Эти два нарушения, ранее считавшиеся взаимоисключающими, имеют ряд особенностей и представляют спектр проблем для клиницистов. Обе болезни имеют генетическую основу и подвержены различным влияниям окружающей среды и обе могут присутствовать у одного пациента одновременно, многократно усиливая свое патологическое влияние [5].
По данным ВОЗ, опубликованным в 2004 г., избыточная масса тела или ожирение были зарегистрированы у 1,7 млрд. человек, т.е. приблизительно у 30% жителей планеты [6]. Избыточное количество висцерального жира является главным критерием метаболического синдрома, самостоятельным фактором риска многих тяжелых заболеваний, таких как сахарный диабет 2 типа и атеросклероз. Помимо этого ожирение является фактором риска развития ишемической болезни сердца, гипертонической болезни, ишемического инсульта, рака ободочной кишки, рака молочной железы и др., оказывая негативное влияние на психологическое здоровье людей и качество их жизни. Едва ли не единственным положительным аспектом наличия ожирения ранее считался его протективный эффект в отношении развития остеопороза [7]. Однако последние данные показывают, что тучные женщины имеют более низкие показатели формирования кости, которые измеряются биохимическими маркерами, предполагая, что увеличение жировых отложений подавляет образование новых коллагеновых структур [8].
Существует мнение, что протективную роль в отношении скелета играет нагрузка весом, обусловленная размерами самого скелета, мышечной массой, связочным аппаратом и внутренними органами, в то время как увеличение количества жировой ткани способствует потере костной массы. Так как жировая ткань является активным эндокринным органом, она может влиять на костную массу самостоятельно или опосредованно - через продукцию адипокинов. Однако на сегодняшний день этот вопрос остается открытым. Из известных адипокинов, синтезируемых жировой тканью, наиболее значимое влияние на костный метаболизм оказывают лептин и адипонектин [9].
Таким образом, несмотря на многочисленные свидетельства того, что жировая ткань защищает скелет, число исследований, свидетельствующих об обратном, увеличивается. В связи с чем, целью настоящего исследования явилось изучение состояния костного метаболизма и кальций - фосфорного обмена у женщин в постменопаузе в зависимости от наличия или отсутствия ожирения, а также уровня лептина и адипонектина.
Материал и методы. В исследование вошли 165 женщин в постменопаузальном периоде. Возраст пациенток составил 40-70 лет с физиологической постменопаузой длительностью более 2 лет. Женщины были разделены на две группы: в 1-ю группу (основную) вошли 83 женщины с абдоминальным типом ожирения (индекс массы тела (ИМТ) 36,6±3,3 кг/м2), окружность талии (ОТ) 101±5,0см, во 2-ю группу (контрольную) вошли 82 здоровые женщины (ИМТ 24,2±2,2 кг/м2), ОТ 82,5±3,6 см.
Минеральную плотность костной ткани (МПКТ) определяли методом двухэнергетической рентгеновской абсорциометрии (ДЭРА) с помощью аппарата Lunar Prodigy в поясничном отделе позвоночника (L1-L4), шейке бедренной кости (Neck), большом вертеле (Troch), треугольнике Варда (Ward). Диагностика остеопороза осуществлялась согласно критериям ВОЗ (1994) по Т-критерию, т.е. в стандартных отклонениях (SD) от нормативных показателей пиковой костной массы здоровых женщин. Величина SD до 1 расценивалась как норма, от 1 до 2,5 SD - как остеопения, ниже 2,5 SD - как остеопороз [2].
Состояние кальций - фосфорного обмена определяли с помощью ионселективного электрода на анализаторе электролитов Микролит 3+2 фирмы «Kone» (Финляндия). Уровень экскреции кальция (метод Arsenazo III), фосфора (метод Molybdate), креатинина (метод Jaffe) определяли с помощью коммерческих наборов фирмы «Kone» (Финляндия) на биохимическом анализаторе Konelab - 30.
Костный обмен характеризовали по уровню биохимических маркеров костного ремоделирования. О состоянии костного формирования судили по содержанию в сыворотке крови остеокальцина (ОК), которое определяли иммунорадиометрическим методом с помощью набора Cis Bio International (Франция), и содержанию костной щелочной фосфатазы (КЩФ), которое определяли иммуноферментным методом с использованием моноканальных антител с помощью коммерческих наборов Аlkphase-B (США). Состояние костной резорбции оценивали посредством определения уровня С-концевых телопептидов (СТх), образующихся при деградации коллагена I типа во второй утренней порции мочи и в сыворотке крови иммуноферментным методом с использованием тест-систем Cross Laps ELISA фирмы «Osteometer Bio Tech». Активность костной резорбции также определяли колориметрическим методом по экскреции оксипролина (ОПР) - ОПР с мочой натощак по отношению к экскреции креатинина (Кр) (ОПР/Кр, мкг/мкмоль/Кр).
Определение уровня лептина и адипонектина в сыворотке крови проводилось методом иммуноферментного анализа наборами Human Leptin ELISA (Diagnostics Biochem Canada Inc.) и Human Adiponectin ELISA (Bio Vender).
Результаты исследования обрабатывали при помощи пакета статистических программ Microsoft Excel 98, при этом соблюдались общие рекомендации для медицинских и биологических исследований [10]. Определялись средние арифметические величины (М) и их ошибки (m). С целью выявления значимости (достоверности) различий сопоставляемых средних величин применялся t-критерий Стьюдента и F-критерий Фишера с учетом неоднородности дисперсий в исследуемых группах. Разница средних величин считалась достоверной при р<0,05. Для определения характера связи между изучаемыми параметрами применялся корреляционный анализ с вычислением коэффициента корреляции r и последующим установлением его значимости по критерию t Стьюдента [11], а также использовались коэффициенты линейной корреляции Пирсона, коэффициент ранговой корреляции Спирмена. Для оценки вклада ряда клинико-инструментальных и лабораторных показателей в снижение костной массы было использовано регрессионное моделирование с расчетом многомерных пошаговых регрессий.
Все участники проведенного исследования подписали информированное согласие. Протокол исследования № 78 одобрен этическим комитетом Дагестанской государственной медицинской академии (367000, Республика Дагестан, г. Махачкала, пл. Ленина, 1) от 12.10.2014 г.
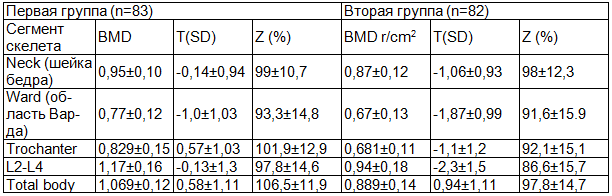
Результаты исследования и обсуждение. Результаты денситометрических исследований, отражающих МПКТ у женщин в постменопаузе с ожирением и без него, представлены в табл. 1.
Таблица 1. Содержание МПКТ во второй и первой группах
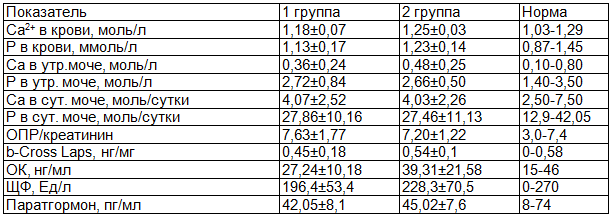
В табл. 2 представлены результаты биохимического исследования показателей кальций - фосфорного обмена и маркеры костного метаболизма у женщин в постменопаузе в зависимости от наличия или отсутствия ожирения. В обследуемых группах не выявлено изменений в показателях кальций - фосфорного обмена и уровня паратгормона, относительно нормы.
Таблица 2. Показатели кальций - фосфорного обмена и костного метаболизма в постменопаузе у женщин с ожирением (1 группа) и у здоровых женщин (2 группа)
В табл. 3 представлены данные по содержанию лептина и адипонектина, полученные в исследуемых группах. Делая вывод из данных таблицы установлено, что гиперлептинемия выявлена у 93% женщин с ожирением и 51% женщин контрольной группы. Достоверных различий по адипонектину в исследуемых группах нет.
Таблица 3. Содержание лептина и адипонектина у женщин в 1 и во 2 группах

Примечание: *р<0,05.
В табл. 4 представлены коэффициенты корреляции между МПКТ, лептином, адипонектином. Лептин прямо пропорционально коррелировал с МПКТ позвоночника (r=0,25, р<0,05) и проксимального отдела бедра (r=0,34, р<0,001). В регрессионном анализе связь лептина с МПКТ осталась высоко достоверной. Обратная корреляция МПКТ в проксимальном отделе и шейке бедра с адипонектином (r=-0,25, р<0,05 и r=-0,28, р<0,01 соответственно) после регрессионного анализа не подтвердилась.
Таблица 4. Коэффициенты корреляции между МПКТ и адипокинами (лептином и адипонектином)
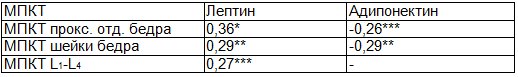
Примечание: *р<0,001, **р<0,01, ***р<0,05.
При сравнении показателей кальций - фосфорного обмена, маркеров костного метаболизма, МПКТ, лептина в 1 и во 2 группах было выявлено, что во 2 группе уровень кальция (р=0,003) и фосфора (р=0,022) в крови ниже, а уровень лептина выше, чем в 1 группе (р<0,00001).
По остальным показателям костного метаболизма статистически значимых различий между группами не выявлено.
В группе женщин с ожирением выявлена положительная зависимость между уровнем лептина, ИМТ и содержанием жировой ткани, и отрицательная зависимость между уровнем адипонектина, ИМТ и содержанием жировой ткани. Зависимости между уровнем лептина, адипонектина и маркерами костного метаболизма обнаружено не было. За исключением отрицательной корреляции лептина с уровнем кальция и положительной с уровнем щелочной фосфатазы крови (r=0,007).
Таким образом, учитывая значимую положительную корреляцию лептина с МПКТ позвоночника и проксимального отдела бедра, которая подтвердилась в регрессионном анализе, можно предположить, что сама по себе жировая масса не оказывает какого-либо существенного эффекта на костную ткань, а ее действие опосредовано через продукцию лептина. Необходимо отметить, что большинство исследований показывают прямую связь лептина в сыворотке крови с МПКТ у человека, другие - обратную. Комплексное действие лептина на кости можно объяснить его способностью, действовать положительно непосредственно в периферических тканях или отрицательно, через центральные механизмы регуляции, приводящие к активации симпатической нервной системы. Поэтому было выдвинуто предложение о «двойном контроле» лептина за формированием костей.
Адипонектин отрицательно коррелировал с МПКТ проксимального отдела бедра, но в регрессионном анализе не показал независимого и значимого эффекта на костную ткань. В нескольких зарубежных работах была обнаружена обратная корреляционная связь адипонектина с МПКТ позвоночника и шейки бедра, после поправки на жировую массу, однако в других исследованиях эта связь не подтвердилась. Таким образом, действие адипонектина на костную ткань неоднозначно и требует дальнейшего изучения.
Заключение. Таким образом, у женщин с ожирением уровень лептина статистически значимо превышал норму и встречался в 93% случаев, тогда как достоверных различий в показателях адипонектина по группам установлено не было. Имеется значительная положительная зависимость между лептином и щелочной фосфатазой (r=0,007), ИМТ и содержанием жировой ткани в организме, и отрицательная зависимость между лептином и уровнем кальция в крови. Установленная достоверная положительная корреляция лептина с МПКТ позвоночника и проксимального отдела бедра позволяет предположить, что жировая масса не оказывает самостоятельного эффекта на МПКТ и ее действие опосредовано продукцией адипокинов. Тем не менее, многие вопросы еще остаются открытыми и требуют дальнейшего изучения в связи с высокими темпами распространения ожирения и остеопороза, пагубно влияющих на качество жизни женщин.
