Диффузный токсический зоб (ДТЗ) занимает ведущие позиции в структуре заболеваний, сопровождающихся тиреотоксикозом: на его долю приходится более 80% всех случаев синдрома тиреотоксикоза [14]. Не смотря на современные методы диагностики и лечения ДТЗ, отмечается дальнейший рост заболеваемости [6, 11]. Так, на 2006 год в разных регионах России на 100 000 населения заболеваемость ДТЗ составляла 5-7 случаев в год, а на 2014 год показатель увеличился и составил до 50 случаев в год [6, 14]. При этом отмечается тенденция к формированию тяжелых форм заболевания, требующих использования в лечении радиоактивного йода или оперативных вмешательств [14].
Одной из возможных причин развития и прогрессирования ДТЗ может послужить дисбаланс в организме макро - и микроэлементов: цинка, селена, меди, магния, железа и других, играющих важную роль в функционировании иммунной и антиоксидантной систем [1, 16, 19, 20, 23]. Согласно многочисленным исследованиям, данным системам, отводится ведущая роль в развитии аутоиммунных заболеваний, в том числе - ДТЗ [11, 12, 29, 25, 27].
К числу важнейших эссенциальных микроэлементов относится цинк [1,4,10]. Однако результаты исследований этого показателя в биологических субстратах больных с ДТЗ у разных авторов неоднозначны [11, 14, 17, 18, 19, 32]. До настоящего времени остается открытым вопрос о содержании цинка в волосах у больных ДТЗ [1, 10]. Не установлен характер связи между уровнем цинка в волосах и значениями антител к рецептору тиреотропного гормона (АТ к р ТТГ), а также размерами щитовидной железы (ЩЖ), состоянием сердечно-сосудистой системы. Решению этих вопросов посвящено настоящее исследование.
Цель исследования: оценить обеспеченность цинком больных с тяжелой и средней степенью ДТЗ и установить наличие связи между значением показателя в волосах и размерами ЩЖ, а также частотой сердечно-сосудистых осложнений.
Материалы и методы. В исследование были включены 133 женщины, поступившие на оперативное лечение в отделение эндокринной хирургии Кемеровской областной клинической больницы с диагнозом ДТЗ средней - 48,9% (n=65) и тяжелой степени тяжести - 51,1% (n=68). Длительность заболевания до 24 месяцев. Пациенты с легкой степенью тиреотоксикоза, впервые выявленным заболеванием, с наличием узловых образований в ЩЖ в исследования не включались. С учетом возраста все обследованные были разделены на 3 группы (согласно классификации Всемирной организации здравоохранения, 2015г.): 1-я группа - 25-44 лет (n=51), 2-я группа - 45-60 лет (n=52), 3-я группа - 61-74 года (n=30). Согласно данным анамнеза, заболеванию ДТЗ предшествовала ишемическая болезнь сердца (ИБС): стенокардия напряжения стабильная I-II функционального класса (ФК) у 22,0% (n=15) больных с тяжелой степенью и у 9,2% (n=6) со средней степенью. Фибрилляция предсердий (ФП) до появления патологии ЩЖ ни у одного больного не зарегистрирована. У всех обследованных было достигнуто состояние клинического эутиреоза. Пациенты продолжали получать стандартную тиреостатическую терапию тиамазолом, неселективными бета-блокаторами - анаприлином. Показаниями к оперативному лечению служили: рецидивирующее течение тиреотоксикоза - 77,4 % (n=103) случаев, большой размер зоба с компрессионным синдромом (объем ЩЖ более 45см3) - 20,3 % (n=27), тяжелая форма течения тиреотоксикоза с нарушениями сердечного ритма по типу ФП и с хронической сердечной недостаточностью (ХСН) - 51,1 % (n=68).
Контролем в исследовании служили пациенты в возрасте 25-74 года, не имевшие патологии ЩЖ и сердечно-сосудистых заболеваний (n=32) (группа сравнения).
У всех обследованных были оценены: в крови показатели ТТГ, св. Т4, концентрация АТ к р ТТГ методом иммуноферментного анализа (ИФА), в волосах - уровень цинка методом атомно-абсорбционной спектрофотометрии. Всем пациентам проведено ультразвуковое исследование (УЗИ) ЩЖ на аппарате Mindray DC-3. За референсный диапазон нормальных показателей принимали: значения ТТГ- 0,4-4,0 мкЕд/мл, свободный тироксин (св. Т4) - 10-22 пмоль/л, АТ к рТТГ ≤1,0 МЕ/л, объем ЩЖ 9-18см3, цинка в волосах - 180-230 мкг/г. Всем пациентам были проведены: электрокардиограмма (ЭКГ) на аппарате Sciller Cardiovit AT-1.
Полученные данные проанализированы с использованием программы Statistica 6.1. Сравнение групп производили с помощью непараметрических критериев - Манна-Уитни, χ2. Количественные признаки описаны медианой и 25-й и 75-й процентилями. Метод Спирмена использовали для определения связи между признаками. Статистически значимыми считали различия при p<0,05.
Результаты и их обсуждение. Результаты исследования свидетельствовали, что при ДТЗ у представителей разных возрастных групп уровень св. Т4 не имеет значимых различий, находится в пределах референсных значений. Литературные данные также указывают на отсутствие возрастных отличий в уровне св. Т4 при клиническом эутиреозе [8, 9]. Показатель ТТГ не отличался у представителей разных возрастных групп, но был снижен у всех пациентов (табл. 1). Это свидетельствовало о том, что достигнутое состояние эутиреоза было лишь клиническим, сохраняется риск рецидива тиреотоксикоза.
Таблица 1. Характеристика функциональных показателей и размеров щитовидной железы у больных с диффузным токсическим зобом
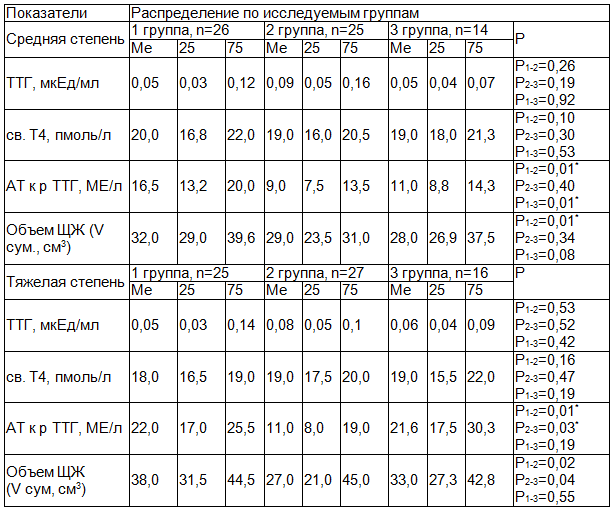
Примечание: здесь и далее * U - критерий Манна-Уитни при сравнении 1 и 2 групп, 1 и 3 групп, 2 и 3 групп, при р<0,05, где Ме – медиана.
В ходе дальнейшего исследования установлено, что все пациенты с ДТЗ имели повышенный уровень АТ к р ТТГ, но в большей степени - лица молодого возраста (р1-2=0,01), а при тяжелой степени ДТЗ - также и пожилые (р2-3=0,03). По мнению исследователей, данный факт объясняется более высокой активностью у молодых всех клеток, в том числе и лимфоцитов [7, 22]. Среди причин высокого титра АТ к рТТГ у пожилых могут быть сопутствующая тиреотоксикозу патология, а также - дисбаланс провоспалительных и противоспалительных цитокинов, способных нарушить синтез иммуноглобулинов, что наблюдается при аутоиммунных заболеваниях [17].
По данным УЗИ, все пациенты с ДТЗ имели увеличенный объем ЩЖ (табл. 1). Этот показатель находился в прямой корреляционной зависимости от титра АТ к рТТГ. Так, при средней тяжести ДТЗ в 1-й группе r=0,738 (р=0,01), во 2-й группе r=0,750 (р=0,01), в 3-й группе r=0,579 (p=0,03). При тяжелом тиреотоксикозе аналогичные показатели составили соответственно: r=0,457 (р=0,02), r=0,744 (р=0,01), r=0,738 (р=0,01). Полученные данные не противоречат литературным [5, 22].
В группе сравнения уровень гормонов находился в пределах референсных значений: у молодых ТТГ-1,25 (1,25:2,0) мкЕд/мл (р=0,01), св.Т4 - 19,0 (18,0:20,0) (р=0,01), в среднем возрасте ТТГ- 1,85 (1,5:2,0) мкЕд/мл (р=0,01), св.Т4 - 17,0 (15,0:18,0) МЕ/л (р=0,01), у пожилых ТТГ-1,95 (1,7:2,1) мкЕд/мл (р=0,00), св.Т4-18,0 (17,0:19,0) МЕ/л (р=0,45). Среди всех обследованных группы сравнения повышения титра АТ к рТТГ не зарегистрировано: у молодых - 0,0 (0:0,3) МЕ/л (р=0,01), в среднем возрасте - 0,0 (0:0,02) МЕ/л (р=0,01), у пожилых - 0,0 (0:0,25) МЕ/л (р=0,01). Размеры ЩЖ были не увеличены: у молодых - 16,3(14,6:17,4) см3 (р=0,01), в среднем возрасте-15,5 (14,0:16,0) см3 (р=0,01), у пожилых -16,0 (14,5:17,5) см3 (р=0,01).
Результаты, полученные в ходе исследования, подтверждают литературные данные о высокой частоте осложнений со стороны сердечно-сосудистой системы у пациентов с ДТЗ [22,33]. Так, при тяжелом тиреотоксикозе 73,5% (n=50) обследованных имели ФП: 68,0% (n=17) -лица молодого возраста, 74,1% (n=20) - среднего и 81,3% (n=13) пожилого возраста. У всех больных с тяжелым тиреотоксикозом диагностирована хроническая сердечная недостаточность (ХСН) - 100,0% (n=68): ХСН I степени - 72,0% (n=49), ХСН II степени - у 28,0% (n=19) При этом развитию ДТЗ ни у одного из обследованных больных не предшествовало ни нарушение ритма сердца, ни ХСН. Йодосодержащие препараты пациенты ранее не принимали. Установлено, что за несколько лет до заболевания ДТЗ у 21 женщины - 15,8% диагностирован ИБС (стенокардия напряжения стабильная I-II ФК): у 15 (22,0%) женщин с тяжелым тиреотоксикозом и 6 женщин (9,2%)- со средней тяжестью тиреотоксикоза. По поводу ИБС назначалась терапия β-блокаторами, антиагрегантами, статинами. У большинства больных с ИБС- 71,4% (n=15) присоединение ДТЗ сопровождалось прогрессированием осложнений со стороны сердечно-сосудистой системы: появлением ФП - у 28,6% (n=6) больных, ХСН- 71,4% (n=15). В этой связи наличие ИБС в анамнезе следует рассматривать как один из факторов риска неблагоприятного прогноза ДТЗ. Согласно литературным данным, даже незначительное повышение уровня тиреоидных гормонов приводит к увеличению работы сердца и потребности миокарда в кислороде, раннему нарушению сердечного ритма, появлению и нарастанию признаков сердечной недостаточности уже в дебюте тиреотоксикоза при отсутствии или стертой картине других его проявлений [18].
В ходе настоящего исследования рассматривалась роль нарушения обеспеченности организма цинком как одной из возможных причин развития и прогрессирования ДТЗ. Среди авторов нет единства мнений по данному вопросу. Согласно результатам одних исследователей, у больных с ДТЗ отмечается снижение уровня цинка в крови, в волосах и увеличение выведения цинка с мочой [19, 22, 34]. Более того, рядом исследователей установлено повышение эффективности терапии ДТЗ при введении в схему лечения заболевания биологических добавок цинка [18, 21]. По мнению других авторов, у больных с ДТЗ содержание цинка в организме повышено [20]. Полученные нами результаты показали, что у большинства больных с ДТЗ тяжелой и средней степени тяжести - у 70,7% (n=94) уровень цинка в волосах снижен и составил 172,0 (147,0:182,5) мкг/г. При тяжелой степени ДТЗ дефицит цинка встречался - у 77,9% (n=53) и составил- 165,5 (124,0:179,0) мкг/г, при средней степени, соответственно: у 63,1% (n=41) (х2=3,54, р1-2=0,06) - 175,0 (157,0:191,5) мкг/г (р1-2=0,002) (табл. 2). Так, при тяжелой степени ДТЗ уровень цинка в волосах снижен у 80,0% (n=20) больных 1-й группы, у 77,8% (n=21) 2-й группы (χ2=0,04, р1-2=0,84) и у 75,0% (n=12) больных 3-й группы (χ2=0,14, р1-3=0,70) (χ2=0,04 р2-3=0,86). При средней степени ДТЗ уровень цинка в волосах снижен у 53,8% (n=14) больных 1-й группы, у 60,0% (n=15) 2-й группы (χ2=0,2, р1-2=0,65) и у 85,7% (n=12) больных 3-й группы (χ2=4,06, р1-3=0,04) (χ2=2,79, р2-3=0,09).
В группе сравнения снижение содержания цинка в волосах встречалось реже - 31,2% (n=10), чем у больных с ДТЗ средней и тяжелой степени (χ2=4,05, р=0,01): в возрасте до 45 лет - у 6,7% пациентов (n=2) (χ2=3,98, р=0,01), в возрасте 45-59 лет - у 11,4% пациентов (n=4) (р=0,01), в возрасте 60-74 лет - у 12,5% пациентов (n=4) (χ2=4,1, р=0,01). При этом уровень микроэлемента - 192,0 (190,0:205,0) мкг/г был выше, чем у больных с ДТЗ, и составил соответственно: 192,0 (191,0:200,0) мкг/г (р=0,01), 191,5 (180,5:200,5) мкг/г (р=0,01), 192,0(190,0:205,0) мкг/г (р=0,01).
Дальнейшие исследования свидетельствовали, что дефицит цинка у обследованных пациентов основной и сравниваемой групп, по-видимому, можно связать с особенностями характера питания, а также повышенным расходованием цинка при тиреотоксикозе. Так, оценивая дневной рацион питания установлено, что для большинства женщин было характерно низкое потребление продуктов, богатых цинком. Оказалось, что морепродукты 65,4% обследованных употребляли не чаще 1 раза в 2 недели. Орехи присутствовали в рационе у всех пациентов реже 1 раза в неделю. Питание имело, главным образом, углеводистую направленность. На недостаточное содержание цинка в рационе у больных с ДТЗ указывают и другие авторы [3]. Пищевой дефицит цинка, в соответствии с литературными данными, приводит к значительному снижению цинк - зависимых ферментов, особенно в условиях повышенного его расхода при тиреотоксикозе [12,22]. Так, несмотря на сходство характера питания, у пациентов с ДТЗ, в отличие от группы сравнения, отмечалось более значимое снижение уровня цинка в волосах. По-видимому, данный факт можно объяснить повышенным расходом микроэлемента на удовлетворение более высоких метаболических потребностей у больных тиреотоксикозом [4].
Таблица 2. Характеристика обеспеченности цинком больных диффузным токсическим зобом; распределение по исследуемым группам; содержание цинка в волосах, мкг/г
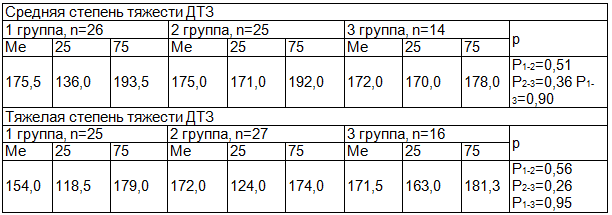
Полученные результаты подтвердили предположение, что снижение обеспеченности организма цинком является одной из возможных причин иммунологических нарушений в организме и развития ДТЗ. Так, согласно результатов корреляционного анализа, уровень АТ к рТТГ при ДТЗ средней и тяжелой степени ассоциирован с содержанием цинка в волосах r=-0,616 (р=0,01). Связь была статистически значимой во всех возрастных группах при ДТЗ тяжелой степени r=-0,652 (р=0,01): в 1-й группе r=-0,775 (р=0,01), во 2-й r=-0,703 (р=0,01), в 3-й группе r=-0,702 (р=0,01), а также при ДТЗ средней степени r=-0,532 (р=0,01): в 1 -й группе r=-0,464 (р=0,02), во 2-й r=-0,548 (р=0,01) группе, в 3-й группе r=-0,703 (р=0,01) . Результаты исследования не расходятся с литературными данными о роли дефицита цинка в организме в развитии аутоиммунных заболеваний, в том числе - ДТЗ [1,11,13,16]. Исследователями ранее было доказано, что в основе иммунологических нарушений при дефиците цинка лежат следующие механизмы: расстройство фагоцитоза, Т-опосредованных клеточных реакций, нарушение созревания В-лимфоцитов в Ig-секретирующие клетки [16, 23].
Проведенный корреляционный анализ показал, что объем ЩЖ ассоциирован с уровнем цинка в волосах r=-0,651 (р=0,01) у больных со средней и тяжелой степенью ДТЗ. Во всех возрастных группах больных ДТЗ тяжелой степени связь была статистически значимой r=-0,749 (р=0,01), в том числе: в 1-й группе r=-0,816 (р=0,01), во 2 -й r=-0,779 (р=0,01) и в 3-й r=-0,542 (р=0,01). Аналогичные результаты получены и у больных со средней степенью ДТЗ: во всех группах r=-0,643 (р=0,01), в 1-й группе r=-0,464 (р=0,02) во 2-й r=-0,672 (р=0,01) в 3-й группе r=-0,612 (р=0,02). Одной из возможных причин появления зоба и прогрессирования его степени на фоне снижения обеспеченности цинком организма, по-видимому, является повышение титра АТ к рТТГ и их стимулирующее влияние на рост ЩЖ [8]. Кроме того, дефицит цинка отражается и на функции макрофагов, способствуя повышению выделения цитокинов (ростовых факторов): трансформирующий фактор роста - альфа, трансформирующий фактор роста - бета [8].
В ходе исследования не выявлено значимых связей между уровнем цинка в волосах и св. Т4, у больных с достигнутым медикаментозным эутиреозом. У всех больных с тяжелой степенью установлена значимая связь между уровнем ТТГ и цинком - r=0,281 (р=0,02).
Согласно полученным результатам, дефицит цинка можно считать одной из возможных причин развития ФП и ХСН у больных с ДТЗ тяжелой степени тяжести. Так, большинство пациентов с ФП- 76,0% (n=38) и ХСН - 77,9% (n=53) имели сниженный уровень цинка в волосах, соответственно: 154,0 (118,8:171,3)мкг/г - при ФП и 164,5 (124,0:179,0)мкг/г - при ХСН, тогда как нормальный показатель зарегистрирован при ФП лишь у 24% (n=12), (p=0,01), при ХСН - у 22,1% (n=15) пациентов (р=0,01). Дефицит цинка в волосах при сочетании ИБС с ДТЗ зарегистрирован у 71,4% больных (n=15), нормальное содержание цинка установлено у 28,6% (n=6, р=0,01).
На дефицит цинка у больных с нарушением ритма и ХСН указывают и другие авторы [32,35,37]. По их данным, развитие ФП и ХСН при дефиците цинка обусловлено снижением антиоксидантной защиты и усилением апоптоза кардиомиоцитов. Известно, что цинк является кофактором активного центра фермента супероксиддисмутазы, играющего ключевую роль в антиоксидантной защите клеток, ДНК, многочисленных транскрипционных факторов от повреждения свободными радикалами [2,13]. Цинку принадлежит важная роль в образовании аденозиттрифосфата (АТФ), необходимого для сокращения миокарда: он входит в состав фермента аргиназы, участвующего в гликолизе, а также в состав фермента лигитиназы, участвующего в синтезе жирных кислот, которые являются субстратом для АТФ [1, 5]. Цинк играет главную роль в биосинтезе белка, в том числе актина и миозина: входит в состав фермента, участвующем в репликации дезоксирибонуклеиновой кислоты (ДНК) и рибонуклеиновой кислоты (РНК). При дефиците цинка активируется перекисное окисление липидов с нарушением целостности кардиомиоцитов, эндотелиальных клеток [1]. Кроме того, дисбаланс цинка может привести к дисбалансу других микроэлементов, в том числе калия, необходимого для сокращения миофибрилл [1]. В литературе приводятся данные о связи дефицита цинка с развитием ИБС. «Антиатеросклеротическая» роль цинка может объясняться накоплением ванадия в эндотелии, который в свою очередь блокирует биосинтез холестерина на стадии мевалоновой кислоты [14, 16].
Таким образом, проведенные исследования показали, что большинство пациентов с ДТЗ тяжелой и средней степени тяжести - 70,7% (n=94), независимо от возраста, имеют пониженное содержание цинка в волосах - 172,0 (147,0:182,5) мкг/г. Недостаточная обеспеченность цинком организма больных ДТЗ связана с несбалансированным характером питания, недостатком в рационе продуктов, насыщенных цинком и, по-видимому, повышенным его расходом. Низкий уровень цинка при ДТЗ тяжелой степени ассоциирован с повышением титра АТ к рТТГ: r=-0,652 (р=0,01), а также объемом ЩЖ: r=-0,749 (р=0,01). Аналогичные результаты получены и у больных со средней степенью тяжести: r=-0,532 (р=0,01), r=-0,643 (р=0,01). При дефиците цинка у больных с ДТЗ тяжелой степени тяжести чаще развивается ХСН - у 77,9% (n=53), а также ФП - у 76,0% (n=38), чем при нормальном уровне микроэлемента, соответственно: у 22,1% (n=15) (р=0,01) и 24,0% (n=12) (р=0,01). Пониженное содержание цинка в волосах чаще регистрируется при наличии ИБС у больных ДТЗ - 71,4% (n=15) ), (р=0,01). Полученные данные позволяют считать дефицит цинка одной из возможных причин неблагоприятного прогноза ДТЗ.
Выводы
- У большинства больных с ДТЗ средней и тяжелой степенью тяжести - 70,7% (n=94) снижено содержание цинка в волосах - 172,0 (147,0:182,5) мкг/г. В группе сравнения дефицит цинка имели 31,2% (n=10) обследованных (р=0,01), уровень микроэлемента составил 192,0 (190,0:205,0)мкг/г (р=0,01).
- При тяжелой степени ДТЗ дефицит цинка встречается чаще - у 77,9% больных и более выражен - 165,5 (124,0:179,0), чем при средней тяжести - у 63,0% (х2=3,54, р1-2=0,06), 175,5 (157,0:191,5)мкг/г (р1-2=0,01).
- Уровень АТ к р ТТГ находится в обратной зависимости от содержания цинка в волосах: при тяжелой степени r=-0,652 (р=0,01), при средней степени ДТЗ r=-0,532 (р=0,01).
- Размеры ЩЖ у больных с ДТЗ ассоциированы с обеспеченностью организма цинком: при тяжелой степени ДТЗ r=-0,749 (р=0,01), при средней степени ДТЗ r=-0,643 (р=0,01).
- При дефиците цинка в волосах среди больных с ДТЗ тяжелой степени чаще встречается сердечная недостаточность - 77,9% (n=53), фибрилляция предсердий - у 76,0% (n=38) чем при нормальном его уровне - 22,1% (n=15), (р=0,01) и 24,0% (n=12) (р=0,01).
- У больных с ДТЗ следует определять уровень цинка в волосах.
