Введение. В последние годы среди известных причин рака молочной железы (РМЖ) (генетические, эндокринные, иммунные, инфекционные) большое значение придается наследственным и приобретённым факторам, приводящим к нарушению метаболизма фолиевой кислоты. Исследования, проведенные рядом авторов в 2002 г. [10,14], показали, что РМЖ может являться следствием ферментопатии фолатного цикла, обусловленной полиморфизмами генов MTHFR, MTRR и MTR, приводящих к дефициту метильных групп и как следствие, к изменению концентрации гомоцистеина и других тиолов в крови.
Дисбаланс, вызванный метаболитами метионинового цикла, может повлиять на уровень метилирования ДНК в клетках, что определяется еще до появления их злокачественного фенотипа, и, следовательно, целенаправленное комплексное исследование позволит повысить точность диагностики пролиферативных заболеваний молочной железы (ПЗМЖ), для выработки критериев ранней диагностики, а коррекция эпигенетических нарушений атипичных клеток является перспективным направлением борьбы со злокачественными новообразованиями.
Цель исследования. Изучить и проанализировать ассоциацию носительства полиморфизмов генов белков фолатного цикла, с уровнем гомоцистеина, цистеина и глутатиона в сыворотке крови у больных пролиферативными заболеваниями молочной железы в Забайкалье.
Материалы и методы. В исследование вошли 35 больных доброкачественными опухолями молочной железы (ДОМЖ) и 77 пациенток с РМЖ, в возрасте 56±10,0 лет. Диагноз, подтвержден гистологическим методом исследования. Контрольную группу составили 144 здоровых женщин Забайкальского края в возрасте 40,2±9,5 лет, считающих себя относительно здоровыми и не имеющих на момент исследования онкологической патологии.
Определение в сыворотке крови цистеина (Cys), гомоцистеина (ГЦ), глутатиона (GSH) осуществляли на базе НИИ молекулярной медицины ФГБОУ ВО ЧГМА методом ВЭЖХ [1].
Экстракцию ДНК из лейкоцитов цельной периферической крови проводили посредством комплекта реагентов «ДНК-Экспресс Кровь» (ООО НПФ «Литех», Россия), согласно инструкции производителя. Генотипирование проводилось с использованием набора «Генетика Метаболизма Фолатов» для выявления полиморфизма: MTHFR-677C>T, MTHFR-1298A>C, MTR-2756A>G, MTRR-66A>G (ООО «НПО ДНК-Технология», Москва) методом полимеразной цепной реакции с детекцией продукта амплификации в режиме реального времени (амплификатор ДТ-96 («ДНК-Технология», Россия)).
Для оценки соответствия распределений наблюдаемых генотипов ожидаемым значениям при равновесии Харди-Вайнберга и для сравнения распределений частот генотипов и аллелей между исследуемыми группами использовали критерий χ2.
Статистический анализ данных проведен с помощью Ms Excel 10.0., Statistica 6.0 и on-line-калькулятора (www.evanmiller.org/ab-testing/). Проверка характера распределения значений в выборке проводилась с помощью теста Shapiro - Wilk's. Использовались непараметрические методы статистического анализа. Статистическую значимость различий определяли по критерию Манна-Уитни. Изучение статистических связей между показателями выборки проводили с помощью корреляционного анализа Спирмена (rs). Показатели считали значимыми при p<0.05.
Результаты и обсуждение. Фолатный обмен - важный поставщик одноуглеродных фрагментов для жизненно важных клеточных процессов (регенерации метионина, биосинтеза пуриновых нуклеотидов). Нарушение метаболизма производных фолиевой кислоты, вследствие недостаточной продукции S-аденозилгомоцистеина в клетке, способствует недостаточному метилированию ДНК, что вызывает нарушение хромосомной сегрегации и анормальную генную экспрессию. Данные процессы могут лежать в основе канцерогенеза [8], и, следовательно, гены белков фолатного цикла могут быть рассмотрены в качестве генов-кандидатов, участвующих в развитии онкологических заболеваний.
В ходе исследования полиморфизма генов белков фолатного цикла, нами обнаружены все искомые мутации в гомо- и гетерозиготном состоянии с частотным подчинением закону Харди-Вайнберга (табл. 1). Установлено, что среди всех исследуемых групп, доля гетерозиготных носителей мутаций MTHFR-А1298С и MTHFR-C677T, составляет 39-51% и 36-51%, а для гомозигот не превышает 9,7% и 13% соответственно. Полиморфизмы генов MTR-A2756G и MTRR-A66G встречаются со следующей частотой: гетерозигот по полиморфному варианту гена составило 28-31% и 40-54 %, а гомозигот - 0-2% и 22-34 %. Можно отметить, что среди больных с ДОМЖ не обнаружено носителей генотипа MTRR-2756G, что может быть объяснено недостаточным количеством наблюдений.
Однако, частоты генотипов и аллелей генов MTHFR-C677T, MTHFR-A1298C, MTR-A2756G, MTRR-A66G не отличались в группах сравнения (в 2-х клинических и контрольной группе) по сравнению с другими европеоидными популяциями и не имели статистически значимых отличий (p>0,05), что, возможно, обусловлено значительной ролью в манифестации клинических проявлений наследственных заболеваний, суммарного эффекта нескольких генов, их взаимодействия, так как канцерогенез - это процесс, который зависит от множества внешних и внутренних факторов, которые могут и способствовать, и противодействовать развитию трансформации клеток.
Таблица 1. Частота полиморфизма генов MTHFR-C677T, MTHFR-A1298C, MTR-A2756G, MTRR-A66G в группах сравнения
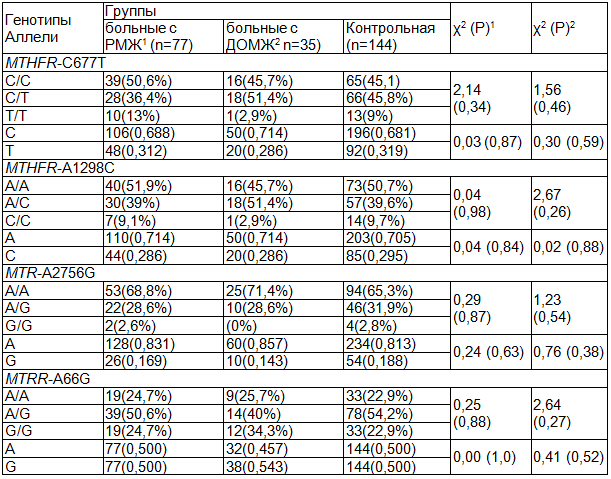
Примечание: 1, 2 (χ2 тест) - сравнение распределений частот генотипов и аллелей групп больных РМЖ и ДОМЖ, с соответствующим показателем в группе контроля.
Учитывая, что сочетание мутаций в разных генах фолатного цикла может значительно влиять на развитие патологического процесса, мы провели сравнение средних сумм баллов, полученных при оценке полиморфизмов в трех группах. Получены статистически не значимые отличия. Так, средняя сумма баллов у больных РМЖ (2,61) и ДОМЖ (2,62) практически не отличалась по сравнению с контрольной группой - 2,62 (р>0,05).
Таким образом, можно предположить, что клиническая значимость изучаемых полиморфизмов, для рассматриваемой группы патологии, проявляется только в определенных условиях, а гены белков фолатного обмена относятся не к главным, осуществляющим координацию всех звеньев патологического процесса, а к дополнительным генам-модификаторам ускоряющим и усугубляющим этот процесс. Но следует учитывать, что получаемые данные ассоциативных исследований зависят от популяции, на которой проводилось исследование, а частоты встречаемости полиморфных локусов могут значительно варьироваться.
Нарушение функции метаболизирующих гомоцистеин-ферментов (MTHFR, MTR, MTRR), приводит к накоплению гомоцистеина и других тиолов в клетках и повышению общего уровня в плазме, что может индуцировать повреждение ДНК [6]. Поэтому мы провели исследование содержания ГЦ, цистеина и глутатиона у больных с ПЗМЖ в зависимости от наличия у них сочетаний выявленных неблагоприятных полиморфизмов (табл. 2).
Таблица 2. Содержание тиолов в исследуемых группах, Me [P25-P75]
![Таблица 2. Содержание тиолов в исследуемых группах, Me [P25-P75]](/images/articles/2016/6.1/16159/t2.png)
Примечание: * p<0,05 - различия статистически значимы по сравнению с соответствующим показателем в группе здорового контроля по критерию Манна-Уитни.
По данным нашего исследования, уровень общего ГЦ у больных РМЖ и ДОМЖ (р<0,05) был достоверно выше, чем у практически здоровых лиц, что вероятно, связано с нарушением метаболизма метионина в злокачественных клетках, и в частности баланса между реметилированием и транссульфированием, а в случае с ДОМЖ - усугублением пролиферативных и регрессивных изменений ткани молочной железы с ненормальным соотношением эпителиального и соединительнотканного компонентов, что может лежать в основе нарушения механизмов реализации противоопухолевой защиты организма (табл. 1). Важно отметить, что полученные результаты в клинических группах превышали оптимальный интервал уровня гомоцистеина - 4,5-7,9 мкмоль/л (в возрасте от 30 до 59 лет), который рассчитан для здоровых лиц в [9].
Но вопрос о цитотоксическом эффекте ГЦ - как физиологического регулятора уровня метилирования, где гипометилирование может приводить к повышенному уровню экспрессии онкогенов, а гиперметилирование ДНК опухолей - подавлять активность генов-супрессоров, остается открытым, поскольку известно, что другие серосодержащие аминокислоты и аминотиолы, такие как цистеин, глутатион, цистеинилглицин циркулирующие в больших концентрациях, не оказывают повреждающего действия на клетки [4,8,10,11].
Концентрация глутатиона у больных РМЖ и ДОМЖ (р<0,05) была выше, чем в контрольной группе, а также отмечалась сильная прямая линейно-корреляционная связь между ГЦ и GSH в обеих клинических группах (R=0,9, р<0,05), что вероятно, является результатом ускоренного катаболизма серосодержащих аминокислот, и может свидетельствовать о случае нарушения утилизации гомоцистеина, сопровождающегося оксидантным стрессом, а, следовательно, и повышением GSH. Глутатион - один из наиболее изученных антиоксидантов, но в отношении канцерогенеза, его роль не достаточно изучена и может носить двойственный характер: как защитный, при участии в устранении и детоксикации канцерогенов, так и патогенный, когда повышенный уровень глутатиона, возможно, способен защитить опухолевые клетки и придать им устойчивость к ряду химиотерапевтических препаратов [8].
Уровень цистеина у больных пролиферативными заболеваниями молочной железы (РМЖ и ДОМЖ (р>0,05)), был вариабелен и не отличался от значений в контрольной группе, что может быть объяснено недостаточным числом наблюдений и/или скрытыми нарушениями метаболизма тиолов. Однако, определялась тенденция к снижению уровня Cys, что по результатам [15], может быть прогностическим признаком РМЖ.
Исследований, с оценкой ассоциаций между уровнем тиолов и раком молочной железы, очень мало в литературе, а результаты противоречивы. Так, у больных с различными видами рака, в том числе рака молочной железы, яичников и поджелудочной железы, отмечалось умеренное повышение концентрации гомоцистеина, которое коррелировало с изменением уровня онкомаркеров [13]. Вероятно, это связано с нарушением метаболизма метионина в злокачественных клетках, и в частности баланса между реметилированием и транссульфированием, который определяет уровень гомоцистеина. А высокий уровень гомоцистеина провоцирует оксидантный стресс за счет нарушения лактат-пируватного обмена. В тоже время, в [7] описывается отсутствие связи между повышенным уровнем гомоцистеина и общим риском развития рака молочной железы, но при этом наблюдается положительная связь с уровнем цистеина. Результаты еще одного, но уже проспективного исследования, напротив, показывают, что более высокие концентрации в плазме общего цистеина прогнозируют снижение риска рака молочной железы [14]. Можно предположить, что такая противоречивость данных, связана с тем, что повышение уровня ГЦ - это результат опухолевого роста, а не его причина [10]. Так как непосредственными источниками гомоцистеина в крови могут выступать именно пролиферирующие клетки, а из пищевых источников в кровь гомоцистеин не поступает [11]. ГЦ может влиять на регуляцию активности многих генов, среди которых есть выполняющие провоспалительные и проапоптозные функции [10], а также на развитие ряда злокачественных опухолей [6,14], и важно отметить, что латентные нарушения обмена гомоцистеина встречаются почти у 50% обследуемых с нормальным уровнем и чаще отмечаются у наиболее клинически тяжелых больных. Повышение GSН и ферментов его метаболизма в плазме крови может свидетельствовать о гибели или апоптозе клеток, а дефицит - о напряжении антиоксидантной защиты, выступая в качестве наиболее раннего показателя усиления окислительных процессов в клетках и способствуя прогрессированию заболевания [2].
Таким образом, можно констатировать различие в метаболизме тиолов между здоровыми и больными ПЗМЖ с учетом отсутствия явной ассоциации с полиморфизмом генов белков фолатного обмена, а также имеются основания говорить о базисной тождественности патогенеза - о нестабильности генома клеток, индуцированной изменением уровня метилирования ДНК, и о снижение антиоксидантной защиты с активностью клеток врожденного иммунитета, которые совместно, могут играть, значительную роль в манифестации клинических проявлений заболеваний.
Вывод
При изучении частот генетического полиморфизма основных белков фолатного цикла в Забайкалье, не отмечено частотного преобладания генотипов и аллелей у больных ПЗМЖ в сравнении с контрольной группой (р>0,05). В сыворотке крови больных пролиферативными заболеваниями молочной железы (как доброкачественными, так и злокачественными) зарегистрирована сравнительная гипергомоцистеинемия, которая была в меньшей степени выражена у пациентов с ДОМЖ, и вероятно, связанная с нарушениями утилизации гомоцистеина в патологически измененных тканях молочной железы, что возможно является дополнительным фактором риска у больных ПЗМЖ, а также более высокая концентрация глутатиона, что может свидетельствовать о нарушении механизмов антиоксидантной защиты в патологически изменённых тканях молочной железы, и является результатом ускоренного катаболизма серосодержащих аминокислот.
Таким образом, полученные результаты свидетельствуют об отсутствии явных ассоциаций генотипов и аллелей генетического полиморфизма основных белков фолатного цикла, с риском развития пролиферативных заболеваний молочной железы в исследуемых группах в Забайкалье, что возможно, обусловлено влиянием определенного сочетания изученных полиморфизмов на активность экспрессируемых ферментов цикла фолиевой кислоты.
