Многие из основных аспектов ГВЗМТ на фоне сахарного диабета в последние десятилетия подверглись существенному пересмотру из-за изменившихся взаимоотношений между микробным возбудителем и организмом человека под действием антибиотиков [2,11].
По данным различных авторов анализ причин неудовлетворительного лечения показал, что из частых причин (70%) была поздняя диагностика, неадекватное хирургическое вмешательство (67%), неполноценное местное лечение (43%) и ошибки в проведении антибактериальной терапии (87,5%) [3,6].
Известно, что инфекционный процесс это взаимодействие макроорганизма с микроорганизмом. Характер и особенности конкретной инфекции определяются с одной стороны, свойствами микроба-возбудителя, с другой - состоянием пораженного макроорганизма. При этом основными параметрами такого взаимоотношения выступают иммунные факторы [1,14,16] определяющие общую реакцию макроорганизма. В тоже время, следует отметить и о состоянии локальных факторов взаимодействия с микробной агрессией. Данный аспект в условиях нарушения микроциркуляции тканей и обмена веществ, имеющее место у больных сахарным диабетом, считается базисным и его необходимо учитывать при разработке новых методов лечения гнойно-воспалительных заболеваний мягких тканей на фоне сахарного диабета.
В связи с этим, целью нашего исследования явилось исследование и оценка особенностей изменения цитологической картины при течении раневого процесса у больных с гнойно-воспалительными заболеваниями мягких тканей на фоне сахарного диабета.
Материал и методы. Проведены исследования 73 пациентов с гнойно-воспалительными заболеваниями мягких тканей (ГВЗМТ) на фоне сахарного диабета (СД), находившихся на стационарном лечении в Республиканском Центре гнойной хирургии и хирургических осложнений сахарного диабета в 2017 году. Средний возраст больных составил 68,1±3,8 лет. Больных в возрасте от 41 и старше составило 93,1%. Среди обследованных было 32 мужчин (43,8%) и 41 женщина (56,2%).
Анализ распространенности гнойно-воспалительного процесса у больных с ГВЗМТ на фоне СД позволил выявить, что в большей степени его локализация отмечена в области туловища (59%), почти в одинаковой количестве были расположения в области нижней конечности (17,8%) и промежности (13,7%). У 95,9% больных (70 пациентов) был диагностирован сахарный диабет II типа.
Основной принцип лечения заключался в кратковременной предоперационной подготовке, включающей взятие клинико-биохимических анализов крови и с началом эмпирической антибактериальной терапии. Больные подвергались обязательному осмотру эндокринолога, с коррекцией уровня гликемии, при этом высокие показатели сахара крови не являлись противопоказанием к проведению оперативного вмешательства. Больным назначали инсулин с поддержанием уровня сахара не выше 9,0 ммоль/л. Дозы инсулина варьировали в зависимости от типа сахарного диабета, тяжести состояния.
Сущностью оперативного вмешательства основывалась на адекватном широком вскрытии гнойного очага с санацией всех имеющихся затеков и карманов. Вскрытие флегмон и некрэктомии выполнялись по общепринятым стандартам. В зависимости от протяженности и глубины патологического процесса раны либо оставались открытыми, чему мы отдавали предпочтение, либо зашивались наглухо с оставлением 2-х просветных дренажей, с последующим проведением лаважа антисептиками. В послеоперационном периоде применяли методы физического воздействия на рану (ультразвуковая кавитация растворами, содержащими антибиотики и антисептики, лазерная терапия, рентгенотерапия). Перевязки ран проводили ежедневно в зависимости от фазы воспалительного процесса с применением водорастворимых гиперосмолярных мазей, а также современные перевязочные материалы.
Комплекс консервативной терапии включал: антибактериальную терапию в зависимости от результатов посева из раны в аэробных и анаэробных условиях и системную противогрибковую терапию; дезинтоксикационную терапию; мероприятия по нормализации всех видов обмена, нарушенных при диабете, включая перевод на инсулинотерапию под контролем гликемии; антикоагулянтную и дезагрегационную терапию под контролем времени свертывания и коагулограммы; препараты, улучшающие микроциркуляцию тканей пораженной области; лечение сопутствующих заболеваний.
Все больные, как правило, поступали в клинику по неотложным показаниям и подвергались всестороннему клиническому обследованию с применением современных клинико-биохимических и инструментальных методов исследования. В динамике проводимого комплексного лечения оценивали местную выраженность воспалительных проявлений (гиперемия, отечность, инфильтрация тканей в области раны, количество и характер раневого отделяемого, интенсивность некролиза, сроки и степень эпителизации раны и формирования рубцовой ткани).
Материалом для микробиологических исследований служил гнойной экссудат, взятый из глубоких отделов раны сразу после вскрытия патологического очага. Эффективность проводимых лечебных мероприятий оценивали по результатам бактериологических исследований раневого экссудата.
Морфологические исследования включали оценку цитологической картины отпечатки раневой поверхности в динамике проводимого лечения. При микроскопическом исследовании препаратов учитывали морфологические признаки клеточных и тканевых элементов. Кроме этого обращали внимание на функциональные признаки, имеющиеся место в цитологическом материале (наличие слизи, белковой массы, эритроцитов, воспалительных лейкоцитарных клеток, микроорганизмов, признаков лечебного эффекта в виде патоморфоза структурных элементов мазков). Фоновыми материалами цитологического препарата были детрит, мелкие белковые зерна, жировые капли, кристаллы, гематоидин, холестерин и др. Окраску цитологического материала проводили азур-эозиновыми смесями. С целью систематизации морфологических препаратов все цитограммы нами были разделены на дегенеративные, дегенеративно-воспалительные, воспалительные, воспалительно-регенеративные, регенеративно-воспалительные и регенераторные.
Результаты и обсуждение. Распределение пациентов с ГВЗМТ на фоне СД выявила преобладание патологических процессов протекающих под нозологической единицей в виде флегмоны. Основными причинами развития флегмон мягких тканей у больных на фоне СД:
- острые локальные гнойно-воспалительные и другие заболевания кожи и подкожной жировой клетчатки - 13,7% (фурункул - 1,3%, карбункул - 3,9 %, гидраденит - 1,3 %, лимфаденит - 1,3%, рожистое воспаление - 1,3 %, парапроктиты –3,9%);
- открытые и закрытые повреждения кожных покровов и глубжележащих тканей (9,5%), ожоги (1,3%), отморожения (2,6%), укусы насекомых (3,9%);
- острые и хронические воспалительные заболевания и другие заболевания органов ротовой (1,3%), грудной (3,9%) и брюшной (2,6%) полости;
- острые и хронические заболевания и процессы, протекающие с нарушением целостности кожных покровов (трофические язвы - 2,6%, пролежни - 3,9 %);
- нагноение послеоперационных ран – у 2 больных (2,6%) (послеоперационная флегмона);
- инъекции препаратов, лечебные и диагностические инвазивные манипуляции и пункции –10,9% (8 больных) - постинъекционная флегмона;
- гнойные метастазы при сепсисе – 2,6% (метастатические флегмоны);
В 12,3% случаев (9 больных) причину развития флегмоны установить не удалось даже при самом тщательном сборе анамнеза, осмотре и обследовании больного.
В 61,4% случаев (45 больных) флегмона развивалась в результате повреждения кожных покровов. Нередко она возникала на фоне инфицирования незначительных поверхностных повреждений кожи в виде ссадин, царапин, расчесов, мелких неглубоких ран, которые не были подвергнуты своевременной и адекватной обработке. У (13,7%) 10 больных флегмона развилась в результате неблагоприятного течения локальных гнойно-воспалительных заболеваний кожи и подкожной жировой клетчатки (фурункул, карбункул, пиодермия, гидраденит). У 2 больных (2,8% случаев) флегмона возникла после инъекции различных лекарственных средств. У 8 больных (10,9% случаев) она развилась после различных оперативных вмешательств.
Микробная этиология флегмон значительно варьировала в зависимости от причины ее возникновения и локализации. В целом превалировали грамположительные кокки, и, прежде всего Staphylococcus aureus (68,9%) 50 случаев и Streptococcus spp. (17,8%) 12 случаев, бактерии семейства Enterobacteriaceae (13,9%) 10 случаев, Pseudomonas aeruginosa (4,3%) у 3 больных. Клинико-бактериологические признаки анаэробной неклостридиальной инфекции выявлялись в общей сложности у 9,58% (7) больных.
Цитологическое исследование раневой поверхности в динамике проводимого лечения у больных с ГВЗМТ на фоне СД показали картину с фоновым жирно-белковый детритом, которые протекали с дистрофическими и некробиотическими изменениями тканевых элементов. Часто отмечались сочетания данного вида изменения с наличием с воспалительных клеток, что является характерным для данного вида патологического процесса [1,7,11].
Тканевые элементы были подвергнуты под действием микроорганизмов и воспалительного процесса деструктивным и некробиотическим изменениям в виде вакуолизации, разрыхления и гомогенизации ядерно-цитоплазматических структур (рис.1).
Со стороны гистиоцитарных клеток отмечалась некоторая активация в виде расширения объема цитоплазмы и гиперхромазии ядер (рис.2).
В ранние сроки лечения и течения гнойно-воспалительного процесса в цитологическом материале преобладали полинуклеарные лейкоциты (рис.3), а более поздние сроки - лейкоцитарная инфильтрация гистиоцитарных и лимфоидных клеток (рис.4).
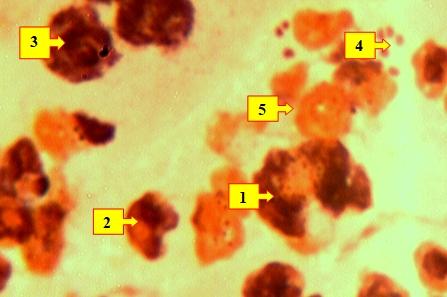
Рис. 1. Мазок отпечаток раны больного Д.Д. 1948 г.р. и.б.№1175/384, 2-е сутки лечения. Видны нейтрофильные лейкоциты (1), разрушенные лейкоциты (2), лимфоциты (3), микроорганизмы (4), белковые вещества (5). Окраска: Рамоновский-Гимза. Ув: ок.10, об. 40.
В наших исследованиях в морфологических препаратах так же были видны внеклеточные гранулы и глыбки бесструктурных масс детрита различной величины. Сочетание такого цитологического альянса по видимому было обусловлено именно наличием фонового патологического процесса в виде сахарного диабета [9,13,15].
Детрит имел сероватый оттенок при его бельковом происхождении. Желтоватый оттенок свидетельствовал о наличие некротического вещества жиролипоидной природы [4,9,15].
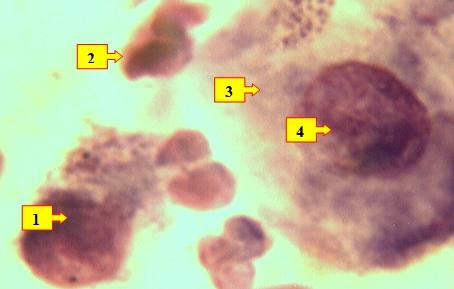
Рис. 2. Мазок отпечаток раны больного Т.И. 1961 г.р. и.б№250/94, 3-е сутки лечения. Определяются нейтрофильные лейкоциты (1), разрушенные лейкоциты (2), гистиоциты (3) с активацией ядра (4) в виде гиперхромазии с расширением цитоплазмы. Окраска: Ромоновский-Гимза. Ув: ок.10, об. 40.
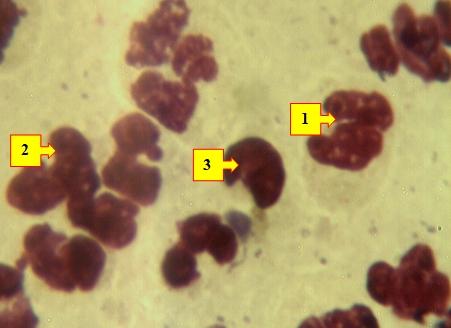
Рис. 3. Мазок отпечаток раны больного Т.И. 1961 г.р. и.б№250/94, 3-е сутки лечения. Определяются сегментоядерные нейтрофилы (1) в виде гиперхромазии, разрушенные лейкоциты (2) и лимфоциты (3). Окраска: Ромоновский-Гимза. Ув: ок.10, об. 40.
Характер детрита и белковой массы в составе цитологического препарата, как известно, определяет вид бактерий [1,8]. При наличии бесструктурных масс жиролипидной природы, в наших исследованиях, инфекция была вызвана грамположительными кокками, которые были покрыты снаружи липосахаридной оболочкой. В ряде случаев в цитологическом отпечатке в составе детрита преобладала белковая масса. Данный вариант поражения был вызван грамотрицательными микроорганизмами [1,8]. Все они имели гликопротеидную наружную оболочку. Результаты микроскопического исследования показали, что характер гнойно-воспалительной раны мягких тканей определил клеточный состав воспалительной инфильтрации.
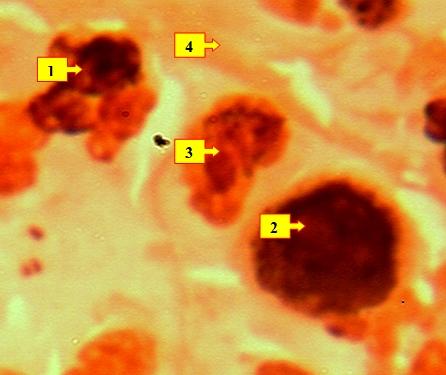
Рис. 4. На фоне уплотнения фонового белкового вещества (4) наличие лимфоидных клеток (2), а также нейтрофильные лейкоциты (1) и гистиоциты. Окраска: Ромоновский-Гимза. Ув: ок.10, об. 40.
В ранние сроки заболевания на цитологических препаратах были также обнаружены полинуклеарные гранулярные лейкоциты. Причем, они имели разные формы и величины, ядерные структуры их часто были окрашены гиперхромный цвет, набухшие с утолщением ядерных мостиков между хроматинными сегментами.
Также были гранулоциты с кариолитическими и кариоректическими изменениями ядерных структур. Иногда хроматиновое вещество ядер находилось в состоянии распыления и распада (рис.5).
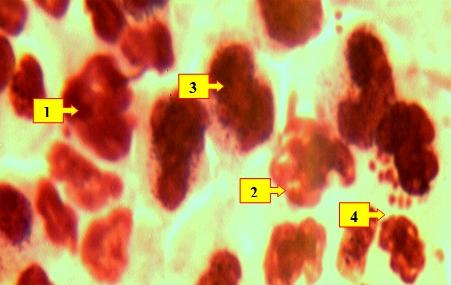
Рис. 5. Нейтрофильные лейкоциты (1) в состоянии кариолизиза и кариопикноза ядерных структур, (разрушенные лейкоциты (2), лимфоциты (3), микроорганизмы (4)) . Окраска: Ромоновский-Гимза. Ув: ок.10, об. 40.
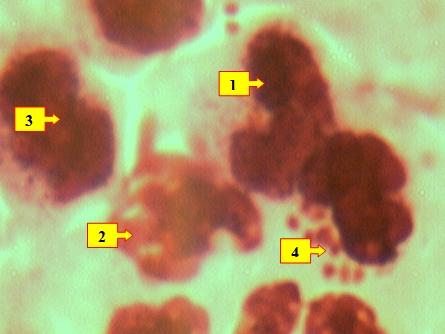
Рис. 6. Нейтрофильные лейкоциты (1) с признаками фагоцитоза (разрушенные лейкоциты (2), лимфоциты (3), микроорганизмы (4)). Окраска: Ромоновский-Гимза. Ув: ок.10, об. 40.
Цитоплазма полинуклеарных лейкоцитов также была набухшая, расширена в объеме, гранулярный материал часто находился в состоянии активации в виде разрыва и растворения или излития в окружающее пространство. В цитоплазме нейтрофильных лейкоцитов было обнаружено фагоцитированные тельца (рис.6).
В воспалительных клетках показатель ядерно-цитоплазматического отношения был низким: в первые сутки лечения в среднем оно составило 0,079±0,0016 %, а в последующие сроки лечения существенно не повышалось (табл. 1).
Таблица 1. Изменение ядерно-цитоплазматического соотношения в процессе лечения больных с ГВЗМТ на фоне СД (%)
![]()
Известно, что данное отношение определяется между площадями цитоплазмы и ядра живой клетки [5,12]. Обладая важной морфологической характеристикой, ядерно-цитоплазматическое отношение позволяет оценить уровень метаболизма, выявить проявление компенсаторных реакций [5,7].
При этом в случаях, когда в цитологических препаратах было обнаружено наличие смешанной флоры, а среди гранулярных лейкоцитов наличие единичных эозинофильных лейкоцитов, констатировали присоединение к воспалительным заболеваниям аутоиммунных процессов [8].
Выводы:
1) Результаты цитологического исследования мазков-отпечатков гнойно-воспалительной раны мягких тканей на фоне сахарного диабета показали, что микроскопическая картина мазка характеризовалась, прежде всего, наличием микробно-клеточного фактора в сочетании с фоновыми элементами.
2) Основными признаками инфекционного гнойного воспалительного процесса явились наличие в мазке микроорганизмов разной формы. В ранние сроки заболевания преобладали кокковая инфекция и полинуклеарная лейкоцитарная инфильтрация, а в более поздние сроки в составе лейкоцитарной инфильтрации обнаруживается небольшое количество лимфо-гистиоцитарных клеток. Все это свидетельствовало о наличии тесной взаимосвязи между течением раневого процесса и ролью специфических клеток лейкоцитарного ряда.
