Актуальность. По данным литературы, каждая 4-5 женщина в мире больна миомой матки. Несмотря на низкую вероятность малигнизации (1%) до 2/3 пациенток страдающих миомой матки рано или поздно подвергаются оперативному лечению, причем 60-90% всех оперативных вмешательств, выполненных по поводу миомы матки, являются радикальными, приводящими к потере репродуктивной и менструальной функции женщины [6,9].
Миома матки достаточно часто сочетается с различными экстрагенитальными заболеваниями; ожирением (64%), функциональными нарушениями желудочно-кишечного тракта (40%), гипертонической болезнью (19%) и др. [7,8]. Многочисленными исследованиями доказано, что избыточный вес женщины и частые стрессовые ситуации относятся к факторам, способствующим развитию миомы матки [7,8].
Патогенез миомы матки остается спорным и вызывает много вопросов. Причиной тому может быть тот факт, что миома матки имеет автономный рост, обусловленный взаимодействием ростовых факторов и образованием гормонально чувствительных и ростовых рецепторов [6,9].
Современные исследования подтверждают ведущую роль эстрогенов в патогенезе миомы матки. Следует учесть, что свободные фракции эстрогенов (неконъюгированные), обладают более выраженной способностью стимулировать гиперпластические процессы в органах-мишенях [6,9].
Нарушение гормонального фона влияет не только на рост миомы матки, но также оказывает различное влияние на функции многих органов и систем. Наиболее часто происходят нарушения функции печени [3,7,6].
Метаболические и катаболические реакции, происходящие в печени, уравновешивают различные секреторные процессы, в частности, здесь активируются, реактивируются и взаимопревращаются гормоны. Изменение превращений гормонов влияет на количество их активных форм в крови и тканях. Усиление метаболических реакций приводит к увеличению концентрации свободных фракции и подавлению синтеза специфических транспортных белков [7]. Последнее, несомненно, сказывается на процессах формирования и роста миомы матки.
На основе вышеизложенного можно сделать вывод, что функциональное состояние печени тесно связаны с развитием миомы матки, так как её рост обусловлен дисфункцией гормонального статуса, где немаловажная роль отводится печени.
Между тем, не вполне ясно, какие взаимосвязи существуют между развитием миомы матки и нарушением функции печени, и что именно является первопричиной – формирование и рост миомы и возникающие на этом фоне изменения функций печени, либо наоборот.
Имеющиеся в литературе данные о функциональном состоянии печени у больных миомой матки противоречивы, так как были получены при анализе небольшого и неоднородного количества клинических наблюдений. Практически не освещен вопрос комплексной диагностики функционального состояния печени.
Материал и методы исследования. Проведено обследование 37 больных с миомой матки, страдавших дисфункциональным маточным кровотечением в возрасте от 40 до 48 лет.
Наряду с клинико-анамнестическими методами исследования в комплекс диагностических мероприятий входило эхографическое исследование, допплерометрия органов малого таза, исследование некоторых биохимических показателей.
Гормоны эстрадиол, прогестерон, глобулин, связывающие половые гормоны, орозомукоид, 25-гидроксихилекальциферол исследовали иммуноферментным методом на анализаторе фирмы «HUMAN», используемые наборы также были представлены этой же фирмой кальций в сыворотке крови, гамма-глутамилтранспептидаза, щелочной фосфатаза исследованы на биохимической анализаторе используя наборы фирмы «HUMAN» циркулирующие иммунные комплексы исследовали используя 7% раствор полиэтиленгликоля. Содержание свободных жирных кислот в сыворотке крови определяли с помощью тест-системы NEFAFS фирмы «Diasys» (Германия). Активность малатдегидрогеназы определяли оптическим методом Варбурга. Пи-глутатион-S-трансферазу иммуноферментным методом используя наборы компании Биохиммак (Россия).
Статистическую обработку данных осуществляли методом вариационной статистики с применением t-критерия Стьюдента.
Результаты исследования и их обсуждение. Ультразвуковые исследования проводили во вторую фазу при сохраненном менструальном цикле с использованием трансабдоминального доступа конвексным датчиком с частотой 3,5мГц и с применением трансвагинального доступа конвексным датчиком с частотой 8 мГц. При исследовании с использованием серой шкалы оценивали размеры матки, величину, структуру, число и локализацию узлов, состояние эндометрия и яичников. Миоматозные узлы имели интрамуральную или интрамурально-субсерозную локализацию и размеры от 3 до 7 см в диаметре, что определялось эхографически. Миома матки в пременопаузальном периоде у 68% женщин характеризовалась быстрым (в теч.1,5лет) увеличением размеров миоматозных узлов (в среднем на 3,5±0,5см), у остальных 32% пациенток не отмечен быстрый рост опухоли. Контрольную группу составили 13 здоровых женщин фертильного возраста, которые поступили для введения ВМС.
Пациентки основной группы значительно чаще, чем здоровые женщины использовали внутриматочную контрацепцию (41,4%), что подтверждает роль ВМС как фактора риска развития миомы матки. Частота медицинских абортов в среднем составила 68,3%. Соматический анамнез женщин с миомой матки был значительно чаще отягощен по сравнению с контрольной группой детскими инфекционными и респираторно-вирусными заболеваниями. Выявленные особенности сопутствующей экстрагенитальной патологии у больных с миомой матки соответствуют данным литературы и характеризуются высокой частотой заболеваний сердечно-сосудистой системы, нарушений липидного обмена.
Приведенные результаты исследования свидетельствуют о том, что у обследуемых лиц с миомой матки отмечается гиперэстрогения, выражающаяся в увеличении концентрации эстрадиола в крови в среднем в 1,8 раза при сравнении с контрольной группой. Уровень прогестерона в плазме крови у женщин с миомой матки также имеет тенденцию к повышению и в среднем был равен 7,21±0,54 мг/мл, что в 7,8 раза выше исходных величин (р<0,05%). Не исключено, что сочетанное действие эстрадиола и прогестерона стимулирует пролиферативный потенциал клеток миомы. Немаловажную роль в этом процессе играют местные ауто- и паракринные факоры (фактор некроза опухолей-ФНОα, цитокины) в реализации влияния половых стероидов на пролиферацию опухолевой ткани. Известно, что большая часть глобулина, связывающего половые гормоны и орозомукоида синтезируется в гепатоцитах печени и отмеченные нами достоверные снижения их концентрации в плазме крови, видимо и являются одной из причин повышения свободных форм гормона, обладающих более выраженной способностью стимулировать гиперпластические процессы в органах мишенях (миометрий и ткани миомы).
Известно, что эстрадиол метаболизируется в печени при участие 17-гидрокси стероид дегидрогеназы и цитохрома Р-450. Данный метаболический процесс регулируется прогестероном и ускоряется при участии кофактора – иона кальция. Наблюдаемый нами низкий уровень орозомукоида - связывающего прогестерон, видимо способствует увеличению концентрации свободного прогестерона в слюне в 5 раз и тем самым ускоряет процесс гидроксилирования и конъюгации эстрадиола.
Таблица 1. Биохимические показатели крови у женщин с миомой матки
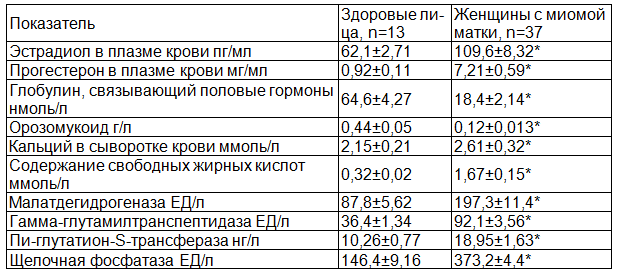
Примечание: * - достоверность различий р<0,05 при сравнении с контролем.
Анализ количественных характеристик свободных жирных кислот в крови у женщин с миомой матки, в сравнении с таковыми у здоровых лиц показал достоверное различие в показателях. Так уровень свободных жирных кислот у здоровых лиц составил 0,32±0,02 ммоль/л и был достоверно ниже (р<0,05), чем у женщин с миомой матки (1,67±0,15 ммоль/л).
Как известно, попадая в системный кровоток свободные жирные кислоты, способствуют усилению состояния инсулино-резистентности, подавляют процесс гликолиза и образуют прочную связь с альбумином. Ингибирование процесса гликолиза приводит к компенсированной активации пентозафосфатного цикла и процесса глюконеогенеза, т.е. в данной ситуации малат используется для синтеза глюкозы и жирных кислот. Результаты исследований показали, что у обследуемых женщин с миомой матки активность митохондриального фермента-малатдегидрогеназы в сыворотке крови повышается в 2 раза, что указывает на нарушение структуры митохондрий гепатоцитов и выхода митохондриального фермента в сыворотку крови.
Пи-глутатион-S-трансфераза находится в цитоплазме клеток желчных канальцев печени и является маркером повреждения желчных канальцев. Как видно из полученных результатов, активность пи-глутатион-S-трансфераза достоверно повышается у женщин с миомой матки в среднем в 1,8 раза (р<0,05), что указывает на повреждение желчных канальцев и развития холестатического синдрома. Последнее подтверждается повышением активности ферментов гамма-глутамилранспептидазы и щелочной фосфатазы у женщин с миомой матки.
Таким образом, в патогенезе миомы матки ведущую роль играет функциональное состояние печени, где одно из ведущих значений играет холестаз. Ведущим фактором повреждения клеток печени при обструктивном холестазе следует признать повышение уровня свободных жирных кислот, нарушения метаболизма в гепатоцитах на фоне гепатотоксического и цитотоксического эффекта гидрофобных желчных кислот, истощение энергетического субстрата (АТФ) и в конечном итоге гибель гепатоцитов.
Вышеизложенное усугубляет процесс конъюгации стероидных гормонов и синтез белка, что и является причиной повышения свободных форм гормонов, которая играет немаловажную роль в индукции развития миомы матки.
