Введение. Современный этап изучения патогенеза опухолевых заболеваний тела матки (миома, рак) характеризуется определением роли гуморальных факторов роста в реализации ауто- и паракринных влияний на пролиферативный процесс в мио- и эндометрии [2]. В основе развития данных заболеваний часть лежат нарушения механизмов роста и апоптоза клеток, которые регулируются клеточными и внеклеточными компонентами на молекулярном уровне. В этой связи факторы, способствующие активации клеточной пролиферации в мио- и эндометрии, следует рассматривать как факторы риска развития неопластических процессов в теле матки [4]. Имеющиеся оценки анализа этиологических факторов и факторов риска развития гиперпластических процессов мио- и эндометрия свидетельствует о гетерогенности факторов риска, на фоне которых возможно развитие опухолевого заболеваний [6]. Это могут быть выраженные гормональные нарушения, инфекционно-воспалительные изменения в урогенитальной системе и за её пределами, приводящие к локальным и системным метаболическим сдвигам, формированию феномена иммунологической толерантности и нарушению регуляции пролиферативной активности клеток мио- и эндометрия [1, 2]. Особое значение в реализации противоопухолевой защиты уделяется цитокинам – пептидам, синтезируемым иммунокомпетентными клетками и опосредующим реакции иммунитета при опухолевом росте. Влияние цитокинов на опухолевый рост многогранно. Установлено, что фактор некроза опухоли (TNFα) в больших концентрациях активирует проапоптотические сигнальные пути, т.е. останавливает процессы клеточного деления и вызывает гибель клеток, но в малых дозах - действует как фактор стимуляции циклооксигеназы-2, фермента участвующего в биосинтезе простагландинов. Последние являются активаторами ядерный фактор транскрипции NF-kB, который включает экспрессию генов эпидермального фактора роста (EGFR), циклинзависимых киназ (CDK), фактора роста эндотелия сосудов (VEGF), инсулиноподобного фактора роста (IGF) и других факторов, стимулирующих клеточную пролиферацию [7, 9, 11]. Исследование молекулярных механизмов гиперпластических процессов и поиск путей их коррекции является важной задачей современной медицины.
Современные утверждения о защитной роли жирорастворимых витаминов (А, Е, каротин и др.) в отношении опухолевых заболеваний базируется на результатах большого количества экспериментальных и клинических исследований. Было установлено, что для профилактики рака эндометрия имеют значение ретинол, β-каротин и витамин E [17]. При канцерогенезе эти соединения действуют антипролиферативно, усиливая дифференцирование клеток, снижая индекс деления и потенцируя апоптоз [14]. Среди аналогов витамина E мощным апоптогеном является альфа-токоферол сукцинат (alpha-TOS). Механизм альфа-TOS-индуцированного апоптоза использует различные пути передачи сигналов: связанные с трансформирующим фактором роста бета, Fas и митоген-активированную протеин-киназу и связанный с фактором некроза опухоли апотоз-стимулирующий лиганд (Apo2) [13, 16]. Противоопухолевая активность жирорастворимых витаминов также определяется их иммунотропными эффектами. Показано, что дефицит витамина E ослабляет иммунную защиту, включая T- и B-клеточные функции [10]. Предотвращение развития или своевременная коррекция нарушений иммунной реактивности организма с помощью жирорастворимых витаминов является одним из эффективных подходов профилактики опухолевых заболеваний.
Целью исследования явилось изучение концентрации цитокинов и жирорастворимых витаминов в сыворотке крови у женщин с опухолевыми заболеваниями тела матки.
Материал и методы исследования. В соответствии с поставленной целью исследования было обследовано 435 женщин, из которых первую группу составили 100 пациенток с диагнозом миома тела матки (МТМ), средний возраст 58,4±3,91 лет. У 63,0% пациенток этой группы при ультразвуковом исследовании были обнаружены единичные миоматозные узлы, у 37,0% - множественные. Общие размеры матки соответствовали 5-6 недельному сроку беременности у 60,0% больных, 7-9 недельному сроку - у 40,0%. Более 50% пациенток не предъявляли жалоб, характерных для больных миомой матки; 31,0% - отмечали болезненные менструации, а в 27% - отмечались обильные и длительные менструации.
Во вторую группу вошли 290 женщин с раком тела матки (РТМ). Согласно степени дифференцировки опухоли группа состояла из 34,5% пациенток с высокодифференцированной, 33,8% - с умереннодифференцированной и 31,7% - с низкодифференцированной аденокарциномой. Распределение по морфологическим стадиям заболевания показало, что у 67,6% пациенток имеется I стадия; у 20,6% - II, у 7,4% – III и у 4,4% – IV. Средний возраст пациенток составил 63,3±5,2 лет.
В контрольную группу были включены 45 женщин, находящихся в таком же возрасте, что и пациентки клинических групп, но не имеющих в анамнезе опухолевых заболеваний матки и других внутренних органов.
Все исследования выполнялись в соответствии с Хельсинской декларацией Всемирной ассоциации «Этические принципы научных и медицинских исследований с участием человека» и «Правилами клинической практики в Российской Федерации», утвержденными Приказом Минздрава РФ от 19.06.2003 г., № 266.
Концентрацию цитокинов (IL-1b, IL-2, IL-6, IFN-g) в сыворотке крови определяли иммуноферментным методом с помощью специализированных тест-систем «ProCon» (Россия) согласно протоколу исследования. В иммуноферментном анализе использовали автоматический ридер «Униплан» (ПИКОН, Россия).
Содержание жирорастворимых антиоксидантов (β-каротина, ретинола, α-токоферола) в сыворотке крови определяли с помощью метода ВЭЖХ [5] на хроматографе «Милихром» (Россия) с УФ детекцией в диапазоне 260-292 нм.
Результаты исследований статистически обрабатывали [3], вычисляя среднюю арифметическую величину (М), ошибку репрезентативности средней величины (m) и уровень значимости различий средних величин (р) на основании t-критерия Стьюдента с поправкой Бонферони для уровня достоверности 95% (p < 0,05).
Результаты. В результате проведенного обследования были получены данные, отражающие изменения концентрации тестируемых цитокинов в сыворотке крови пациенток с опухолевыми заболеваниями тела матки (табл. 1). Так, у пациенток с МТМ «средняя» величина IL-1b была в 2,1 раза выше (p < 0,05) «средней» нормативных значений. У пациенток с РТМ содержание IL-1b также было в 2,5 выше (p < 0,05) контрольных показателей.
Таблица 1. Содержание цитокинов в сыворотке крови у пациенток с опухолевыми заболеваниями тела матки (M±m)

Примечание: здесь и далее * - p < 0,05 по сравнению с контролем.
При тестировании концентраций IL-2 в крови у пациенток с МТМ уровень изучаемого цитокина оказался 1,4 выше данных контрольной группы и в 3,7 раза результатов у пациенток с РТМ (p<0,05). Причем у последних содержание IL-2 в крови также было ниже в 2,6 раза, относительно нормативных значений (p<0,05).
При определении концентраций провоспалительного цитокина IL-6 в крови в группе пациенток с МТМ «средняя» величина тестируемого интерлейкина значимо не отличалась от нормативных значений. В тоже время у пациенток с РТМ уровень IL-6 в крови превышал показатели контроля в 6,8 раза и данные пациенток с МТМ в 5,1 раза (p<0,05). Считается, что повышение уровней IL-6 является негативным фактором в патогенезе опухолевой патологии [15], связывая его с прогрессирующим течением и формированием синдромов злокачественных процессов, выражающихся в кахексии, анемии [12]. Объяснение данного феномена может быть следующим: под действием высоких концентраций IL-6 происходит активация В-лимфоцитов, усиливается синтез противоопухолевых антител, которые блокируют антигены опухолевых клеток и рецепторы Т-киллеров, тем самым, защищая опухолевую клетку от разрушения [1, 2].
Анализ содержания INF-g в крови у пациенток с РТМ показал достоверное снижение исследуемого цитокина в 1,8 раза (p<0,05), по сравнению с результатами контрольной группы.
Известно, что важную роль в регулировании активности иммунной системы, в частности синтеза цитокинов в организме могут играть жирорастворимые витамины. Так, показано, что в процессе дифференцировки T-клеток в тимусе витамин Е, ингибируя экспрессию CD95-лиганда, защищает их от апоптоза. Кроме того, α-токоферол оказывает влияние на активность В-лимфоцитов, макрофагов, а также уровень ИЛ-1β и других цитокинов [8]. Поэтому следующий фрагмент исследований был посвящен изучению содержания жирорастворимых витаминов в крови у женщин с опухолевыми заболеваниями тела матки.
При оценке содержания жирорастворимых витаминов было обнаружено (табл. 2), что в группе пациенток с диагнозом МТМ «средняя» величина концентрации β-каротина была ниже на 27,3%, по сравнению с контролем. В группе пациенток с РТМ содержание β-каротина также было достоверно (p<0,05) ниже на 35,1% «средней» контрольных показателей и не отличалась от значений, полученных в группе пациенток с миомой.
Таблица 2. Содержание жирорастворимых антиоксидантов в сыворотке крови у пациенток с опухолевыми заболеваниями тела матки (M±m)
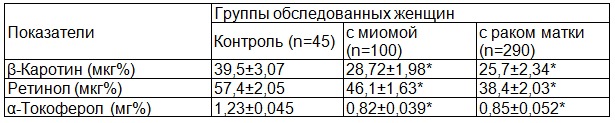
Анализ концентраций ретинола в крови у пациенток с миомой показал, что «средняя» концентраций антиоксиданта была ниже на 19,7% контрольных значений. В группе пациенток с РТМ содержание ретинола также была ниже на 33,2% показателей контроля и в 1,2 раза концентраций определяемого витамина в группе пациенток с миомой (p<0,05). При определении уровня витамина Е в сыворотке крови у пациенток с миомой «средняя» концентраций α-токоферола оказалась ниже на 33,3% контрольных значений. В группе пациенток с РТМ содержание α-токоферола в крови также было ниже на 30,9% показателей контроля.
Заключение. Обобщая полученные результаты, следует отметить, что характерной чертой патогенеза опухолевых заболеваний тела матки является наличие дисбаланса цитокинов, когда у пациенток с раком тестируется повышение концентраций провоспалительных цитокинов IL-1b, IL-6 на фоне снижения содержания IL-2 и INF-g в крови. Это свидетельствует о том, что при раке тела матки в отличие от миомы, определяется выраженное угнетение синтеза цитокинов, обладающих способностью индуцировать цитотоксическую активность и ингибировать рост опухолевых клеток. Кроме этого патогенетической особенностью злокачественного опухолевого роста в теле матке, по сравнению с доброкачественным, является более низкое содержание жирорастворимых витаминов (β-каротина, ретинола, α-токоферола) в организме.
