Актуальность темы
Синдром поликистозных яичников (СПКЯ) – распространенная эндокринопатия, которой страдает до 10% женщин репродуктивного возраста [1-3]. СПКЯ является сложной патологией, включающей как гормональные, так и метаболические нарушения [1]. Диагноз СПКЯ основывается исключительно на репродуктивных проявлениях (олиго - или ановуляция, клинические и/или биохимические признаки гиперандрогении, поликистозные яичники при ультразвуковом исследовании). Однако данный синдром ассоциирован с рядом метаболических изменений, которые способствуют увеличению риска сердечно-сосудистых событий [1, 4, 5]. Хотя в научной литературе недостаточно данных относительно частоты этих событий и смертности у женщин с СПКЯ, хорошо доказана повышенная распространенность сердечно-сосудистых факторов риска в этой популяции [1].
У молодых женщин с СПКЯ описаны несколько факторов риска сердечно-сосудистых заболеваний: метаболический синдром, сахарный диабет типа 2 (СД типа 2), нарушение толерантности к глюкозе (НТГ), дислипидемия, абдоминальное ожирение, артериальная гипертензия, синдром обструктивного сонного апноэ, протромботические изменения [3, 4]. Основное патофизиологическое значение в развитии этих кардиометаболических нарушений принадлежит инсулинорезистентности и компенсаторной гиперинсулинемии [4]. Инсулинорезистентность в сочетании с секреторной дисфункцией панкреатических бета-клеток приводит к возникновению нарушенной толерантности к глюкозе и СД типа 2 [1]. Патогенез дислипидемии при СПКЯ остается спорным. Различные варианты дислипидемий могут быть обусловлены совместными эффектами инсулинорезистентности и гиперандрогении в комбинации со средовыми (диета, физическая активность) и генетическими факторами [3].
В этой связи нам представляется актуальным выполнение мониторинга факторов СС-риска у всех женщин с СПКЯ и их коррекция путем модификации образа жизни, назначения сенситайзеров инсулина и других препаратов при необходимости [3].
Цель исследования: выявить факторы риска сердечно-сосудистых осложнений у женщин репродуктивного возраста с диагнозом СПКЯ, а именно наличие абдоминального ожирения, дислипидемии и ее особенностей, оценить степень и время повышения глюкозы и инсулина в ходе ОГТТ, а также определить степень нарушения толерантности к глюкозе и наиболее неблагоприятный метаболический фенотип синдрома.
Материалы и методы. Выполнено одномоментное исследование, в которое включили 85 женщин в возрасте от 18 до 45 лет из популяции Северо-Западного региона с диагнозом СПКЯ, установленным в соответствии с критериями Роттердамского консенсуса 2003 года. Все пациентки дали письменное информированное согласие на участие в исследовании. Критериями исключения были: прием комбинированных оральных контрацептивов, беременность, наличие острых или обострение хронических заболеваний, тяжелые соматические заболевания, отказ от участия в исследовании. Всем женщинам было выполнено антропометрическое обследование с оценкой роста, веса, окружности талии (ОТ) и окружности бедер (ОБ). Рост измерен ростомером «Person Chek» фирмы KaWe, Германия. Вес измеряли на электронных весах «Seca-780». ОТ определяли на середине расстояния между нижним краем реберной дуги и вершиной гребня подвздошной кости в конце выдоха. Диагноз абдоминального ожирения определяли при значении ОТ более 80 см. Индекс массы тела (ИМТ) вычисляли как вес в килограммах, разделенный на рост в метрах квадратных. Составляющую жировой ткани в организме в процентах у обследованных женщин измеряли анализатором «Omron PF-306». Содержание жировой ткани более 30% рассматривали как превышающее норму. Всем пациенткам был выполнен трехчасовой ОГТТ с нагрузкой 75 граммов глюкозы. Лабораторный анализ включал измерение в сыворотке крови следующих показателей: общего холестерина (ХС), холестерина липопротеидов высокой плотности (ХСЛПВП), триглицеридов (ТГ), глюкозы, иммунореактивного инсулина (ИРИ) натощак, глюкозы на 30-й, 60-й, 120-й, 180-й минутах (мин.), а также ИРИ на 30-й и 120-й мин. после приема глюкозы. Показатели инсулина более 25 мкМЕ/мл оценивались как гиперинсулинемия. Показатели ХС, ХСЛПВП, ТГ определяли энзиматическим колориметрическим методом, глюкозы – ферментативным глюкооксидазным колориметрическим методом. ИРИ был определен методом иммуноферментного анализа. Уровень холестерина липопротеидов низкой плотности рассчитали по формуле Фривальда [6]: ХСЛПНП =[ХС (ммоль/л) – ХСЛПВП (ммоль/л) – ТГ (ммоль/л) ×0,45]. Вычисляли площади под кривыми глюкозы и инсулина. Чувствительность тканей к инсулину оценили при помощи математических моделей: «HOMA» = уровень ИРИ натощак (мкЕд/мл) × уровень глюкозы натощак (ммоль/л) / 22,5; «CARO» = уровень глюкозы натощак (ммоль/л) / уровень ИРИ натощак (мкЕд/мл); «ISISTUM» = чувствительность периферических тканей к инсулину = 0,226 – 0,0032 × ИМТ – 0,0000645 × ИРИ на 120-й мин. – 0,0037 × глюкоза на 60-й мин [7]. Выполнили оценку функции бета-клеток при помощи математических моделей, полученных на основании метода клэмпа (Stumvoll M. et al., 2000) [7]: «1-st Phase» = индекс первой фазы секреции инсулина = 1283 + 1,829 × ИРИ на 30-й мин.– 138,7 × глюкоза на 30-й мин. + 3,772 × ИРИ базальный и «2-nd Phase» = индекс второй фазы секреции инсулина = 2,87 + 0,4164 × ИРИ на 30-й мин. – 26,07 × глюкоза на 30-й мин. + 0,9226 × ИРИ базальный.
Количественные данные работы представлены как среднее арифметическое (M) ± стандартное отклонение (SD) при нормальном распределении и как медиана (Me) и квартили (Q25 – 75) при распределении, отличающемся от нормального. Качественные данные представлены как частоты и проценты. Для анализа данных использовался непарный t-критерий Стьюдента, критерий Манна-Уитни, критерий χ2. За критический уровень значимости принято значение p<0,05. Проводился корреляционный анализ с определением коэффициента корреляции Спирмена (rs), множественный регрессионный анализ. Математическая обработка результатов исследования выполнена при помощи программы SPSS for Windows (версия 18).
Результаты исследования и их обсуждение. Средний возраст обследованных составил 28,26±5,3 года. Антропометрические показатели: вес 60,05 [52,78 – 72,33] кг, рост 164,77±6,81 см, ИМТ 22,0 [20,13 – 26,63] кг/м2, содержание жировой ткани 34,35±6,63%, ОТ 71,25 [64,13 – 81,0] см, ОБ 96,23±8,65 см. Нормальная масса тела была у 63,5% (54) пациенток. Дефицит массы тела имел место в 7,1% (6) случаев. Избыточный вес выявлен у 17,6% (15), ожирение – у 11,8% (10). Повышенное содержание жировой ткани было у 70,6% (60), а абдоминальное ожирение определено у 27,1% женщин (23).
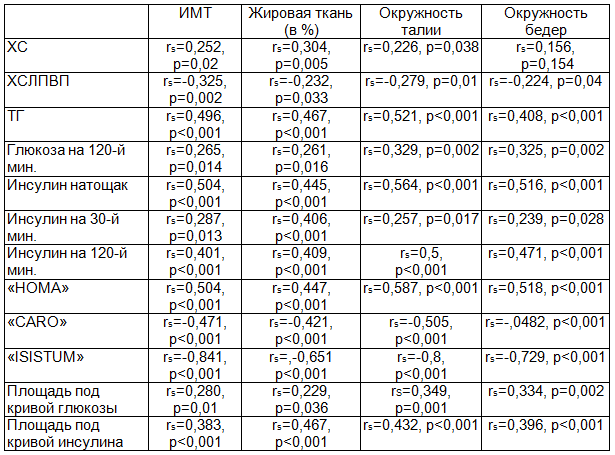
Корреляционный анализ позволил установить прямую связь между следующими антропометрическими и метаболическими показателями: ИМТ и уровнем ТГ; содержанием жировой ткани и уровнями ХС и ТГ. ОТ и ОБ коррелировали с уровнями ТГ, глюкозы на 120-й мин., площадью под кривой глюкозы. Уровень ХСЛПВП отрицательно коррелировал с ИМТ. Площадь под кривой инсулина положительно коррелировала с ИМТ, содержанием жировой ткани, ОТ и ОБ. Выявлены корреляционные связи между антропометрическими показателями и индексами чувствительности к инсулину: ИМТ, содержание жировой ткани, ОТ и ОБ имели положительную ассоциацию с инсулинорезистентностью натощак на основании индекса «HOMA», отрицательную – с индексом «CARO». Содержание жировой ткани, ОТ и ОБ имели сильную отрицательную зависимость от периферической чувствительности к инсулину по оценке на основании математической модели «ISISTUM». Коэффициенты корреляции и их статистическая значимость представлены в табл. 1.
По результатам множественной линейной регрессии уровень глюкозы натощак был значимым предиктором веса: F=43,578, p<0,001, константа p<0,001, глюкоза натощак β=4,704, p=0,001.
Таблица 1. Коэффициент корреляции Спирмена между антропометрическими и метаболическими показателями
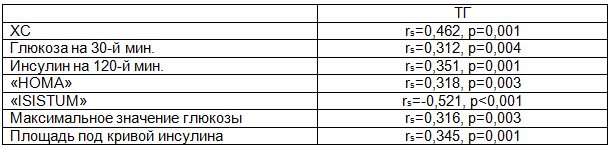
Анализ уровней липидов в сыворотке крови не выявил существенных отклонений: ХС 4,88±0,87 ммоль/л, ХСЛПВП 1,47 [1,21 – 1,77] ммоль/л, ТГ 0,85 [0,67 – 1,21] ммоль/л, ХСЛПНП 2,92±0,82 ммоль/л, но в этой группе молодых женщин все же имели место следующие варианты дислипидемий: гиперхолестеринемия в 42,4% случаев (36); снижение ХСЛПВП – 30,6% (26); гипертриглицеридемия – 10,6% (9); повышение ЛПНП у 45,9% (39). Дислипидемия, типичная для метаболического синдрома, была выявлена у 36,5% (31) женщин, и ее особенностями были снижение ХСЛПВП и гипертриглицеридемия – у 4,7% (4), а также снижение ЛПВП – у 25,9% (22), гипертриглицеридемия – у 5,9% (5). Аналогичные проявления дислипидемии при СПКЯ были описаны многими исследователями [8, 9]. Мы выявили характерные ассоциации дислипидемии в данной популяции; так у женщин с избытком жировой ткани отмечалось повышение ХСЛПНП: 33 случая против 6 случаев при нормальном содержании жировой ткани (χ2=6,830, p=0,009). Этот вариант дислипидемии также чаще регистрировался у женщин с гиперинсулинемией на 120-й мин. ОГТТ: 30 случаев против 9 случаев отсутствия гиперинсулинемии в этой точке (χ2=4,710, p=0,030). Полученные данные нашли подтверждение и в ряде других исследований, демонстрирующих сильную корреляционную зависимость между ХСЛПНП, содержанием жировой ткани и концентрациями глюкозы и инсулина в плазме [10]. Уровень ТГ имел прямую корреляционную связь со следующими метаболическими показателями и индексами: уровнем ХС, максимальным значением глюкозы в ходе ОГТТ и ее показателем на 30-й мин., площадью под кривой инсулинемии, индексом «HOMA». Обратная зависимость имелась между уровнем ТГ и индексом чувствительности тканей к инсулину «ISISTUM». Коэффициенты корреляции и их статистическая значимость представлены в табл. 2.
Значимым предиктором повышения уровня ТГ был индекс «ISISTUM»: F=5,775, p=0,018, константа p<0,001, «ISISTUM» β=-10,488, p=0,018, а предиктором снижения ХСЛПВП – возраст: F=4,522, p=0,036, константа p<0,001, возраст β=-0,020, p=0,036.
Таблица 2. Коэффициент корреляции Спирмена между ТГ, гликемией, инсулинемией, индексами чувствительности к инсулину
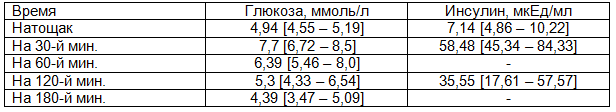
Уровни гликемии и инсулинемии натощак и в ходе ОГТТ представлены в таблице 3. НТГ выявлено у 3,5% (3) пациенток, СД типа 2 – у 2,4% (2). По данным ряда авторов НТГ встречается у 30-40% женщин с СПКЯ, а СД типа 2 у 5-10% [11, 12], что превышает результаты, полученные у наших пациенток, и, вероятно, связано с меньшим возрастом и ИМТ обследованных в нашей группе. Гиперинсулинемия натощак была только у 3,5% (3), гиперинсулинемия на 30-й мин. ОГТТ имелась у большинства женщин – 96,5% (82), гиперинсулинемия на 120-й мин. ОГТТ зарегистрирована у 62,4% (53).
Таблица 3. Показатели гликемии и инсулинемии в ходе ОГТТ
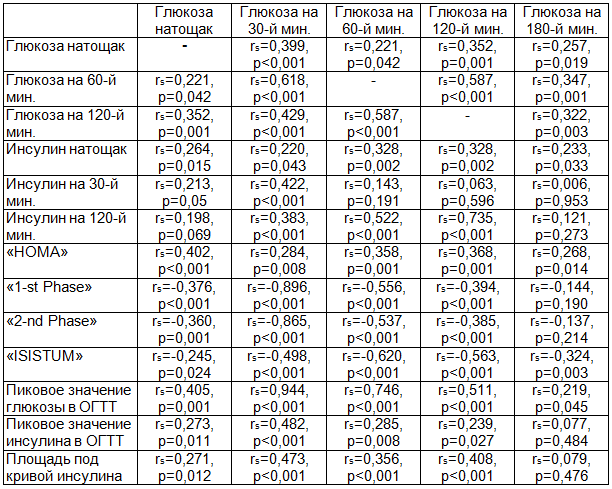
Таким образом, чем выше была гликемия на 30-й и 60-й минутах ОГТТ, тем имелось более высокое повышение глюкозы на 120-й мин. Также уровень гликемии на 120-й мин. ОГТТ имел прямую зависимость от возраста женщины (rs=0,305, p=0,004) и пикового уровня глюкозы в тесте. Чем выше глюкоза на 30-й мин., тем более высокие значения глюкозы и инсулина можно ожидать в других точках ОГТТ. Повышение инсулина на 120-й мин. ОГТТ было обусловлено более высокими показателями глюкозы на 30-й, 60-й, 120-й мин. теста. В табл. 4 представлены коэффициенты корреляции между показателями гликемии, инсулинемии натощак и в ходе ОГТТ и их статистическая значимость.
Таблица 4. Коэффициенты корреляции Спирмена между показателями глюкозы и инсулина в ходе ОГТТ, индексами, отражающими чувствительность к инсулину и функцию бета-клеток
Повышение инсулинорезистентности натощак (оценка по индексу «HOMA») обусловливало повышение глюкозы в ходе ОГТТ, а также инсулина на 30-й и 120-й мин. Снижение чувствительности периферических тканей к инсулину было связано с повышением инсулина натощак и глюкозы на 30-й и 120-й мин. ОГТТ, большей площадью под кривой гликемии и более высоким пиковым уровнем глюкозы в ходе ОГТТ. Коэффициенты корреляции и их статистическая значимость представлены в табл. 5, 6.
Таблица 5. Коэффициент корреляции Спирмена между показателями инсулина в точках измерения в процессе ОГТТ и индексами, отражающими чувствительность к инсулину и функцию бета-клеток
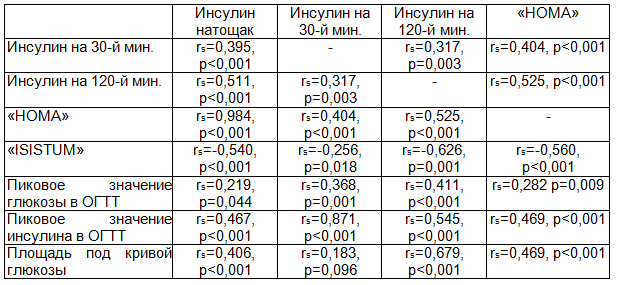
Таблица 6. Коэффициент корреляции Спирмена между индексами функции бета-клеток и индексом «ISISTUM», пиковым значением глюкозы в ходе ОГТТ, площадью под кривой глюкозы

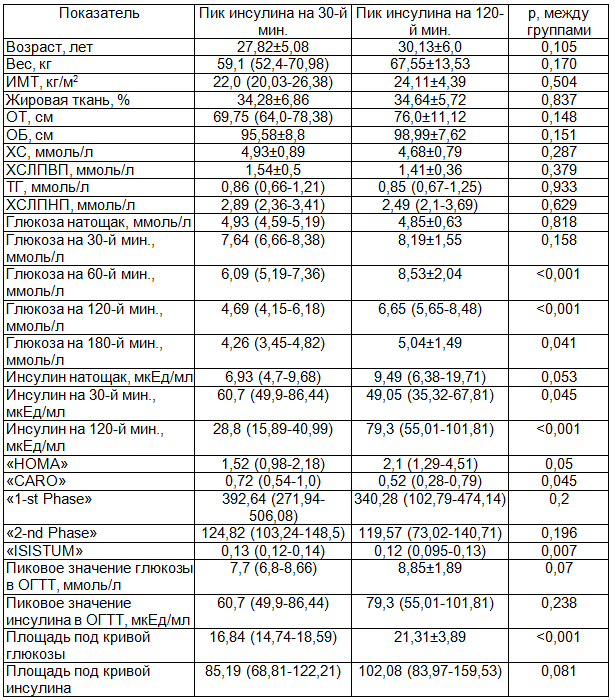
Все обследованные пациентки с СПКЯ были разделены на 2 группы по времени достижения пикового уровня инсулина в ходе ОГТТ с целью оценки наиболее значимой когорты сочетания факторов СС-риска в этих группах. В 1-ую группу вошли 69 женщин с достижением пикового уровня инсулина на 30-й мин. ОГТТ. Во 2-ой группе были 16 женщин с достижением пикового уровня инсулина на 120-й мин. ОГТТ. В результате были выявлены статистически значимые различия между группами по показателям гликемии на 60-й, 120-й, 180-й мин. ОГТТ, инсулина на 30-й и 120-й мин., показателями индексов чувствительности к инсулину «ISISTUM» и инсулинорезистентности «CARO», а также площади под кривыми глюкозы. Других значимых отличий между группами не было (табл. 7). Таким образом, пациентки с фенотипом максимального повышения инсулина на 120-й минуте имели более серьезные нарушения углеводного метаболизма в виде меньшей чувствительности периферических тканей к инсулину и большей резистентности к инсулину натощак, более высокой гликемии в ходе ОГТТ и имели отсутствие раннего пика инсулина, свидетельствующее о нарушении первой фазы его секреции и высоком риске СД типа 2.
Таблица 7. Клинические показатели в группах, различающихся достижением пикового уровня инсулина на 30-й или 120-й минутах ОГТТ
Выводы
- У женщин репродуктивного возраста с СПКЯ выявлены следующие клинические проявления метаболического синдрома: абдоминальное ожирение (27,1%), дислипидемия с повышением ТГ и снижением ХСЛПВП (36,5%), гиперинсулинемия (96,5%) и значительно реже – НТГ (3,5%) и СД 2-го типа (2,4%).
- У женщин с СПКЯ избыточная масса тела прямо зависела от степени гиперинсулинемии натощак и в 2-х часовой точке ОГТТ. Масса тела, увеличение процента жировой ткани и ОТ нарастали с повышением резистентности к инсулину натощак и снижением чувствительности периферических тканей к инсулину. ОТ увеличивалась в зависимости от степени повышения глюкозы после нагрузки, а также зависела от степени повышения показателей инсулина натощак и в 2-х часовой точке теста и уровня ТГ.
- У женщин с СПКЯ и нормальной массой тела ОТ и содержание жировой ткани положительно коррелировали со степенью резистентности к инсулину натощак и отрицательно – с чувствительностью периферических тканей к инсулину.
- У молодых женщин с СПКЯ выявлены три варианта атерогенных дислипидемий: повышение ХСЛПНП (45,9%), вызванное избытком жировой ткани и гиперинсулинемией в 2-х часовой точке теста; снижение ХСЛПВП (30,6%), ассоциированное с возрастом женщины, и гипертриглицеридемия (10,6%), обусловленная снижением чувствительности тканей к инсулину.
- В ходе ОГТТ у женщин с СПКЯ выявлено 2 метаболических фенотипа секреции инсулина с максимальным уровнем этого показателя в период ранней фазы и на 120-й мин. ОГТТ, причем последний отличался большей степенью повышения глюкозы после нагрузки и резистентности к инсулину натощак, но меньшей чувствительностью периферических тканей к инсулину.
