Эндометриоз является хроническим, прогрессирующим и рецидивирующим заболеванием, поражающим 12-60% женщин репродуктивного возраста, которое характеризуется эктопическим разрастанием эндометрия [1-3]. Эндометриоз является одной из самых распространенных причин болевого синдрома, проявляется дисменореей, диспареунией и приводит к бесплодию. Частота бесплодия при всех локализациях генитального эндометриоза примерно в 3-4 раза превышает частоту бесплодия в популяции [3,4]. При эндометриозе нарушение функции клеток эндометрия связано с экспрессией дефектных (мутантных) генов. Наблюдаемые семейные случаи заболевания указывают на возможность участия в патогенезе заболевания генетических дефектов [11], формируется неблагоприятный «генетический фон», который под влиянием дополнительных факторов реализуется в патологический фенотип [8].
Современные исследователи склонны расценивать автономный рост очагов эндометриоза как результат отсутствия адекватного контроля за пролиферацией и дифференцировкой клеток гетеротопий со стороны организма женщины. Клеточная пролиферация контролируется сетью генов, немаловажную роль среди которых играет ген р21. Белковый продукт гена p21 – один из мощных ингибиторов циклинзависимых киназ, блокирующий киназную активность, необходимую для перехода клетки из пресинтетической фазы G1 в синтетическую S-фазу, и специфически активируемый белком p53. При отсутствии гена p53 или в случае, когда происходит его мутация, нарушается активация гена р21, и его протеиновый продукт Waf1 не синтезируется. При повреждении дезоксирибонуклеиновой кислоты (ДНК) активированный белок р53 взаимодействует с промоторной областью гена р21, увеличивая тем самым синтез продукта Waf1. Белковый продукт гена р21 связывается с циклинзависимыми киназами, блокируя их и препятствуя тем самым синтезу рибонуклеиновой кислоты (РНК) [6].
Наличие полиморфных вариантов генов-регуляторов клеточного цикла, в частности гена р21, делает возможным изменение уровня контроля над остановкой клеточного цикла и не обеспечивает полноценной реализации исправления генетического аппарата клетки. В связи с этим целью настоящего исследования явился анализ распределения аллелей и генотипов полиморфных вариантов гена р21 у женщин с генитальным эндометриозом.
Материал и методы исследования. В программу исследования вошло 300 женщин репродуктивного возраста, находившихся на стационарном лечении в гинекологической клинике ГБОУ ВПО СибГМУ Минздрава России. Основную группу составили 200 женщин с наружным генитальным эндометриозом. В группу контроля включено 100 женщин, которым проводилась диагностическая лапароскопия по поводу синдрома хронической тазовой боли, бесплодия и у которых не было выявлено органической патологии, а также женщины, реализовавшие свои репродуктивные планы, которым проводилась добровольная хирургическая стерилизация. Всем женщинам была проведена лапароскопия по стандартной методике с использованием аппаратуры фирмы «KarlStorz» (Германия) и последующим гистологическим исследованием операционного материала. У всех женщин было получено добровольное информированное согласие на забор венозной крови и использование её для проведения исследований. Кровь для исследования получали из кубитальной вены в стандартных условиях у всех пациенток утром в день операции. Выделение ДНК из периферической крови проводили согласно инструкции, прилагаемой к набору «ДНК-сорб-В» («ИнтерЛабСервис», Россия). Изучение распределения генных полиморфизмов образцов ДНК гена p21 (1026 A/G, rs2395655; 369 G/C, rs4135239) осуществляли с помощью метода ПЦР в режиме реального времени, используя олигонуклеотидные праймеры к специфическому участку гена (р21 G1026A: forward 5’-CAT-TTC-TTT-GCT-GCA-TGA-TCT-GAG-TT-3’ и reverse 5’-CCC-TAC-ACT-CAC-CTG-AAC-AGA-AGG-3’;р21 А369С: forward 5’- GAT-TTG-TGG-CTC-ACT-TCG-TGG-GG-3’ и reverse 5’-GCT-CCT-GGC-TGC-CCA-GCG-T-3’ и зонды к участку внутри амплифицируемого фрагмента ДНК (5’-FAM-CAA-CCA-CAG-GGG-TTT-3’ и 5’-ROX-CAG-GGA-TTT-CTT-CTG-T-3’;5’-FAM-CAT-GTG-CAG-GGA-AG-3’ и 5’-ROX-GTG-CGG-ACA-TGT-GCA-CGG-A-3’ соответственно) [10].
Амплификацию осуществляли согласно инструкции, прилагаемой к набору «АмплиСенс-200-1» («ИнтерЛабСервис», Россия). Программа амплификации включала 5 минут предварительной денатурации при 94С° и 30 циклов: 94 С° – 30 с, 64 С° – 30 с, 72 С° – 40 с. Кривые накопления флуоресцентного сигнала анализировались с помощью программного обеспечения прибора ДТ-96 («ДНК-Технология», Россия). Распределение генотипов по исследованным полиморфным локусам проверяли на соответствие равновесию Харди-Вайнберга с помощью точного теста Фишера. Для анализа ассоциации маркеров исследуемых генов с эндометриозом сравнивали частоты аллелей и генотипов в группах больных и здоровых индивидов, используя критерий χ2 с поправкой Йетса на непрерывность. При численностях генотипов менее пяти использовали точный тест Фишера.
Результаты исследования и их обсуждение. На первом этапе исследования нами был проведен анализ распределения полиморфного вариантаG1026Aгена р21 у женщин с эндометриозом, который выявил, что частота встречаемости АА-генотипа (16,00%) превышала таковую у здоровых лиц (6,00%) более чем в два раза (р=0,03). Частота встречаемости «патологического» аллеля А гена р21 G1026A у женщин с эндометриозом также более чем в полтора раза превышала аналогичный показатель у женщин без данной патологии (32,00 и 21,00% соответственно) (р=0,005) (табл.1). Риск развития эндометриоза при носительстве минорного аллеля А гена р21(G1026A) возрастает в 1,7 раза, а при наличии АА-генотипа – почти в 3 раза. На втором этапе было проведено генотипирование обследованных женщин на предмет определения частоты встречаемости полиморфного варианта G369C гена р21. При этом было показано, что частота встречаемости минорного аллеля А гена р21(G369C) у женщин с эндометриозом статистически значимо (р=0,02) превышала таковую у здоровых лиц (23,00 и 15,00 % соответственно). Частота встречаемости «редкого» генотипа CC у женщин с эндометриозом оказалась в 5,5 раз выше, чем у женщин без эндометриоза (11,00 и 2,00% соответственно) (табл. 2). Было показано, что риск развития эндометриоза при носительстве C-аллеля возрастает в 1,7 раза, CC-генотипа – почти в 3 раза.
Таким образом, проведенное нами исследование свидетельствует о том, что генитальный эндометриоз характеризуется увеличением частоты «редких» аллелей и генотипов: А и АА полиморфизма G1026A гена р21,С и СС полиморфизма G369C гена р21 соответственно. Кроме того с перечисленными выше полиморфными вариантами гена р21 связан и повышенный риск развития генитального эндометриоза. В настоящее время в литературе в основном представлены данные о влиянии полиморфных вариантов гена р21 на развитие и течение онкологических заболеваний [5, 8, 9]. Кроме того в исследовании австрийских ученых, посвященному поиску функциональных генетических полиморфизмов при заболеваниях женской репродуктивной системы, не было выявлено статистической ассоциации между полиморфным вариантом гена р21 и генитальным эндометриозом [7].
Таблица 1. Распределение вариантных генотипов гена р21 G1026A (в абс. знач. и в %) у женщин с эндометриозом.
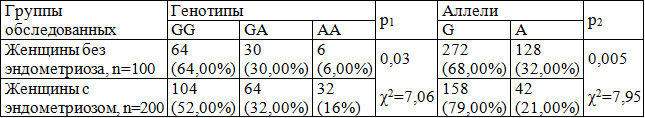
Примечание: здесь и далее р1 – уровень статистической значимости различий частоты генотипов между группами женщин с эндометриозоми и без эндометриоза, р2 – уровень статистической значимости различий частоты аллелей между группами женщин с эндометриозом и без эндометриоза, χ2 – стандартный критерий Пирсона для сравнения частоты генотипов и аллелей генов.
Таблица 2. Распределение генотипов и аллелей гена р21 G369C (в абс. знач. и в %) у женщин с эндометриозом.
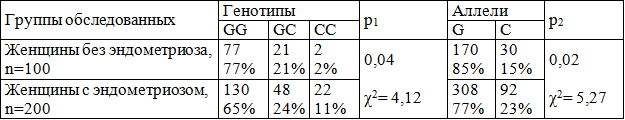
Увеличение частоты встречаемости минорных генотипов и аллелей гена р21, обнаруженное в настоящем исследовании, у женщин с эндометриозом может свидетельствовать о значимости привносимых изменений «патологических» генотипов в конформационную или функциональную характеристику кодируемого белкового продукта, обеспечивающего индивидуальные особенности во взаимодействии компонентов – участников регуляции клеточного цикла. Минорные варианты гена р21 оказывают значимое влияние на развитие эндометриоза, уменьшая контроль над прохождением клеточного цикла и не осуществляя элиминации измененных клеток путем апоптотической гибели, которая в норме осуществляется через р53-опосредованное увеличение экспрессии р21 и активацию каспаз [9, 11].
Таким образом, дальнейшее изучение и выявление ассоциации полиморфных вариантов генов регуляторов клеточного цикла с риском возникновения и рецидивирования генитального эндометриоза является актуальной и перспективной задачей. Идентификация генов и их аллелей, от экспрессии которых зависит предрасположенность или резистентность к эндометриозу позволила бы глубже проникнуть в фундаментальные механизмы данной патологии. В результате появилась бы возможность использовать методы генетического типирования для прогнозирования характера течения эндометриоза, а также выявления среди здоровых женщин групп с генетически повышенным риском заболевания, требующих первоочередных мер профилактики и динамического наблюдения.
