Ряд исследователей [11,21] у больных с синдромом поликистозых яичников (СПКЯ) выявили нарушения липидного обмена в связи с наличием у них гиперандрогении, на фоне которой развивается висцеральное ожирение [1,20]. Поскольку при СПКЯ гиперандрогения в 50-60% случаев сочетается с ожирением [5] и в 70-75% случаев с гиперинсулинемией (ГИ) [14], можно предположить наличие нарушений липидного обмена у данного контингента больных.
Висцеральное ожирение вызывает ГИ, инсулинорезистентность (ИР) и нарушение толерантности к глюкозе [16], способствующие развитию нарушений метаболизма липопротеидов (ЛП) [3,8]. На фоне развившейся ИР инсулин (И) действует как атерогенный гормон, способствующий увеличению синтеза триглицеридов (ТГ) и холестерина липопротеидов очень низкой плотности (ЛПОНП) печенью и ингибированию элиминации этих ЛП из кровеносного русла, что сопровождается увеличением уровня ТГ и ускорением превращения в кровотоке ЛПОНП в наиболее атерогенные частицы – липопротеиды низкой плотности (ЛПНП) и замедлением образования липопротеидов высокой плотности (ЛПВП) [2,3]. Сочетание подобных факторов способствует развитию атеросклероза, коронарной болезни сердца (КБС), сахарного диабета II типа [22].
Целью исследования явилось изучение липидного обмена и его взаимосвязь с углеводным обменом у больных с СПКЯ.
Материал и методы исследования. Под нашим наблюдением находилось 120 больных СПКЯ в возрасте от 20 до 35 лет (средний возраст 31,9±1,4 года) с длительностью бесплодия от 1 года до 8 лет (в среднем 3,7±0,9 лет). У 61 (50,8%) больной была олигоменорея (задержка менструаций от 45 до 120 дней), у 30 (25%) – аменорея, у 12 (10%) – дисфункциональные маточные кровотечения (ДМК), у 17 (14,2%) – регулярные менструации через 28-30 дней.
У больных индекс массы тела (ИМТ) превышал (26,1±0,3) показатели здоровых женщин (23,4±0,8). У 81 (67,5%) больной ИМТ составлял 24,9±0,2, у 39 (32,5%) – 32,2±1,2. В соответствии с этим больные были разделены на 2 группы, по которым проводилась оценка липидных показателей.
Ожирение I степени (25<ИМТ<30 кг/м2) диагностировано у 14 (35,9%), ожирение II степени (30<ИМТ<35 кг/м2) – у 16 (41%), ожирение III степени (35<ИМТ<40 кг/м2) – у 9 (23%) из 39 больных с ожирением.
39 (32,5%) больных с ИМТ>25 кг/м2 имели абдоминальный или висцеральный тип ожирения, величина индекса, отражающего отношение окружности талии к окружности бедер (ОТ/ОБ), составила 0,82±0,01. Контрольную группу составили 20 здоровых женщин (средний возраст 32,4±1,5 лет, ИМТ – 22,1-0,8 кг/м2, ОТ/ОБ – 0,74±0,02.
Состояние липидного спектра крови оценивали по основным показателям, характеризующим обмен и транспорт липидов: общий холестерин (ХС), ТГ, ХС ЛПВП, ХС ЛПНП, ХС ЛПОНП, коэффициент атерогенности (КА), уровень аполипопротеинов А1 и В (апоА1, апоВ), коэффициент апоВ/апоА1, уровень ЛП(а). Кровь для исследования брали из локтевой вены натощак спустя 12 ч после приема пищи.
Содержание общего ХС, ТГ, ХС ЛПВП в сыворотке крови определяли на автоанализаторе Airone 200 ферментным методом с помощью комбинированных диагностических наборов фирмы «Biocon» (Германия). Концентрацию ХС ЛПНП, ХС ЛПОНП оценивали по расчетным формулам Фривальда, КА — по формуле А.Н. Климова:
ХС ЛПОНО (ммоль/л)=ТГ (ммоль/л)/2,2,
ХС ЛПНП (ммоль/л)=общий ХС — ХС ЛПОНП — ХС ЛПВП,
КА=ХС ЛПНП+ХС ЛПОНП/ХС ЛПВП.
Количественная оценка апоА1 и апоВ проводилась иммунонефелометрическим методом на нефелометре Behring с использованием антисыворотки и контрольных стандартных материалов фирмы Behring. Концентрацию в сыворотке крови ЛП(а) определяли методом количественного ракетного иммуноэлектрофореза.
При анализе данных использовали нормативные показатели, принятые для оценки гиперлипидемий в рекомендациях 1998 г. европейских обществ кардиологов по изучению гипертонии и атеросклероза [23]. Величина суммарного риска развития КБС высчитывали всем больным индивидуально с учетом возраста, курения, систолического артериального давления, показателей липидного спектра крови, а также наследственных заболеваний по таблицам, данным в рекомендациях европейских обществ кардиологов [23].
Результаты. Средний показатель уровня липидов в сыворотке крови обследованных больных (табл. 1) свидетельствует, что средний уровень ХС у больных СПКЯ (5,19±0,13 ммоль/л) на 11% превышал нормативные данные (1,67±0,13ммоль/л, р<0,05). Средний уровень ХС у больных СПКЯ, имеющих как ожирение (5,23±0,12 ммоль/л), так и нормальную массу тела (НМТ) (4,92±0,11) был на 12 и 5,3% соответственно больше по сравнению со здоровыми женщинами (4,67±0,13 ммоль/л, р<0,05). Однако, у пациенток с СПКЯ и ожирением средний уровень ХС повышен на 6,3% по сравнению с больными с НМТ (р<0,05). По уровню общего ХС в крови принято различать умеренную (5,0<ХС<6,5 ммоль/л) и выраженную (ХС>6,5 ммоль/л) гиперхолестеринемию: выраженная гиперхолестеринемия диагностирована у 7 (17,9%) больных СПКЯ с ожирением и лишь у 1 (1,2%) пациентки с СПКЯ с НМТ.
Таблица 1. Основные показатели липидного спектра сыворотки крови у больных СПКЯ и у здоровых женщин (M±m)
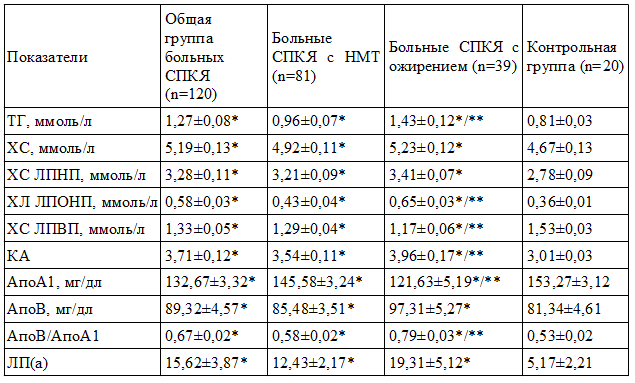
Примечания: * - достоверные различия с группой контроля (р<0,05); ** - достоверные различия с группой больных с НМТ (р<0,05)
Средний уровень ТГ у больных СПКЯ (1,27±0,08 ммоль/л) в 1,6 раза превышал контрольные значения (0,81±0,03 ммоль/л, р<0,05). У больных СПКЯ и ожирением выявлено в 1,8 раза повышение среднего содержания ТГ в сыворотке крови (1,43±0,12 ммоль/л) по сравнению со здоровыми женщинами (р<0,05) и в 1,5 раза — по сравнению с больными СПКЯ с НМТ (0,96±0,07 ммоль/л, р<0,05).
Аналогичная зависимость отмечалась при определении среднего уровня ХС ЛПНП и ХС ЛПОНП у обследованных больных. Это, вероятно, связано с тем, что ЛПНП являются основной транспортной формой ХС, а ЛПОНП — транспортной формой ТГ.
Концентрация ХС ЛПНП у больных была повышена в 1,2 раза (3,28±0,12 ммоль/л) по сравнению с контрольной группой (2,78±0,09 ммоль/л). У больных СПКЯ с ожирением концентрация ХС ЛПНП (3,41±0,07 ммоль/л) была повышена на 9,3% по сравнению с больными СПКЯ с НМТ (3,21±0,09 пмоль/л, р<0,05). У больных СПКЯ с НМТ концентрация ХС ЛПНП была на 12,2% больше по сравнению с контрольной группой (р<0,05).
ХС ЛПОНП представляет собой атерогенный фактор, при его гидролизе образуется еще более атерогенная фракция — ХС ЛПНП, которая является основным транспортером ХС в периферические клетки.Концентрация ХС ЛПОНП у больных СПКЯ была в 1,6 раза снижена (0,58±0,03 ммоль/л) по сравнению с контрольной группой (0,36±0,01 ммоль/л, р<0,05). У больных СПКЯ и ожирением концентрация ХС ЛПОНП была повышена (0,65±0,03 ммоль/л) в 1,5 раза по сравнению с больными СПКЯ с НМТ (0,43±0,04 ммоль/л, р<0,05) и в 1,8 раза по сравнению с контрольной группой (р<0,05). У больных СПКЯ с НМТ концентрация ХС ЛПОНП была повышена в 1,2 раза по сравнению с контрольной группой (р<0,05).
Концентрация ХС ЛПВП в сыворотке крови у больных СПКЯ снижена на 15% (1,33±0,05 ммоль/л) по сравнению со здоровыми женщинами (1,53±0,03 ммоль/л, р<0,05). Средние концентрации ХС ЛПВП в сыворотке крови у больных СПКЯ с ожирением (1,17±0,06 ммоль/л) и НМТ (1,29±0,04 ммоль/л) снижены в 1,3 и 1,2 раза соответственно по сравнению с контрольной группой (р<0,05).
Таким образом, наиболее выраженные нарушения липидного спектра крови, проявляющиеся высоким уровнем атерогенных фракций ЛП (ЛПНП и ЛПОНП) и низким содержанием антиатерогенных ЛПВП, выявлены у пациенток с СПКЯ и ожирением, что нашло яркое отражение в значениях КА. Так, у больных СПКЯ средний показатель КА (3,71±0,12) был больше в 1,2 раза по сравнению со здоровыми женщинами (3,01±0,13, р<0,05).
КА у больных СПКЯ с ожирением (3,96±0,17) был на 11,9% больше по сравнению с больными СПКЯ с НМТ (3,54±0,11, р<0,05) и на 31,6% больше по сравнению с контрольной группой (3,01±0,03, р<0,05). КА у больных СПКЯ с НМТ был на 17,6% больше по сравнению с контрольной группой (р<0,05). Содержание АпоА1 в сыворотке крови у больных было снижено на 15,5% (132,67±3,32 мг/дл) по сравнению с контрольной группой (153,27±3,12 мг/дл, р<0,05).
Содержание АпоА1 у больных СПКЯ с ожирением (121,63±5,19 мг/дл) было снижено по сравнению с больными СПКЯ с НМТ (145,58±3,24 мг/дл) и контрольной группой (153,27±3,12 мг/дл) на 19,7% и 26% соответственно (р<0,05). У больных СПКЯ с НМТ содержание АпоА1 в сыворотке крови было снижено на 5,3% по сравнению с контрольной группой (р<0,05). Следует отметить, что концентрация АпоА1 и ХС ЛПВП у больных СПКЯ с ожирением были однонаправленно достоверно снижены в 1,3 и 1,26 раза соответственно по сравнению с контрольной группой (р<0,05). Это, вероятно, связано с тем, что АпоА1 входит в состав антиатерогенных ЛПВП и обеспечивает транспорт ХС в печень и его катаболизм.
У больных СПКЯ показатель АпоВ увеличен на 9,8% (89,32±4,57 мг/дл) по сравнению с нормативными данными (81,34±4,61 мг/дл, р<0,05). У больных СПКЯ с ожирением уровень АпоВ увеличен на 13,8% (97,31±5,27 мг/дл) по сравнению с больными СПКЯ с НМТ (85,48±3,51 мг/дл, р<0,05). У больных с НМТ концентрация АпоВ в сыворотке крови была снижена на 5,1% по сравнению с контрольной группой (р<0,05).
Поскольку АпоВ является основным протеином ХС ЛПНП и ХС ЛПОНП [16] повышение уровня которых сопровождается увеличением транспорта ХС внутрь клетки, то и характер их нарушений аналогичен с изменениями уровня ХС ЛПНП и ХС ЛПОНП.
Указанные нарушения наиболее ярко демонстрируют повышение соотношения АпоВ/АпоА1, отражающие атерогенный потенциал крови. Соотношение АпоВ/АпоА1 у больных СПКЯ в 1,3 раза превышало (0,67±0,02) контрольные значения (0,53±0,02). Соотношение АпоВ/АпоА1 у больных СПКЯ с ожирением (0,79±0,03) по сравнению с больными с НМТ (0,58±0,02) и контрольной группой было повышено в 1,4 и 1,5 раза соответственно (р<0,05). У больных СПКЯ с НМТ соотношение АпоВ/АпоА1 превышало на 9,4% нормативные данные (р<0,05).
Средний уровень ЛП(а) у больных СПКЯ в сыворотке крови был увеличен в 3 раза (15,62±3,87) по сравнению со здоровыми женщинами (5,17±2,21, р<0,05). У больных СПКЯ с НМТ уровень ЛП(а) превышал контрольные значения в 2,4 (12,43±2,17, р<0,05), при наличии ожирения — в 3,7 раза (19,31±5,12, р<0,05).
Одним из наиболее важных критериев атерогенности является отношение АпоВ/АпоА1 и КА. Если значение КА между больными СПКЯ с ожирением и НМТ составляли 11,9%, то отношение АпоВ/АпоА1 — 19,7%. Таким образом, полученные результаты свидетельствуют о более высокой прогностической значимости показателя АпоВ/АпоА1 в отношении риска атеросклероза по сравнению с традиционно используемым показателем КА.
У больных с 25<ИМТ<30 кг/м2 КА превышал нормативные данные на 15%, АпоВ/АпоА1 — на 26,4%, у больных с ИМТ>30 кг/м2 — на 17,4% и 32,8% соответственно, т.е. по мере увеличения ИМТ достоверно повышаются атерогенные индексы, что имеет высокую корреляцию (r=0,79, р<0,05).
Проведенные исследования показывают, что у 81 (67,5%) больных СПКЯ выявлены нарушения метаболизма липидов (табл. 2), частота которых была достоверно выше у больных с ожирением по сравнению с пациентками, имеющими НМТ (соответственно 87,1 и 58%).
Таблица 2. Частота и структура нарушений липидного спектра крови у больных СПКЯ
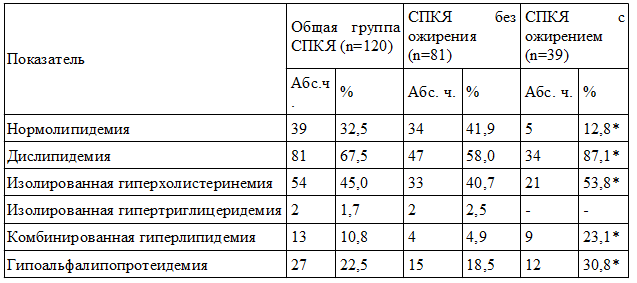
Примечание: * — достоверные различия с соответствующей группой больных без ожирения (р<0,05)
При ИМТ<25 кг/м2 ДЛП встречались у 47 (58%) из 81 больной, при 25<ИМТ<30 кг/м2 — у 11 (78,6%) из 14 больных, при ИМТ>30 кг/м2 — у 23 (92%) из 25 больных, т.е. по мере увеличения ИМТ возрастает частота встречаемости ДЛП, что имеет высокую корреляцию (r=0,71, р<0,05).
Изолированная гиперхолестеринемия (II а тип, ХС>5,0 ммоль/л) выявлена у 45% больных СПКЯ, частота которой достоверно (р<0,05) выше у больных с ожирением по сравнению с больными, имеющими НМТ (соответственно 53,8 и 40,7%).
Гиперлипидемия II в типа или комбинированная гиперлипидемия (ХС>5,0 ммоль/л, ТГ>1,7 ммоль/л) диагностирована у 10,8% больных, частота выявления которой была достоверно (р<0,05) выше у больных с ожирением по сравнению с пациентками, имеющими НМТ (соответственно 23,1 и 4,9%).
Гипоальфалипопротеидемия (ЛПВП<1,3 ммоль/л) выявлена у 22,5% больных СПКЯ, частота которой была достоверно (р<0,05) выше у больных с ожирением по сравнению с больными, имеющими НМТ (соответственно 30,8 и 18,5%).
Изолированная гипертриглицеридемия IV типа (ТГ>1,7 ммоль/л) была выявлена лишь у 1,7% пациенток.
Наиболее частыми нарушениями липидного обмена у больных СПКЯ являются изолированная гиперхолестеринемия (45%) и гипоальфалипопротеидемия (22,5%), несмотря на то, что средние уровни ХС превышали контрольные значения лишь на 11,1%, а средние уровни ХС ЛПВП были снижены на 15% (рис.1). Общая гипертриглицеридемия, как изолированная, так и в комбинации с гиперхолестеринемией, выявлена у 12,5% больных СПКЯ, несмотря на то, что среднее содержание ТГ в сыворотке крови было увеличено в 1,6 раза по сравнению со здоровыми женщинами.
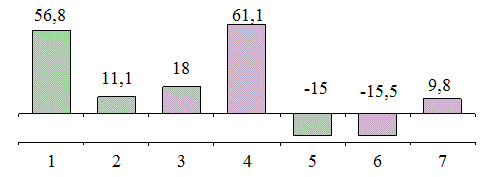
Рис. 1. Процентные отношения от нормативных показателей липидного обмена у больных СПКЯ: 1 — ТГ; 2 — ХС; 3 — ХС ЛПНП; 4 — ХС ЛПОНП; 5 — ХС ЛПВП; 6 — АпоА1; 7 — АпоВ
Изучение взаимосвязей липидных показателей позволило выявить положительную корреляцию ИМТ с ТГ, АпоВ, АпоВ/АпоА1 (r=457, r=361, r=469, р<0,05) и отрицательную — с ХС ЛПВП, АпоА1 (r=-0,327, r=-0,361, р<0,05), что подтверждает негативное влияние ожирения на показатели липидного обмена.
С другой стороны, атерогенный показатель крови может повышаться под влиянием яичниковых андрогенов, о чем свидетельствуют полученные нами корреляции между Т и ХС, ТГ, АпоА1, АпоВ, АпоВ/АпоА1 (r=0,245, r=0,369, r=+0,341, r=391, r=0,634 соответственно, р<0,05), между ИСА и ТГ, АпоА1, АпоВ/АпоА1 (r=0,221, r=0,527, r=0,548 соответственно, р<0,05). Выявлены корреляционные связи андростендиола (А) с данными липидных показателей: (r=0,487 — для ХС, r=531 – для ТГ, r=0,231 – для ХС ЛПНП, r=0,351 — для КА, r-0,621 — для АпоВ/АпоА1, р<0,05) и отрицательная корреляция А с ХС ЛПВП (r=-0,435, р<0,05), что, возможно, свидетельствует о большем неблагоприятном влиянии А на метаболизм липидов. Отмечены корреляционные связи между концентрациями ДГЭА-С в крови и ХС (r=0,264, р<0,05), ТГ (r=0,409, p<0,05), АпоВ/АпоА1 (r=0,679, р<0,05), КА (r=0,357, р<0,05). В связи с этим нельзя исключить, что повышенные концентрации ДГЭА-С также могут усугублять изменения липидного обмена у больных СПКЯ.
Сниженная секреция СТГ у больных СПКЯ связана с нарушенной чувствительностью к И, которая на уровне жировой ткани может влиять на превращение глюкозы в жиры и тем самым играть определенную роль в развитии ДЛП [21]. Это предположение подтверждается обнаруженными корреляциями между концентрациями СТГ и ТГ, АпоА1, АпоВ/АпоА1 (r=0,217, r=+0,236, r=0,271 соответственно, р<0,05).
С другой стороны, ГИ может способствовать возникновению нарушений липидного обмена у больных СПКЯ [12,22]. С целью изучения влияния ГИ на липидный обмен, обследованные больные были разделены на 2 группы: 62 (51,7%) - с ГИ и 58 (48,3%) - с нормоинсулинемией (НИ).
Независимо от наличия или отсутствия ГИ уровни атерогенных фракций липидов были достоверно выше, а уровни антиатерогенных достоверно ниже у больных СПКЯ по сравнению со здоровыми женщинами (р<0,05) (табл. 3). Однако, ГИ значительно усугубляет эти нарушения, что выражается в увеличении среднего показателя ТГ, ХС ЛПОНП и отношения АпоВ/АпоА1 почти в 1,5 раза по отношению к таковым у больных с НИ (р<0,05). Уровни ХС ЛПВП и АпоА1 у больных с ГИ были снижены (р<0,05) по отношению к больным с НИ.
Таблица 3. Основные показатели липидного спектра сыворотки крови у больных СПКЯ и различными типами инсулиновых ответов на ГТТ
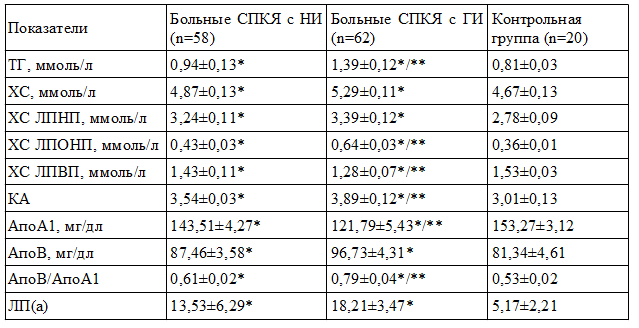
Примечания: * - достоверные различия с группой контроля (р<0,05); ** - достоверные различия по отношению к группе больных с нормоинсулинемией (р<0,05)
Уровни И положительно коррелировали с ТГ (r=0,23, р<0,05), АпоВ/АпоА1 (r=0,253, р<0,05) и отрицательно с ХС ЛВП (r=-0,453, р<0,05) и АпоА1 (r=-0,236, р<0,05).
Известно, что гиперлипидемия крови при сочетании с такими факторами риска, как курение, наследственные заболевания (семейная гиперлипидемия, сахарный диабет и сердечно-сосудистые заболевания — ССЗ), артериальная гипертензия являются риском развития атеросклероза. Показатель суммарного риска развития КБС (табл.4) свидетельствует о высоком суммарном риске развития КБС у больных СПКЯ. Так, у каждой второй пациентки риск развития КБС был>5% и почти у каждой десятой - >20%, тогда как в контрольной группе риск развития КБС был низким - <5%. Низкий суммарный риск развития КБС (<5%) значительно реже выявляли у больных с СПКЯ и ожирением, чем у пациенток с НМТ (р<0,05). Высокие показатели суммарного риска развития КБС (>20%) отмечались лишь в группе больных с СПКЯ и ожирением, о чем свидетельствует достоверно более высокой средний показатель суммарного риска развития КБС (8,81±1,1 — 22,81±2,36%) по сравнению с больными с НМТ (5,19±0,15 — 10,91±0,45%, р<0,05).
Таблица 4. Показатели суммарного риска развития КБС у больных СПКЯ
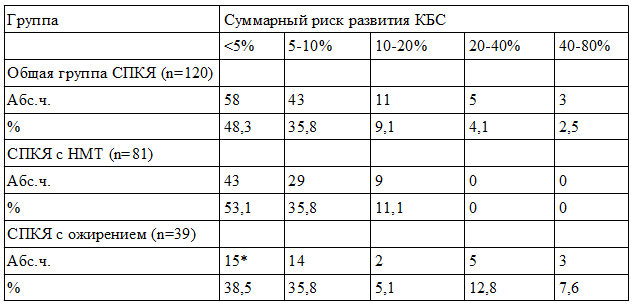
Примечание: * - достоверные различия с соответствующей группой больных с НМТ (р<0,05)
Обсуждение. Частота ДЛП у больных СПКЯ составила 65,8%. Следует отметить, что ДЛП чаще диагностировались у больных с ожирением (у 87,1%), у больных с НМТ частота ДЛП составила 58%, что, вероятно, обусловлено атерогенным эффектом андрогенов. Роль яичниковой гиперандрогении в развитии ДЛП у больных СПКЯ можно рассматривать в нескольких аспектах. Так, андрогены могут оказывать непосредственное влияние на липидный обмен, способствуя повышению синтеза ЛПОНП в печени и подавлению катаболизма ЛПНП, что приводит к увеличению уровня ЛПОНП и ЛПНП в сыворотке крови. Кроме того, андрогены могут усиливать активность печеночной липазы и угнетать синтез ЛПВП [19]. С другой стороны, гиперандрогения, по данным исследователей [25], в 50-75% случаев сочетается с ГИ, а по нашим — в 51,7%. ГИ вызывает нарушения метаболизма липидов, которые сопровождаются повышением содержания в крови атерогенных фракций ЛП (ЛПОНП, ЛПНП) и снижением уровня антиатерогенных ЛПВП [2,3,6]. Подтверждением этого являются полученные результаты, свидетельствующие о том, что в структуре ДЛП у больных с СПКЯ вне зависимости от наличия или отсутствия ожирения преобладают изолированная гиперхолестеринемия (45%) и гипоальфалипопротеидемия — у 22,5%. Выявлено также значительное повышение среднего уровня общего ХС, ХС ЛПНП, ХС ЛПОНП и снижение уровня ЛПВП в сыворотке крови больных с СПКЯ по сравнению с нормативными данными (р<0,05). Об увеличении атерогенного потенциала крови у больных с СПКЯ свидетельствуют повышение КА, соотношения АпоВ/АпоА1 у больных не только с ожирением, но и с НМТ. Полученные нами данные согласуются с результатами ряда исследователей [7,9].
Яичниковая гиперандрогения наряду с ГИ способствует возникновению висцерального ожирения, которое усугубляет нарушения метаболизма, вызванные избыточным количеством андрогенов [12,22]. Липолиз жировой ткани в абдоминально-висцеральной области приводит к увеличению содержания свободных жирных кислот, в первую очередь, в портальной вене, которая наиболее коротким путем доставляет их в печень, в результате чего возникают нарушения метаболизма с повышением синтеза ТГ, АпоВ и сборки частиц ЛПОНП [13]. Этим объясняется пятикратное увеличение частоты выявления комбинированной гиперлипидемии, характеризующейся повышением уровня как ХС, так и ТГ у больных СПКЯ и ожирением, по сравнению с таковой у больных с НМТ (р<0,05). Средний уровень ТГ у пациенток с СПКЯ с ожирением был достоверно высоким по сравнению с больными с НМТ, что свидетельствует о роли ожирения и связанных с ним факторов в генезе гипертриглицеридемии. Ряд исследователей [2,17] обнаружили у больных с СПКЯ повышенный уровень ТГ по сравнению с женщинами с той же весовой категории без СПКЯ, что было показано и в наших исследованиях.
Неблагоприятное влияние ожирения на липидный спектр крови проявлялось как повышением частоты, так и увеличением степени выраженности ДЛП. Так, средний уровень ХС был значительно выше у больных с ожирением, чем у больных с НМТ, а средний уровень ЛПВП — достоверно более низким, что нашло отражение в достоверном повышении КА. У пациенток с СПКЯ и ожирением был выявлен высокий средний уровень АпоВ, который является составной частицей ЛПНП, в связи с чем повышение содержания ЛПНП, обусловленное влиянием избыточного количества андрогенов и ожирением у больных с СПКЯ, привело к увеличению уровня АпоВ. АпоВ является надежным маркером развития атеросклероза, поэтому у больных с СПКЯ повышен риск возникновения ССЗ [15].
Представляются интересными изменения концентрации ЛП(а), повышение которой рассматривается в качестве независимого, наследственно обусловленного фактора риска атеросклероза и ишемической болезни сердца, что связано с особенностью его метаболизма и структурной схожестью с плазминогеном [10]. Существует концепция генетической детерминированности СПКЯ с метаболическими нарушениями [4]. В этой связи показателен повышенный уровень ЛП(а) у больных СПКЯ по сравнению с контрольными значениями (р<0,05). Увеличение уровня ЛП(а) может указывать не только на высокую вероятность возникновения атеросклероза, но и на повышенный риск тромботических осложнений. Полученные результаты свидетельствуют о высоком риске развития атеросклероза и КБС у больных с СПКЯ, так как повышение уровня атерогенных фракций ЛП, АпоВ, ЛП(а) и снижение уровня антиатерогенного ЛПВП увеличивает вероятность возникновения ССЗ.
Высокий риск развития КБС (>5%) отмечался почти у каждой второй пациентки с СПКЯ, тогда как у всех женщин контрольной группы данный показатель был низким (<5%). Высокие показатели суммарного риска развития КБС (более 20%), требующие фармакотерапии, отмечались лишь в группе больных с СПКЯ и ожирением.
Можно заключить, что для больных СПКЯ характерны нарушения липидного спектра крови, в структуре которых доминируют гиперхолестеринемия и гипоальфалипорпотеидемия. Ожирение является дополнительным неблагоприятным фактором, усугубляющим липидные нарушения, что проявляется значительным повышением атерогенного потенциала крови и развитием гипертриглицеридемии. Высокая частота липидных нарушений, сопряженных с повышенным риском развития атеросклероза и КБС, указывает на необходимость разработки терапевтических мероприятий по профилактике ССЗ у больных с СПКЯ. Коррекция липидных нарушений должна предусматривать в первую очередь лечение ожирения, а также нормализацию уровня И и андрогенов, назначение гиполипидемических препаратов в соответствии с индивидуальным типом ДЛП, что должно приводить к снижению частоты возникновения ССЗ у больных с СПКЯ.
