Введение. Миома матки является доминирующей доброкачественной опухолью малого таза и определяет наибольшее количество оперативных вмешательств в репродуктивном возрасте [2, 18]. Лейомиома матки представляет собой доброкачественную опухоль независимого моноклонального происхождения [13]. Концепция эстрогенной зависимости роста миомы матки, долгое время господствующая в патогенезе данного заболевания, пересмотрена благодаря результатам последних молекулярно-генетических, иммунногистохимических, биохимических и клинических исследований, свидетельствующих о том, что не только стероидные гормоны, но и факторы роста (ФР) играют значительную роль в формировании миомы матки [1, 6, 18]. Факторы роста – полипептиды, объединенные в группу трофических регуляторных субстанций. Подобно гормонам, факторы роста обладают широким спектром физиологического воздействия на многие клетки – стимулируют и ингибируют митогенез, хемотаксис, дифференцировку.
В патогенезе лейомиомы матки ключевую роль играют следующие факторы роста: EGF (эпидермальный фактор роста), IGF (инсулиноподобные факторы роста и связывающие их протеины, осуществляющие регуляторную роль), TGF-β (трансформирующий фактор роста), bFGF (основной фактор роста фибробластов) [7, 11, 12, 14, 15, 17].
Инсулиноподобные факторы роста — это низкомолекулярные белки, структурно схожие с проинсулином, стимулирующие пролиферацию и дифференцировку клеток различных тканей [16, 19]. Исследования Boehm K. и соавт. (1990) впервые показали повышенную экспрессию IGF-II в тканях миомы в сравнении с окружающим миометрием [3], повышенная экспрессия данного фактора роста была доказана целым рядом работ как клинических [7], так экспериментальных [4]. В частности, в эксперименте была показана стимуляция митоза и ингибирование апоптоза в культуре ткани миомы в отсутствие половых гормонов [19, 20]. Американскими учёными впервые in vitro была доказана аутокринная и паракринная стимуляция инсулиноподобными факторами роста митоза в клетках миометрия [22]. Работы китайских учёных подтвердили этот факт, а также показали, что IGF-II может выступать в качестве медиатора эстрогенного воздействия на клетки миометрия [10].
Молекулярно-генетические исследования, прежде всего, касаются изучения Ava-II (restriction fragment length polymorphism) полиморфизма гена инсулиноподобного фактора роста. Работы Gloudemans T, Pospiech I и соавт. (1993) показали, что гомозиготные носители аллеля А данного полиморфного варианта имеют более высокий риск развития лейомиомы матки, такой же результат был получен в отношении злокачественных новообразований гладкомышечной ткани для лиц обоего пола [7]. В тоже время работы японских учёных показали, что повышенная экспрессия IGF-II в тканях миометрия не является результатом биаллельной экспрессии данного гена [9].
Анализ литературных данных показал, что основная роль инсулиноподобного фактора роста II типа (IGF–II) в патогенезе лейомиомы матки связана с процессами активации митотической активности клеток и медиаторной ролью данного фактора роста в отношении эстрогенного воздействия [7, 9, 10, 16, 19, 20], что обосновало выбор гена данного фактора роста для исследования.
Целью нашего исследования стало изучение генетического полиморфизма 3123 G/A инсулиноподобного фактора роста (IGF II) в связи с возникновением миомы матки.
Материалы и методы исследования. Материалом для исследования послужила выборка из 300 пациентов отделения оперативной гинекологии Областного перинатального центра г. Курска за 2011-2012 г. Основную группу составили 180 человек с гистологически верифицированным диагнозом миомы матки, 120 пациенток вошли в контрольную группу. Всем пациентам проводилось стандартное клинико-лабораторное обследование.
У всех пациентов проводился забор венозной крови. Выделение геномной ДНК осуществляли из размороженной венозной крови стандартным методом фенольно-хлороформной экстракции. Генотипирование полиморфизма генов IGF-II осуществлялось с помощью мультиплексной полимеразной цепной реакции (ПЦР) с последующим анализом длин рестрикционных фрагментов согласно описанному в литературе протоколу [5]. Продукты рестрикции подвергали электрофорезу в 3% агарозном геле с добавлением бромистого этидия и визуализировали в проходящем УФ-свете с применением компьютерной видеосъемки на приборе GDS-8000 (UVP, США).
Для сравнения распределений частот генотипов и их комбинаций в выборках больных миомой матки и контрольной группе использовали критерий χ2 Пирсона с поправкой Йетса на непрерывность. Различия рассматривали как достоверные при уровнях значимости р<0,05. Об ассоциации генотипов с предрасположенностью к заболеванию судили по величине отношения шансов с 95% доверительным интервалом (CI). Статистическая обработка данных проводилась с использованием программных пакетов Statistics 6.0 («StatSoft», США).
Полученные результаты и обсуждение. Статистически значимых возрастных различий между исследуемыми группами не наблюдалось. Средний возраст пациенток основной группы – 48,78 ± 5,91, средний возраст пациенток, включенных в группу контроля – 51,31 ± 8,93 лет.
Отклонения частот генотипов исследуемых полиморфных вариантов от равновесия Харди–Вайнберга в основной и контрольной группах не было.
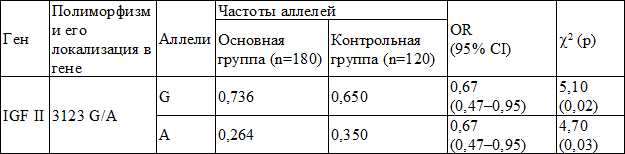
При сравнении частот аллелей нами были получены статистически достоверные различия между исследуемыми группами: частота аллеля G в основной группе составила 0,736, а аллеля A – 0,264 (OR=0,67, 95%Cl = 0,47–0,95, p=0,02); в контрольной группе – частота аллеля G составила 0,650, а аллеля A – 0,350 (OR=0,67, 95%Cl = 0,47– 0,95, p = 0,03).
Сравнительный анализ частот аллелей полиморфизма 3123 G/A гена IGF II представлен в табл. 1.
Таблица 1. Сравнительный анализ частот аллелей исследуемого ДНК-маркера между основной и контрольной группой
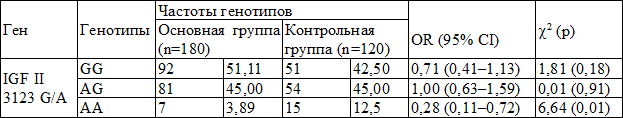
В распределении частот генотипов полиморфизма гена IGF II 3123 G/A обнаружены следующие закономерности: гомозиготный мутантный генотип AA статистически достоверно чаще встречается в группе здоровых (OR = 0,28; 95%Cl = 0,11–0,72, p = 0,01) в сравнении с основной группой. Сравнительный анализ частот генотипов полиморфизма 3123 G/A гена IGF II приведен в табл. 2.
Таблица 2. Распределение частот генотипов полиморфизма 3123 G/A гена IGF II у больных миомой матки и здоровых
Обсуждение полученных результатов. В результате нашего исследования выявлено, что носительство вариантных генотипов 3123 G/A IGF II (rs:680) имеет ассоциацию с развитием миомы матки в популяции Центрально – Черноземного региона.
Ген инсулиноподобного фактора роста II типа локализуется в коротком плече 11ой хромосомы – 11q15,5, данный фактор также известен под названием соматомедин А [5]. Инсулиноподобный фактор роста II типа, как и остальные представители данного семейства факторов роста обладает мощным митогенным влиянием, ускоряет клеточную дифференцировку и ингибирует апоптоз [7].
О функциональной роли исследуемого полиморфизма (3123 G/A IGF II) можно говорить исходя из данных исследования Vafiadis P. и соавт. (1998), согласно которым носители GG полиморфного варианта отличаются повышенным количеством мРНК IGF II у пациентов с сахарным диабетом [21].
В результате нашей работы выявлено, что частоты аллелей и частоты генотипов в основной и контрольной группе достоверно различаются по полиморфизму 3123 G/A IGF II. Частота А-аллеля в основной группе была достоверно снижена, что говорит о его протективной роли в развитии миомы матки. Известно, что носители АА–генотипа отличаются пониженным уровнем инсулиноподобного фактора роста II типа, что реализуется в снижении митогенной активности клеток мезодермального происхождения (миометрия и лейомиомы), подавлении процесса апоптоза. Таким образом, полиморфный вариант G/G 3123 G/A IGF II может быть ассоциирован с повышенным риском развития данной гинекологической патологии.
В настоящее время продолжается поиск генов кандидатов, вовлеченных в патогенез миомы матки, как мультифакториального заболевания. Возможно, ген инсулиноподобного фактора роста является одним из них, так как достоверно доказана его роль в активации митоза и ингибировании апоптоза, в ключевых патогенетических механизмах миоматозного процесса. Полученные результаты о протективном A аллеле 3123 G/A полиморфного варианта IGF II, могут быть использованы для расчёта индивидуального риска развития миомы матки у пациенток с отягощенным наследственным и гинекологическим анамнезом.
Данная работа может быть продолжена в исследовании других популяций и этнических групп, а также в отношении полиморфных вариантов других генов, вовлеченных в процесс формирования миомы матки.
