Актуальность проблемы. В современных демографических условиях проблема абортов в Российской Федерации занимает особое место. Ежегодно в мире более 75 млн. женщин сталкиваются с проблемой незапланированной беременности, из них у 2/3 она заканчивается абортами [11], последствия которых занимают значительное место в структуре материнской смертности. При этом если раньше репродуктивный выбор ограничивался только правом на аборт, то сегодня он включает право на контрацепцию, право на беременность и право на стерилизацию, которая может улучшить качество жизни [8].
Стерилизация женщин является высокоэффективным методом долговременной контрацепции, который заключается в создании искусственной непроходимости маточных труб при мини-лапаротомии, лапароскопии или гистероскопии [2,3,7,9,12,13,15]. Добровольная женская стерилизация является наиболее распространенным в ряде стран мира методом контрацепции. По данным AVSC International, около 166 млн. женщин в настоящее время предохраняются от нежелательной беременности, используя метод добровольной хирургической стерилизации (ДХС). В соответствии с Федеральным законом № 323 от 21.11.11 г. «Об основах охраны здоровья граждан в Российской Федерации» (статья 57) медицинская стерилизация как специальное вмешательство с целью лишения человека способности к воспроизводству или как метод контрацепции может быть проведена по письменному заявлению женщины/мужчины не моложе 35 лет или имеющих не менее двух детей, а при наличии медицинских показаний и согласии женщины/ мужчины – независимо от возраста и наличия детей [5]. Противопоказаний к операции хирургической стерилизации практически нет [1].
Механическая стерилизация клеммами Фильше и Хулка является наиболее распространенным методом хирургической контрацепции в мире, конкурирующим с электрокоагуляцией [15]. Отдаленные осложнения при клеммировании труб клипсами Фильше и Хулка были менее значительными в сравнении с электрокоагуляцией. Однако проведение хирургической стерилизации с применением клемм Фильше и Хулка может быть осуществлено лишь в специализированных гинекологических стационарах врачом достаточно высокой квалификации при наличии соответствующего вспомогательного оборудования для наложения клемм [4], при строго перпендикулярном расположении клемм на маточных трубах. Отсутствие опыта выполнения таких операций может послужить причиной технических ошибок и послеоперационных осложнений (повреждение целостности трубы, внутрибрюшное кровотечение, соскальзывание клемм с последующей их миграцией, беременность). Главными причинами возникновения послеоперационных осложнений являются несовершенство конструкций существующих разновидностей клемм, сложность их строения (наличие замыкательной пружины, амортизирующей прокладки, шарнирного крепления). Эти факторы определяют также относительно большую массу клемм. Особое значение имеет тот факт, что при использовании клемм подобного рода не выполняется условие их биомеханической совместимости с тканями. Давление клемм является более жестким, чем обратная реакция тканей, что приводит к некрозу и обуславливает появление трубно-перитонеальных фистул. Помимо недостатков самих конструкций клемм, их наложение на маточные трубы невозможно при отсутствии специального вспомогательного инструментария (аппликатора).
Цель исследования. Разработать метод хирургической стерилизации маточных труб с применением кольцевидных клемм, обладающих термомеханической памятью.
Материал и методы. Учитывая существование данной проблемы, при отсутствии отечественного аналога клеммы, нами совместно с НИИ медицинских материалов и имплантатов с памятью формы (г. Томск) была создана клемма из никелида титана, обладающего биомеханической совместимостью с тканями человеческого организма [14], для проведения хирургической контрацепции женщин. Успех при использовании имплантата определяется в первую очередь его биомеханической и биохимической совместимостью с тканями. Это обусловлено тем, что ткани представляют собой не просто материал, а биологическую систему, которая реагирует на введение имплантата изменением собственной структуры. Биомеханическая совместимость означает отсутствие иммунных реакций, воспалительных процессов и, как следствие, отсутствие отторжения имплантата. В совокупность требований биологической совместимости материала включены: отсутствие канцерогенной активности, токсичности, коррозионной реакции, проявление химической и физической стойкости [14].
Использование клеммы позволяет уменьшить величину повреждаемого фрагмента маточной трубы, что очень важно для безопасности операций подобного рода. В клипсе, представляющей собой отрезок сомкнутой проволочной спирали из сверхэластичного никелида титана с эффектом памяти формы, имеется три витка. Концы витков (2) подогнуты параллельно оси спирали внутрь ее контура, касательно витков (1) (рис.1) [6]. В сомкнутом состоянии концы спирали служат ограничителем выдавливания ткани сжимаемого органа и фиксатором клипсы на нем, так как ориентированы навстречу друг другу. Достижимость технического результата обусловлена, в основном, цилиндрической формой клипсы. Круглая в плане, то есть не имеющая выступающих участков, клипса при необходимости может рационально вписываться в просвет цилиндрического троакара и не требует точной ориентации, т.е. сложной манипуляции в стесненных условиях при установке на пережимаемый орган. При этом два смежных витка середины спирали служат браншами устройства (рис.2) [6] и, стремясь к сомкнутому («холодному») состоянию под действием сил термомеханической памяти формы и сверхэластичности, пережимают помещенный между ними полый орган. Длина подогнутых концов ограничена их соотношением 2,5 – 3,0 с диаметром проволоки для исключения возможности травматизации окружающих тканей. При срабатывании устройства витки – бранши смыкаются и ущемляют стенки яйцеводов в двух местах под образующими (рис.3) [6]. Усилие компрессии благодаря свойству сверхэластичности адекватно величине, вызывающей ишемию ущемленной ткани и замещение ее в отдаленный период соединительной тканью.
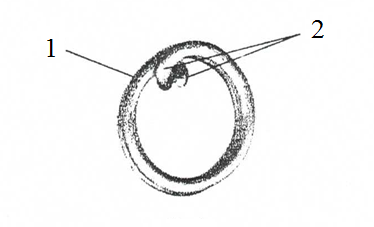
Рис. 1. Кольцевидная клемма

Рис. 2. Кольцевидная клемма в раскрытом состоянии
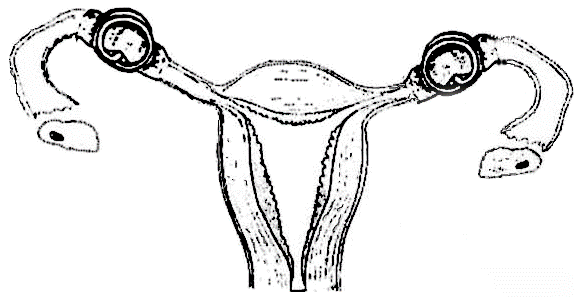
Рис. 3. Схема наложенных на маточные трубы кольцевидных клемм
Эксперименты по использованию созданной клеммы были проведены на половозрелых самках кролика породы Шиншилла, разделенных на две равные группы. В I группе у 30 животных осуществляли двустороннее клеммирование яйцеводов с помощью разработанной модели кольцевидной клеммы. Во II группе 30 самкам кролика проводилась двусторонняя биполярная электрокоагуляция яйцеводов. Подготовка к операции, анестезиологическое пособие и ведение послеоперационного периода у всех животных были одинаковыми. С 7-х суток экспериментальные животные подсаживались в клетки к половозрелым кроликам-самцам. Выведение из опыта осуществляли на 3-и, 7-е, 14-е, 30-е и 60-е сутки с последующим исследованием механической прочности участков окклюзии яйцеводов методом пневмопрессии.
После подготовки операционного поля брюшную полость кролика вскрывали минилапаротомным доступом. Инструментально осуществлялась мобилизация яйцевода, затем с помощью доставляющего инструмента клемма с разведенными браншами подводилась к заданному участку яйцевода. Клемма, нагреваясь за счет тканей до температуры тела, спонтанно смыкала бранши, восстанавливая свою первоначальную форму. Вследствие этого происходило плавное сжатие яйцевода в двух локальных участках. Аналогичным образом производилось клеммирование яйцевода с противоположной стороны. После двухстороннего клеммирования яйцеводов брюшная полость ушивалась послойно наглухо. Для сравнительного анализа была проведена вторая серия опытов, в которую также вошли 30 кроликов. Им осуществлялась стерилизация яйцеводов методом биполярной коагуляции по стандартной методике: яйцевод захватывался зажимом-коагулятором и осуществлялась его электрокоагуляция двумя захватами щипцов по 15 с каждый при температуре 120ºС.
Ежедневно проводилась оценка общего состояния животных, определялась их масса (до кормления), измерялась ректальная температура. В процессе экспериментальных исследований проводилась динамическая оценка показателей крови. Клинический анализ крови (уровень лейкоцитов, скорость оседания эритроцитов (СОЭ), лейкоцитарная формула) проводился с помощью традиционных методик. В связи с недостаточной информативностью общепринятых гематологических показателей для оценки течения послеоперационного периода у экспериментальных животных было проведено определение лейкоцитарного индекса интоксикации и гематологического показателя интоксикации. Из биохимических показателей крови исследовалось содержание общего белка, а также С-реактивный белок.
В послеоперационном периоде животным, которым была проведена стерилизация яйцеводов кольцевидными клеммами, выполнялась обзорная рентгенография органов брюшной полости для определения места расположения клемм и выявлении возможных внурибрюшных осложнений. Проведение рентгенологического исследования позволило исключить соскальзывание клемм с яйцеводов и их миграцию в брюшной полости.
Механическую прочность и физическую герметичность участков окклюзии яйцеводов у экспериментальных животных изучали в различные сроки после операции методом пневмопрессии по методике В.П. Матешука после выведения кроликов из опыта и визуальной оценки состояния органов брюшной полости. Для этого использовали манометр от аппарата Рива-Роччи для измерения артериального давления. После извлечения органокомплекса, состоящего из внутренних половых органов, его погружали в лоток с водой. В дистальном отделе маточного рога герметично фиксировали трубку, через которую нагнетали воздух с помощью баллончика от аппарата Рива-Роччи. Давление регистрировали в момент появления пузырьков воздуха над участком окклюзии яйцевода. Участок окклюзии считался состоятельным, если внутрипросветное давление яйцевода достигало 50 мм.рт.ст. Выше давления не повышали в связи с необходимостью сохранения объекта для дальнейшего гистологического исследования.
Удаленные у экспериментальных животных яйцеводы и яичники подвергались гистологическому исследованию. После фиксации и последующей промывки проточной воде препараты подвергались уплотнению путем их обезвоживания в спиртах возрастающей концентрации и затем заливались в парафиновые блоки. На микротоме осуществлялось приготовление срезов толщиной 5-7 мкм. Окрашивание срезов проводили гематоксилином Эрлиха и эозином, пикрофуксином по методу Ван-Гизона. Подсчет клеточных элементов проводился в 10 полях зрения при увеличении 40х10 с перерасчетом на площадь 1 мм2. Определение линейных размеров структур выполнялось на микрометре с ценой деления 0,01 мм.
Статистическую обработку полученных результатов проводили с помощью стандартных программных продуктов «MS Excel 2010» и SPSS. Проверка на нормальность распределения выполнялась методом Шапиро-Уилка. Для данных, подчиняющихся закону нормального распределения, рассчитывали среднее значение и стандартные отклонения; для данных, ему не подчиняющихся, рассчитывали медиану и квартили. По критерию Стьюдента производили сравнение средних значений для параметрических показателей, а по методу Краскела-Уоллиса и Манна-Уитни – для непараметрических данных. Различия сравниваемых результатов считали достоверными при уровне значимости р<0,05.
Результаты и обсуждение. В первые трое суток состояние крольчих соответствовало тяжести перенесенной операции. К седьмым суткам состояние животных было вполне удовлетворительным, о чем свидетельствовало повышение их аппетита и положительная динамика массы тела. Заживление послеоперационного шва во всех случаях было первичным натяжением. В последующие сутки активность животных соответствовала дооперационному периоду. Все животные дожили до выведения их из опыта. Выведение из опыта осуществлялось по 6 особей из каждой группы на 3-и, 7-е, 14-е, 30-е и 60-е сутки после операции стерилизации. После выведения животных из опыта проводилась визуальная оценка экспериментальных участков яйцеводов и окружающих их органов. Наступления беременности не отмечено ни в одном случае наблюдения.
На 3-и сутки после операции стерилизации яйцеводов клеммами из нитинола в брюшной полости не обнаружено патологических изменений. Фиксация клемм на яйцеводах надежная, миграции их не отмечено. На 3-и сутки после стерилизации методом электрокоагуляции в брюшной полости обнаружен серозный выпот. Экспериментальные фрагменты яйцеводов деструктивно изменены, отмечен умеренный отек окружающих тканей. На 7-е сутки после стерилизации клеммами из нитинола патологические изменения в брюшной полости отсутствовали. Отмечен процесс спонтанной перитонизации клемм за счет окружающей их брюшины без признаков воспалительной реакции. После проведения электрокоагуляции к этому сроку экспериментальные фрагменты яйцеводов к этому сроку имели бледно-розовую окраску с белесоватым оттенком, брюшина, покрывающая их, была тусклой. Сохранялся отек тканей, отмечены рыхлые спайки с окружающими органами.
К 14 суткам после стерилизации клеммами процесс их перитонизации был более выраженным, макроскопических признаков воспалительной реакции не отмечено. При стерилизации электрокоагуляцией на 14-е сутки после операции исследуемые фрагменты яйцеводов визуализировались в виде бессосудистых грубых соединительнотканных тяжей, имеющих спайки с мочевым пузырем и предлежащими петлями кишечника. По истечении 30 суток. При вскрытии брюшной полости у животных первой группы патологических изменений не обнаружено, клеммы покрыты брюшиной. Миграции клемм также не отмечено. У животных второй группы отмечен спаечный процесс между экспериментальными участками яйцеводов и окружающими тканями. Коагулированные яйцеводы выглядели в виде плотных белесоватых тяжей.
К 60-м суткам после операции стерилизации клеммами из нитинола миграции клемм не обнаружено, клеммы покрыты прозрачной блестящей брюшиной, спаечного процесса в брюшной полости не отмечено. В то время как у животных второй группы спаечный процесс присутствовал практически во всех случаях. Микроскопическое исследование препаратов I группы (после клеммирования яйцеводов) показало, что в ранние сроки (3–7 сутки) в местах компрессии развивается неспецифическое воспаление с явлениями вакуолизации цитоплазмы и пролиферации клеток однорядного призматического эпителия слизистой оболочки, отеком соединительной ткани собственной пластинки слизистой, мышечной и серозной оболочек, более выраженные между браншами клемм. При этом в проксимальных и дистальных отделах яйцеводов на удалении 5 мм от клеммы патологических изменений обнаружено не было, отмечено лишь незначительное расширение кровеносных сосудов, что явилось результатом тех процессов, которые происходили в зоне клеммирования. К концу периода наблюдений (30-60 сутки) отмечено, что складки слизистой в местах компрессии сращены. В окружающих место клеммирования тканях патологических изменений не отмечено.
Проведенные гистологические исследования показали, что применение созданных клемм для хирургической стерилизации создает локальный участок непроходимости яйцеводов без грубых морфологических изменений, окружающих зону клеммирования тканей. При гистологическом исследовании экспериментальных фрагментов яйцеводов у животных II группы (после электрокоагуляции яйцеводов) к 3-им суткам отмечается формирование обширных зон некроза, в мезосальпинксе определяются участки с выраженным нарушением кровообращения и признаками асептического воспаления. К 14-м суткам при использовании электрокоагуляции сохраняется выраженная воспалительная реакция в стенке яйцевода, постепенно происходит замещение соединительной тканью на протяжении всей зоны коагуляции. Замещение зон некроза фиброзной тканью происходит вплоть до 60-х суток после операции.
Оценка механической прочности участков окклюзии яйцеводов с помощью метода пневмопрессии показала, что после стерилизации яйцеводов клеммами из никелида титана в течение всего периода наблюдения отмечалась надежная герметичность клеммированных участков, в то время как после электрокоагуляции вплоть до 60-х суток она все еще оставалась недостаточной.
Заключение. Таким образом, проведенные исследования убедительно свидетельствуют, что применение созданной клеммы для хирургической контрацепции создает надежные участки непроходимости яйцеводов, что позволяет гарантировать состоятельность операции со дня ее проведения.
