Введение. За последнее 10-летие произошли значительные изменения в понимании механизмов обмена железа в организме и его регуляции. К современным методам ранней диагностики железодефицитных анемий (ЖДА) относятся определение концентрации сывороточного железа (СЖ), общей железосвязывающей способности сыворотки (ОЖСС), сывороточного трансферрина и ферритина (СФ). Определение железа сыворотки крови дает представление об уровне транспортируемого железа в плазме крови, связанного с трансферрином. Большие вариации содержания железа в сыворотке крови, возможность его увеличения при некротических процессах в тканях, снижение при воспалительных процессах, ограничивают диагностическое значение измерения железа сыворотки. Определяя только концентрацию железа в сыворотке крови, нельзя получить информацию о причинах нарушения феррокинетики. Для этого необходимо определять содержание в крови трансферрина и ферритина.
Ферритин является растворимым в воде комплексом гидроокиси железа с белком апоферритином. Он содержится в клетках печени, селезенки, костного мозга и ретикулоцитах. Ферритин содержит 20% общего количества железа в организме и является основным белком человека, депонирующим железо. Измерение ферритина сыворотки крови используется для диагностики и мониторинга дефицита или избытка железа, дифференцированной диагностики анемий. Низкие значения ферритина - это самый ранний критерий уменьшения запасов железа в организме [1].
Определение ферритина может давать ложноположительные результаты при патологии печени, воспалениях, опухолях, когда его содержание может быть увеличено. Наибольшее значение определение ферритина имеет при диагностике нарушений метаболизма железа [3].
В последнее время предложен более чувствительный, но и технически более сложный метод диагностики железодефицитных состояний - определение концентрации в сыворотке крови растворимого трансферринового рецептора (рТфР). Этот метод зарекомендовал себя как высокоэффективный и информативный для изучения состояния эритропоэза [5,8].
Вопросу изучения роли рТфР как одного из основных патогенетических механизмов развития ЖДА посвящены работы целого ряда исследователей [4,6,7].
Трансферрин - бета-глобулин, синтезируемый в печени. Из общего количества трансферрина в организме человека только 25-40% содержит железо. Трансферрин способен также связывать ионы других металлов (цинк, кобальт). Коэффициент насыщения трансферрина железом - это процент, который составляет железо сыворотки от трансферрина. Определение трансферрина в сыворотке крови является наиболее достоверным тестом оценки железодефицитных состояний.
Основными причинами снижения содержания трансферрина в сыворотке крови являются торможение процессов его синтеза в гепатоцитах при хроническом гепатите, циррозе, хронической нефропатии, голодании, неопластических процессах. Транспорт железа в клетку происходит при взаимодействии комплекса железо-трансферрин со специфичным для трансферрина рецептором плазматической мембраны. Рецептор состоит из двух пептидных цепей, проходящих сквозь мембрану клетки. Молекула транферрина, несущая до двух атомов железа, присоединяется к экстрацеллюлярному концу рецептора, после чего поглощается клеткой путем эндоцитоза. В сформированной везикуле происходит изменение рН, железо изменяет степень окисления (с Fe3+ на Fe2+) и в дальнейшем используется для синтеза гемоглобина (HGB) или сохраняется в форме депонированного железа. Белковая часть трансферрина, освободившись от железа, вместе с рецептором выходит на поверхность клетки, где апо-трансферрин отделяется и весь цикл возобновляется. При повышенной потребности в железе, цикл рецептора трансферрина ускоряется и все больше рецепторов располагается на поверхности клетки. При этом все чаще внеклеточная часть рецептора подвергается расщеплению экстрацеллюлярными протеазами. В результате воздействия протеаз от рецептора отделяется и попадает в кровь довольно стабильный фрагмент - пептид с молекулярным весом 95 кDа - растворимый рецептор трансферрина, концентрацию которого можно определить с помощью иммуноферментного метода. Приблизительно 80% рецепторов трансферрина находится на плазматической мембране эритропоэтических клеток. Кроме того, наличие рецептора доказано в клетках плаценты, в лимфоцитах и в некоторых опухолевых клетках. Плотность рецептора трансферрина на поверхности клеток-предшественников эритроцитов повышается по мере развития клеток вплоть до ретикулоцита, но на поверхности зрелого эритроцита рецепторов трансферрина не обнаружено.
Мониторинг уровня рTфР позволяет определить терапевтический успех применения эритропоэтина. Обычно, при адекватной стимуляции эритропоэза рTфР начинает повышаться. При локальном дефиците железа уровень ферритина и рTфР изменяются разнонаправлено: ферритин снижается, рTфР повышается. При повышении ферритина при хронических воспалениях и опухолях эффективную потребность железа можно оценить только при определении концентрации рTфР. При истинных железодефицитных анемиях уровень трансферринового рецептора увеличивается в 3-4 раза [2].
Целью настоящей работы явилось изучение содержания растворимого трансферринового рецептора в сыворотке крови женщин репродуктивного возраста с различной патологией эндо- и миометрия, осложненной кровотечением, и уточнение его роли в оценке патогенетических механизмов железодефицитных состояний у данной категории больных.
Материалы и методы исследования. Анализ показателей гемограммы и определение уровня растворимых трансферриновых рецепторов в сыворотке крови проведены у 105 женщин репродуктивного возраста с аденомиозом, лейомиомой матки и гиперплазией эндометрия, осложненные кровотечением, поступивших в гинекологическое отделение стационара Дорожной клинической больницы г. Саратова. Группы обследуемых формировались в зависимости от уровня гемоглобина и по клиническому диагнозу. Из них 40 пациенток – это женщины с лейомиомой матки без сопутствующей гинекологической патологии. Среди этой категории больных было выделено 2-е подгруппы с учетом уровня гемоглобина крови: I.1 подгруппа – 25 женщин с уровнем гемоглобина от 111 г/л до 125 г/л; I.2 подгруппа – 15 женщин с уровнем гемоглобина от 80 г/л до 110 г/л. Во вторую группу вошли 35 человек – пациентки с лейомиомой матки в сочетании с аденомиозом. Из них – II.1 подгруппа 18 женщин с содержанием гемоглобина от 111 г/л до 125 г/л; II.2 подгруппа - 17 пациенток с уровнем гемоглобина от 80 г/л до 110 г/л. В третью группу вошли 30 женщин с гиперпластическим процессом эндометрия. Среди них III.1 подгруппа – 19 пациенток с показателями гемоглобина от 111 г/л до 125 г/л; III.2 подгруппа – 11 пациенток с уровнем гемоглобина от 80 г/л до 110 г/л. Критериями не включения в обследуемую группу явились больные с хроническими воспалительными заболеваниями органов малого таза, с обострением сопутствующей соматической патологии, заболевания печени, онкологическими заболеваниями, сахарным диабетом, тяжелыми иммунодефицитами. Критериями включения в группу явились: возраст пациенток от 30 до 45 лет; наличие диагноза лейомиома матки, аденомиоз, гиперпластический процесс эндометрия; наличие информированного согласия обследуемых женщин. Контрольную группу составили 25 практически здоровых женщин аналогичного возраста, при обследовании которых не было выявлено патологии органов малого таза и без выраженной сопутствующей патологии, с нормальным уровнем гемоглобина.
Постановка диагноза проводилась с учетом клинической картины, данных постоперационного цитологического и гистологического исследования, результатов ультразвукового исследования органов малого таза. Для исключения воспалительного процесса проводили определение С-реактивного белка (СРБ). Для оценки обмена железа у женщин было проведено исследование общего железа сыворотки крови, определение ферритина, общей железосвязывающей способности сыворотки и растворимого трансферринового рецептора.
Определение уровня сывороточного ферритина проводилось методом твердофазного иммуноферментного анализа (ИФА), на автоматическом ИФА-анализаторе Аlisei Q.S. (SEАC, Италия), используя стандартизированные наборы производства ЗАО «ВЕКТОР-БЕСТ». На биохимическом полуавтоматическом анализаторе CLIMА MC-15 (PАL, Испания) определяли уровень сывороточного железа, общей железосвязывающей способности сыворотки крови колориметрическим методом (без депротеинизации) с использованием наборов FS «ДДС» (Германия), содержание СРБ - иммунотурбодиметрическим методом. Для определения растворимого трансферринового рецептора в сыворотке крови использовали специальный набор реагентов «Растворимый рецептор трансферрина – ИФА – БЕСТ» с использованием метода твердофазного иммуноферментного анализа.
Обработку результатов проводилась с использованием программы Stаtistikа 6.0. Ассиметрично распределенные вариационные ряды описывали при помощи медианы (Ме) и интерквартильной широты (интервал значений между 25-м и 75-м процентилем распределения). Показатели с нормальным распределением описывались при помощи среднего (М) и стандартного отклонения (СО). При анализе непрерывных данных двух независимых выборок использовался t-критерий Стьюдента либо его непараметрический аналог U-критерий Манна-Уитни. Различие считалось достоверным при двустороннем уровне значимости р<0,05, р<0,01.
Результаты и их обсуждение. Результаты проведенных исследование представлены в табл. 1. Анализ значений рТфР проводился с учетом нормативных величин, представленных фирмой «ВЕКТОР БЕСТ» в использованном нами набором «Растворимый рецептор трансферрина – ИФА – БЕСТ».
Таблица 1. Показатели растворимого трансферринового рецептора и феррокинетики у женщин репродуктивного возраста с лейомиомой матки, аденомиозом и гиперплазией эндометрия, осложненные кровотечением
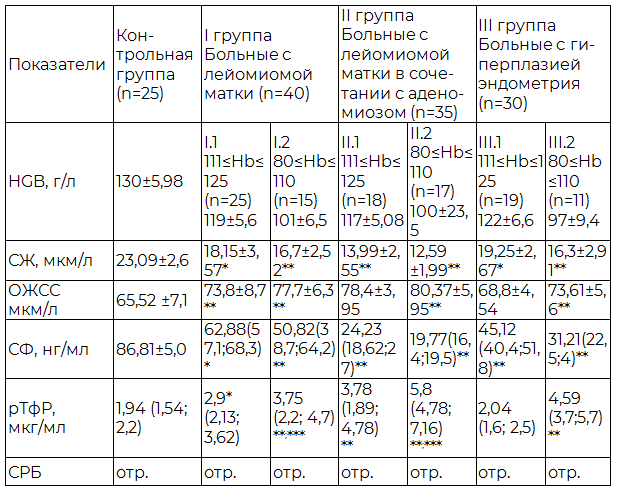
Примечание: * - различия достоверны по сравнению с контрольной группой (p≤0,05); **-различия достоверны по сравнению с контрольной группой (p≤0,01); ***-различия достоверны между I.2 и II.2 подгруппой (p≤0,01).
У всех обследуемых нами женщин наблюдается характерная клинико-диагностическая картина железодефицитной анемии на разных стадиях ее развития, проявляющаяся в соответствующих изменениях показателей обмена железа – у женщин с лейомиомой матки, аденомиозом и гиперплазией эндометрия I.1, II.1 и III.1 подгрупп уровень гемоглобина приближается к нормальным значениям и составляет 119 г/л, 117 г/л и 122 г/л (по данным Всемирной организацией здравоохранения (ВОЗ) анемией считается снижение гемоглобина ниже 120 г/л). Уровень сывороточного железа и ферритина у данной категории больных достоверно снижен по отношению к здоровым женщинам и составляет 18,15 мкм/л и 62,88 нг/мл, 13,99 мкм/л и 24,23 нг/мл, 19,25 мкм/л и 45,12 нг/мл, 23,09 мкм/л и 86,81 нг/мл соответственно.
Железосвязывающая способность сыворотки достоверно повышается у женщин I.1, II.1 и III.1 подгрупп по сравнению с контрольной группой (65,52 мкм/л), и достигает максимального значения у пациенток с лейомиомой матки в сочетании с аденомиозом (78,4 мкм/л). Описанная выше лабораторная картина метаболизма железа у женщин репродуктивного возраста с различной патологией матки с уровнем гемоглобина выше 110 г/л, позволяет нам предположить наличие у данной категории больных латентного дефицита железа.
Оценивая аналогичные показатели в подгруппах I.2, II.2 и III.2 нами были выявлены диагностические признаки манифестного дефицита железа – снижение уровня гемоглобина до 101 г/л, 100 г/л и 97 г/л соответственно. Концентрация сывороточного железа и ферритина значительно снижена во всех подгруппах больных относительно здоровых женщин и женщин I.1, II.1 и III.1 подгрупп – 16,7 мкм/л, 12,59 мкм/л, 16,34 мкм/л и 50,82 нг/мл, 19,77 нг/мл и 31,21 нг/мл соответственно. Железосвязывающая способность сыворотки у пациенток I.2, II.2 и III.2 подгрупп повышена относительно контрольной группы и составляет 77,7 мкм/л, 80,37 мкм/л и 73,61 мкм/л соответственно.
Концентрация растворимых трансферриновых рецепторов оказалась достоверно повышенной у всех обследуемых женщин по сравнению со здоровыми (1,94 мкг/мл), и своих максимальных значений (5,8 мкг/мл) достигает у пациенток с сочетание лейомиомы матки и аденомиоза со средним значение гемоглобина 100 г/л и минимальным значением сывороточного ферритина и железа 19,77 нг/мл и 12,59 мкм/л соответственно. Полученные результаты полностью согласуются с результатами, полученными другими исследователями [9], и позволяют рассматривать растворимый трансферриновый рецептор как один из основных патогенетических механизмов формирования ЖДА.
Выводы
1. Результаты нашего исследования подтверждают значимость рТфР как одного из основных патогенетических механизмов ЖДА.
2. При ЖДА уровень ферритина и рТфР в плазме крови изменяются разнонаправлено: концентрация ферритина – снижается, а уровень рТфР – повышается.
Таким образом, уровень растворимых рецепторов трансферрина отражает адекватное поступление железа в клетки костного мозга и соответствует «активной массе» эритропоэза.
