Удельный вес женского бесплодия колеблется в пределах 60-70%. Этиология женского бесплодия весьма разнообразна и мало изучена. По данным отечественных и зарубежных ученых, бесплодие при эндометриозе встречается в 30-60% случаев и является одним из основных симптомов проявления данной патологии [1, 2, 5, 7, 16,17, 18].Кроме того, частота наступления беременности у женщин с бесплодием, ассоциированным с эндометриозом, после проведения курса лечения не превышает 30-33% [2,6,17,19], что требует углубления исследований и поиска новых стратегий, направленных на повышение эффективности лечения.
В последние годы большое внимание уделяется изучению роли цитокинов в механизмах формирования эндометриоидных очагов [1,9,15,20,23]. Гены цитокинов характеризуются наличием одного или нескольких структурных полиморфизмов, которые оказывают влияние на функциональную активность или уровень экспрессии кодируемых белков [3,8,10,21]. В то же время представляются интересными результаты немногочисленных, но перспективных исследований о возможном участии иммунорегуляторных цитокинов в формировании женского бесплодия без сочетания с эндометриозом [15,18,20,23].
В связи с этим является актуальным анализ аллельного полиморфизма генов иммунорегуляторных цитокинов при бесплодии, ассоциированном с эндометриозом, и установление роли полиморфных вариантов генов иммунорегуляторных цитокинов в патогенезе бесплодия, ассоциированного с эндометриозом, и идентификация молекулярно-генетических маркеров предрасположенности к развитию заболевания.
Материал и методы исследования. Нами было обследовано 236 женщин с бесплодием, находившихся на стационарном лечении в гинекологическом отделении с 2010 по 2012 г., подписавших информированное согласие на участие в исследовании. В программу исследования были включены женщины только европеоидного происхождения, проживающие на территории г. Томска и Томской области, поскольку существуют значительные межрасовые различия в распределении исследуемых генотипов и аллелей.
Все женщины на догоспитальном этапе были обследованы согласно стандартизированному протоколу обследования бесплодной пары, разработанному группой экспертов ВОЗ для программ исследований по репродукции человека (протокол № 84914 от 19.02.2007 г.).
Пациентки поступали на плановую лапароскопию и гистероскопию для уточнения причин бесплодия.
На основании лапароскопической картины и гистологического подтверждения диагноза все обследованные женщины были распределены на две группы: основная группа состояла из 145 пациенток, страдающих бесплодием, ассоциированным с наружным генитальным эндометриозом.
Критерии включения в исследование:
- бесплодие;
- репродуктивный возраст (21-40 лет);
- подтвержденный (лапароскопически и гистологически) диагноз наружный генитальный эндометриоз;
- информированное согласие женщины на участие в исследовании.
Контрольная группа состояла из 91 женщины, страдающей бесплодием, у которых по результатам лапароскопии и гистероскопии наружный генитальный эндометриоз был исключен.
Критерии исключения для обеих групп:
-возраст до 21 и после 40 лет;
-хроническая ановуляция;
-другая патология органов малого таза (воспалительные заболевания в фазе обострения, миома матки);
-аномалии развития половых органов;
-мужской фактор бесплодия;
-участие женщины в другом клиническом исследовании;
-тяжелые экстрагенитальные заболевания в стадии декомпенсации;
-онкологические заболевания;
-хромосомные болезни;
-отказ женщины от продолжения исследования.
Всем женщинам была проведена лапароскопия и гистероскопия с последующим гистологическим исследованием операционного материала.
Нами проводилось исследование полиморфизмов генов IL1B, IL2, IL4, IL6, IL10, IFNG, и TGFB в периферической крови пациенток.
Для исследования полиморфизма генов IL1B, IL2, IL4, IL6, IL10, IFNG, и TGFB выделение ДНК из периферической крови проводили согласно инструкции, прилагаемой к набору «ДНК-сорб-В» («ИнтерЛабСервис», Россия). Исследование полиморфных участков генов цитокинов проводили с использованием аллель-специфической амплификации специфических участков генома. Амплификацию осуществляли согласно инструкции, прилагаемой к набору «АмплиСенс-200-1» («ИнтерЛабСервис», Россия), в пробирках типа «Эппендорф» путём полимеразной цепной реакции, используя структуру праймеров и параметры температурных циклов, описанных в литературе с применением амплификатора «Терцик МС2» («ДНК-технология», Россия). Было исследовано семь полиморфных вариантов семи генов цитокинов –511С/Т гена IL1B (rs16944), T-330G гена IL2 (rs2069762), C-590T гена IL-4 (rs2243250), –174G/C гена IL6 (rs1800795), C-592A гена IL10 (rs1800872), +874А/Т гена IFNG (rs2340561), С-509Т гена TGFВ (rs1800469).
Статистическую обработку данных проводили с использованием стандартных алгоритмов биометрии с помощью программы Microsoft Exсel (2007), стандартного пакета программ SPSS® 17.0 for Windows. Для определения соответствия распределения количественных признаков нормальному закону использовали критерий Шапиро-Уилка. Проверку статистической значимости равенства выборочных средних, имеющих ненормальный закон распределения, проверяли с помощью U-критерия Манна-Уитни для двух групп и с помощью критерия Крускала-Уолиса для трех групп. Различия считались достоверными при уровне значимости p<0,05 и p<0,001. Для анализа качественных независимых данных использовали точный критерий Фишера и χ2 Пирсона. Распределение генотипов по исследованным полиморфным локусам проверяли на соответствие равновесию Харди-Вайнберга с помощью точного теста Фишера. Для анализа ассоциации исследуемых генов с эндометриозом сравнивали частоты аллелей и генотипов, используя критерий χ2 с поправкой Йетса на непрерывность. При численностях генотипов менее пяти использовали точный тест Фишера. В дополнение к этому об ассоциации генотипов (или их комбинаций) с заболеванием судили по величине отношения шансов (OR - критерий отношения шансов, отражающий относительный риск развития заболевания при определенном генотипе по сравнению со здоровыми донорами с 95% доверительным интервалом).
Результаты исследования и их обсуждение. В ходе настоящего исследования было установлено, что средний возраст всех обследованных женщин составил 30,22±0,28 лет, длительность бесплодия у которых колебалась в пределах от 1 года до 11 лет. Среди женщин без эндометриоза чаще встречалось вторичное бесплодие - 52,7% (p<0,05), а у пациенток с эндометриозом статистически значимо чаще наблюдалось первичное бесплодие, частота которого составляла 67,6% (p<0,05).
При изучении жалоб интересно отметить, что 33,8% женщин с бесплодием и эндометриозом и лишь 1,1% женщин с бесплодием, кроме отсутствия беременности при регулярной половой жизни без контрацепции в течение года и более, предъявляли жалобы на тазовую боль (р<0,001).
Основным лечебно-диагностическим методом, применяемым нами для диагностики и хирургической коррекции бесплодия, сочетанного с эндометриозом, были лапароскопия и гистероскопия. По результатам лапароскопии у 60 (41,4%) женщин были зарегистрированы эндометриодные кисты яичников, у 45 (31%) – малые формы эндометриоза, а у 40 (27,6%) женщин - сочетание эндометриодных кист яичников и малых форм эндометриоза (p<0,05). Проводилось иссечение эндометриодных очагов и эндометриоидных кист яичников. Интраоперационно всем обследованным женщинам выполнялась хромогидротубация, по результатам которой установлено, что у 43 (47%) пациенток контрольной группы и 92 (63,4%) основной группы маточные трубы были непроходимы (p<0,05).
В ходе лапароскопии у всех обследованных женщин был выявлен спаечный процесс органов малого таза различной степени. В группе женщин, страдающих эндометриозом и бесплодием, спаечный процесс наблюдался у 75 (51,72%) женщин, а в группе женщин, имеющих только бесплодие – лишь у 1 (1,1%). При этом у женщин с бесплодием, ассоциированным с эндометриозом, чаще были обнаружены первая и вторая степени спаечного процесса (у 24 (16,55%) и 33 (22,76%) пациенток соответственно), третья степень – у 14 (9,65%) и четвертая степень – у 4 (2,76%) женщин (p<0,001). В ходе выполнения гистероскопии у обследованных женщин обеих групп патологии выявлено не было, что подтверждалось результатами гистологического исследования эндометрия.
Анализируя данные литературы, можно сказать, что патогенетическая ассоциация эндометриоза и бесплодия на сегодняшний момент достоверно не раскрыта. Имеются различные данные о возможных механизмах сочетания этих двух состояний. Одной из причин бесплодия при эндометриозе может быть генетически детерминированное нарушение в цитокиновой системе эндометрия, фолликулов яичников, перитонеальной жидкости [2,11,15,19,23]. Молекулярно-генетическими методами было установлено, что наличие одного или нескольких структурных полиморфизмов генов цитокинов оказывает влияние на функциональную активность или уровень экспрессии кодируемых белков [4,12-14,22,24,25].
В связи с этим представляется актуальным анализ аллельного полиморфизма генов иммунорегуляторных цитокинов при бесплодии в сочетании с эндометриозом и без него.
Проведенный нами анализ позволил установить, что аллель Т полиморфизма C511T гена IL1B являлся фактором риска развития эндометриоза, ассоциированного с бесплодием. Риск развития заболевания увеличивался почти в 3 раза (OR=2,81). При этом аллель С обладал протективным эффектом. При сравнении распределения генотипов в двух группах пациенток было обнаружено, что у женщин с бесплодием и с бесплодием, сочетанным с эндометриозом, характер распределения генотипов полиморфизма Т-330G гена IL2 значимо не отличался. При анализе полиморфизма C-590T гена IL4 нами были получены следующие результаты. Показана положительная ассоциация генотипа ТТ (OR=21,74) и аллеля Т (OR=1,9) с бесплодием, сочетанным с эндометриозом, в то время как генотип СС полиморфизма C-590T гена IL4 обеспечивал протекцию в отношении сочетания эндометриоза и бесплодия.
В ходе исследования была установлена ассоциация риска развития бесплодия при эндометриозе с генотипом АА (29,89) и аллелем A (3,95) полиморфного сайта C-592A гена IL10. Также был отмечен протективный эффект гомозиготного генотипа по аллелю С данного полиморфизма (OR=0,25). В ходе проведенного нами исследования было установлено значимое увеличение частоты генотипа СС и аллеля С полиморфизма G-174C гена IL6 у женщин с бесплодием, ассоциированным с эндометриозом. Таким образом, нами было показано, что фактором риска ассоциации бесплодия с эндометриозом являлся аллель C (OR=3,07) и генотип СС (9,27), а защитным эффектом обладал генотип GG локуса G-174C гена IL6 (OR=0,34). Результаты анализа сайта С-509Т гена TGFВ у женщин с бесплодием и эндометриозом показали преобладание гомозиготного генотипа CС, в то время как самым редким генотипом был TT, аналогичную тенденцию имело распределение частот встречаемости генотипов в группе пациенток, страдающих бесплодием без эндометриоза. По полученным нами данным при носительстве аллеля Т риск развития бесплодия, сочетанного с эндометриозом, увеличивается в 1,7 раза, а в случае наличия генотипа ТТ локуса С-509Т гена TGFВ в 2,4 раза.
Полученные нами результаты подтверждают факты, описанные в литературе, результатом которых является супрессия Th1 звена иммунного ответа и пролиферация и инвазия эндометриодных имплантов, что может приводить к развитию инфертильности.
Отдельные аллельные варианты генов цитокинов малоинформативны для прогнозирования развития эндометриоза и ассоциированного с ним бесплодия, тогда как анализ их комбинаций может дать более полноценный индивидуальный прогноз. Нами был проведен анализ сочетаний генотипов полиморфизма C511T гена IL1B, полиморфизма С-590T гена IL4, полиморфизма G-174C гена IL6, полиморфизма С-592A гена IL10, полиморфизма C-509T гена TGFB, в результате которого мы определили протекторные, предрасполагающие и интактные комбинации к развитию инфертильности, сопровождающейся эндометриозом. Ввиду того, что статистически значимых различий в распределении генотипов полиморфных вариантов полиморфизма T-330G гена IL2 и полиморфизма A-874T гена IFNG у обследованных женщин получено не было, мы не включили в анализ сочетаний полиморфных маркеров данные показатели (табл. 1).
Таблица 1. Рисковые комбинации полиморфных вариантов генов C511T гена IL1B, С-590T гена IL4, G-174C гена IL6, С-592A гена IL10, C-509T гена TGFB, у женщин с бесплодием и эндометриозом
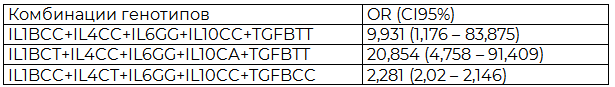
Примечание:: анализ качественных независимых данных проводили с помощью критерия χ2 Пирсона или точного критерия Фишера; р – уровень статистической значимости различий между группами; статистически значимые различия считали при р<0,05; χ2=16,18; χ2=13,1 соответственно.
Кроме того, нам удалось определить рисковые комбинации генотипов в отношении развития трубного фактора бесплодия у пациенток с инфертильностью, сочетанной с эндометриозом (табл. 2).
Таблица 2. Рисковые комбинации полиморфных вариантов C511T гена IL1B, С-590T гена IL4, G-174C гена IL6, С-592A гена IL10, C-509T гена TGFB у женщин с непроходимыми маточными трубами
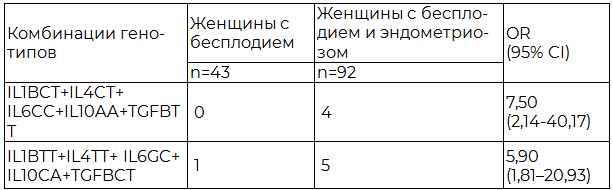
Примечание: n – количество человек в группе; статистически значимые различия считали при р<0,05; χ2=11,18; χ2=19,1 соответственно.
Нами определен вклад как отдельных генных полиморфизмов, так и их сочетаний в увеличении рисковых шансов развития инфертильности в сочетании с наружным генитальным эндометриозом. Проведенное исследование распределения генетических полиморфизмов у больных бесплодием, сочетанным с эндометриозом, выявило значимость вариантных генотипов генов иммунорегуляторных цитокинов в формировании предрасположенности к развитию бесплодия, ассоциированного с эндометриозом, и, сочетанного с ним, трубного фактора бесплодия.
Подводя итог, можно сделать вывод, что у женщин с бесплодием, ассоциированным с эндометриозом, преобладают генотипы TT полиморфизма C-511T гена IL1B, TT полиморфного сайта C-590T гена IL4, CC полиморфизма G-174C гена IL6, AA промоторного региона С-592A гена IL10 и TT полиморфизма C-509T гена TGFB. А также было установлено, что сочетание эндометриоза и бесплодия статистически ассоциировано с тремя рисковыми комбинациями генотипов полиморфных вариантов генов: CC гена IL1B + CC гена IL4 + GG гена IL6 + CC гена IL10 + ТT гена TGFB; CТ гена IL1В + CC гена IL4 + GG гена IL6 + CА гена IL10 + ТТ гена TGFВ; CC гена IL1B + CT гена IL4 + GG гена IL6 + CC гена IL10 + CC гена TGFB.
В тоже время сочетание генотипов CT гена IL1B + СТ гена IL4 + СС гена IL6 + АА гена IL10 + ТТ гена TGFB и ТT гена IL1B + ТТ гена IL4 + GС гена IL6 + CА гена IL10 + CТ гена TGFB значимо чаще встречается у женщин с бесплодием, сопровождающимся эндометриозом и поражением маточных труб.
