Введение. Железодефицитная анемия (ЖДА) – это наиболее распространенная форма анемии, составляющая 80-90% всех случаев анемии. ЖДА наблюдается не менее чем у 10-15% взрослого населения России, достигая в отдельных регионах 25-30% среди женщин детородного возраста [2].
В 80-90% случаев причинами возникновения железодефицитной анемии у пациенток с гинекологическими заболеваниями являются миома матки, аденомиоз и гиперплазия эндометрия, сопровождающиеся патологическими маточными кровотечениями [7]. У 70% больных с миомой матки и у 67% с аденомиозом именно хроническая постгеморрагическая анемия является показанием к оперативному лечению [1].
Согласно современным представлениям наиболее адекватными тестами для оценки метаболизма железа в организме являются: определения уровня сывороточного железа и феррритина (СФ), содержание растворимых трансферриновых рецепторов (рТфР) в сыворотке крови.
Накопленные в настоящее время данные по изучению показателей феррокинетики при железодефицитных состояниях, обусловленных кровотечением указывают на то, что именно ферритин является одним из основных регулятором гомеостаза железа в организме, а снижение его уровня в сыворотке крови является одним из патогенетических механизмов формирования анемии [3].
На сегодняшний день для объективной оценки феррокинетики наряду с ферритином, для раннего выявления дефицита железа в организме появился альтернативный лабораторный тест – определение концентрации растворимого рецептора трансферрина в сыворотке крови.
Наличие растворимого трансферринового рецептора известно достаточно давно: еще в 1963 г. австрийские исследователи Jandl и Katz [6] сообщили о существовании рецепторов трансферрина. Сначала для измерения концентрации рТфР были использованы коммерческие наборы, основанные на иммуноферментном анализе (ИФА). В настоящее время в лабораториях применяют гомогенные методы или методы латексной нефелометрии, которые адаптируются к обычным типам анализаторов.
В течение длительного времени исследователи искали претендента на роль гуморального регулятора обмена железа. Связь между гепсидином и метаболизмом железа была впервые установлена C. Pigeon [10]. В последующих работах R.E. Fleming и W.S. Sly предположили, что гиперпродукция гепсидина во время инфекции и воспаления может быть ответственна за анемию воспаления [5]. А в 2002 г. работами G. Nicolas, D.A. Weinstein и другими доказано главенствующее значение гепсидина при железодефицитных состояний [8,9]. В настоящее время установлено, что увеличение концентрации железа в организме провоцирует синтез гепсидина – гуморального регулятора метаболизма железа, при активации которого уменьшается всасывание железа в кишечнике и транспорт из макрофагального депо в плазму. Это означает, что гепсидин оказывает тормозящее воздействие на любой транспорт железа из тканей и клеток, таких как макрофаги, энтероциты, плацента.
Целью настоящей работы явилось изучение некоторых патофизиологических механизмов формирования анемии у женщин репродуктивного возраста с лейомиомой матки и аденомиозом, осложненные кровотечением.
Материалы и методы исследования. Для изучения особенностей феррокинетики и патофизиологических механизмов формирования железодефицитной анемии было обследовано 105 женщин репродуктивного возраста, находившихся на лечении в гинекологическом стационаре Дорожной клинической больницы г. Саратова.
В обследование были включены только женщины репродуктивного возраста от 30 до 45 лет, средний возраст которых составил 40,2±4 года. До обследования женщины не получали терапию препаратами железа, витаминами, влияющими на кроветворение, гемотрансфузии, оральные контрацептивы. Критериями исключения являлись: манифест органной патологии; инвалидность (любая причина); хронические неспецифические заболевания легких; пороки сердца; аутоиммунные заболевания; эндокринная патология (сахарный диабет); заболеваниями печени (острые гепатиты и циррозы печени); хронические заболевания почек; хронические инфекции в фазе обострения; хронические воспалительные заболевания органов малого таза; тяжелые иммунодефициты. Группу сравнения составили 25 практически здоровых женщин с нормальным уровнем гемоглобина.
Диагноз был верифицирован с учетом клинической картины, результатов ультразвукового исследования органов малого таза, данных постоперационного цитологического и гистологического исследования. Объективное исследование включало общий осмотр, обследование по органам и системам. Определение С-реактивного белка (СРБ) для исключения воспалительного процесса.
Общий анализ крови проводили на гематологическом автоматическом анализаторе КХ- 21N (SYSMEX, Япония) с определением гемоглобина (HGB), эритроцитов (RBC), лейкоцитов (WBC) и эритроцитарных индексов: среднего объема эритроцита (MCV), среднего содержания гемоглобина в эритроците (MCH), средней концентрации гемоглобина в эритроците (МСНС), показателя анизоцитоза эритроцитов (RDW). Определение уровня сывороточного ферритина проводилось методом твердофазного иммуноферментного анализа, на автоматическом ИФА-анализаторе Alisei Q. S. (SEAC, Италия), используя стандартизированные наборы производства ЗАО «ВЕКТОР-БЕСТ». На биохимическом полуавтоматическом анализаторе CLIMA MC-15 (PAL, Испания) определяли уровень сывороточного железа, общей железосвязывающей способности сыворотки крови колориметрическим методом (без депротеинизации) с использованием наборов FS «ДДС» (Германия), содержание СРБ - иммунотурбодиметрическим методом. Для определения растворимого трансферринового рецептора в сыворотке крови использовали специальный набор реагентов «Растворимый рецептор трансферрина – ИФА – БЕСТ» с использованием метода твердофазного иммуноферментного анализа. Для определения гепсидина в сыворотке крови использовали специальный набор без экстракции (Hepsidin-25 human) для иммуноферментного анализа, разработанный группой компаний «BCM», США, Cat. No. S-1337.
Обработку результатов проводилась с использованием программы Statistika 6.0. Ассиметрично распределенные вариационные ряды описывали при помощи медианы (Ме) и интерквартильной широты (интервал значений между 25-м и 75-м процентилем распределения). Показатели с нормальным распределением описывались при помощи среднего (М) и стандартного отклонения (СО). При анализе непрерывных данных двух независимых выборок использовался t-критерий Стьюдента либо его непараметрический аналог U-критерий Манна-Уитни. Различие считалось достоверным при двустороннем уровне значимости р<0,05, р<0,01.
Результаты и их обсуждение. Кровотечение является одним из ведущих факторов в развитии анемии у женщин репродуктивного возраста с лейомиомой матки, аденомиозом и гиперплазией эндометрия.
По клиническому диагнозу, обследуемые нами женщин были разделены на три группы. Первую группу составили женщины (38,2%) с изолированной лейомиомой матки, во вторую группы вошли пациентки (33,3%) с сочетанием лейомиомы матки с аденомиозом и третью группу составили женщины (28,5%) с гиперплазией эндометрия, осложненной кровотечением. Все группы были рандомизированны по возрасту.
Анализ содержания гемоглобина в крови в этих группах выявил наличие достоверных различий в группах и в сравнении с контрольной группой (112 г/л, 106 г/л, 116 г/л и 130 г/л соответственно). Свое минимальное значение (106 г/л) уровень гемоглобина имел в группе с сочетанной патологией, что объясняется более обильной кровопотерей, в связи с особенностями ангиогенеза у данной категории больных.
Таким образом, у женщин репродуктивного возраста с лейомиомой матки, аденомиозом и гиперплазией эндометрия повышенная кровопотеря во время менструации, повышенная потребность в железе и повышенная его трата оказывают значительное влияние на развитие анемического синдрома у данной категории больных.
Изучая распространенность анемического синдрома у 105 женщин детородного возраста с аденомиозом и лейомиомой матки при помощи скрининга общего анализа крови, в 72% случаев анемия была диагностирована (критериями анемии был уровень гемоглобина менее 120г/л (ВОЗ, 1979) [4]. У 28% больных показатели гемограммы не отличались от нормальных, однако при дальнейшем более глубоком изучении феррокинетики у данной категории больных также было выявлено нарушение обмена железа.
Следовательно, исследование только показателей гемограммы является не достаточным и не позволяет дать полного представления о патогенетических механизмах формирования анемии у данной категории больных.
Согласно современным представлениям наиболее адекватными тестами для оценки метаболизма железа в организме являются: определения уровней железа, феррритина, содержание растворимых трансферриновых рецепторов в сыворотке крови.
Проанализировав содержание сывороточного железа у женщин репродуктивного возраста с различной патологией эндо- и миометрия мы получили достоверное снижение его содержания во всех группах обследуемых нами пациенток. Уровень сывороточного ферритина у всех женщин снижен относительно контрольной группы и составил 58,35 нг/мл у женщин с лейомиомой матки, 22,18 нг/мл – у пациенток с сочетанием лейомиомы матки и аденомиоза и 39,56 нг/мл – у женщин с гиперплазией эндометрия. Анализ изменений общей железосвязывающей способности сыворотки крови выявил ее достоверное повышение в группах больных относительно здоровых женщин (табл.1).
Таблица 1. Показатели феррокинетики у женщин репродуктивного возраста с лейомиомой матки, аденомиозом и гиперплазией эндометрия, осложненные кровотечением
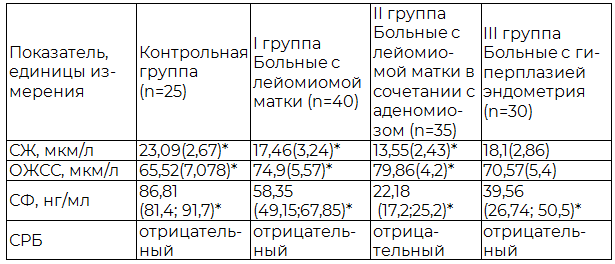
Примечание: * - различия достоверны по сравнению с контрольной группой, между I,II и III группой (p<0,001).
Накопленные в настоящее время данные по изучению показателей феррокинетики при железодефицитных состояниях, обусловленных кровотечением указывают на то, что именно ферритин является одним из основных регулятором гомеостаза железа в организме, а снижение его уровня в сыворотке крови является одним из патогенетических механизмов формирования анемии [3].
Таким образом, определение уровня сывороточного ферритина в клинической практике позволяет улучшить диагностику нарушений метаболизма железа. Однако при интерпретации результатов необходимо учитывать ряда факторов, влияющих на уровень ферритина (поражения печени, хронические воспалительные процессы), так как ферритин обладает свойствами белка острой фазы воспаления.
На сегодняшний день для объективной оценки феррокинетики наряду с ферритином, для раннего выявления дефицита железа в организме появился альтернативный лабораторный тест – определение концентрации растворимого рецептора трансферрина.
Анализируя показатели растворимого трансферринового рецептора у женщин с уровнем гемоглобина от 111 г/л до 125 г/л и группой женщин, где уровень гемоглобина составил от 80 г/л до 110 г/л, нами было установлено, что у 69,3% пациенток репродуктивного возраста первой группы, на фоне умеренно измененных биохимических показателях обмена железа (СФ), уровень рТфР достоверно увеличен по сравнению со здоровыми женщина. А в группе с уровнем гемоглобина от 80 г/л до 110 г/л у всех женщин концентрация трансферринового рецептора была значительно повышена (табл. 2).
Таблица 2. Показатели растворимого трансферринового рецептора и феррокинетики у женщин репродуктивного возраста с лейомиомой матки, аденомиозом и гиперплазией эндометрия, осложненные кровотечением
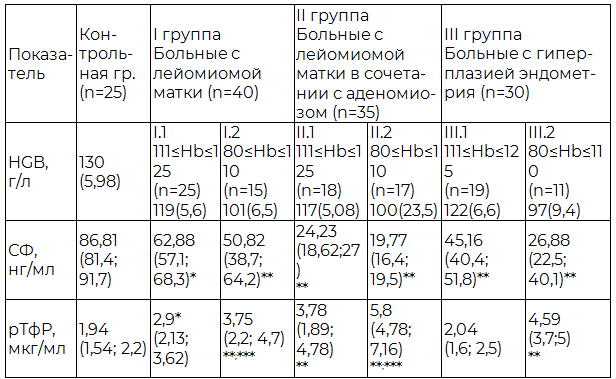
Примечание: * - различия достоверны по сравнению с контрольной группой (p≤0,05); **-различия достоверны по сравнению с контрольной группой (p≤0,01); ***-различия достоверны между I.2 и II.2 подгруппой (p≤0,01).
Сопоставляя значения концентраций ферритина и растворимого рецептора трансферрина при железодефицитной анемии у женщин репродуктивного возраста с лейомиомой матки, аденомиозом и гиперплазией эндометрия, нами было отмечено, что уровни растворимого рецептора трансферрина и ферритина изменяются разнонапрвленно: рТфР повышается, в то время как содержание ферритина снижается. Подобные разнонаправленные изменения концентрации в сыворотке крови ферритина и растворимого трансферринового рецептора объясняются генетической регуляцией метаболизма железа и способностью железорегуляторных белков по-разному реагировать с пулами рибонуклеиновой кислоты (РНК) ферритина и рТфР. Таким образом, происходит опосредованное ингибирование синтеза ферритина, и одновременная активация синтеза рТфР.
Учитывая современное состояние проблемы, можно предположить, что определение содержания растворимого трансферринового рецептора является важным показателем оценки метаболизма железа, особенно латентных его стадий.
В своей работа мы попытались выявить патогенетическое значение гепсидина как отрицательного регулятора метаболизма железа, при формировании железодефицитной анемии. Для этого все обследуемые нами женщины были разделены на две группы. В первую группу вошли женщины с уровнем гемоглобина от 111 г/л до 125 г/л; вторую группу составили пациентки с концентрацией гемоглобина от 80 г/л до 110 г/л (табл. 3).
Таблица 3. Показатели гепсидина и феррокинетики у женщин репродуктивного возраста с лейомиомой матки, аденомиозом и гиперплазией эндометрия осложненные кровотечением
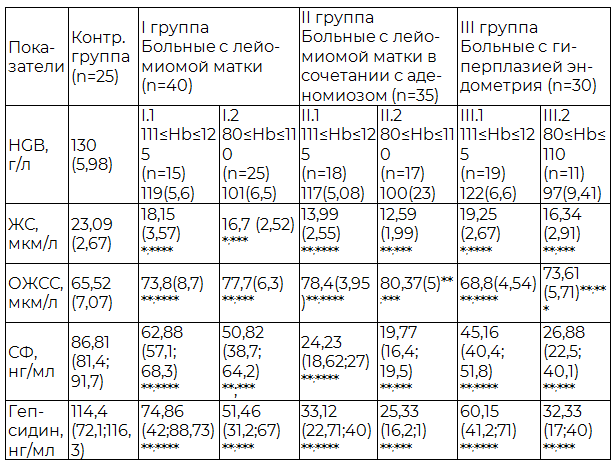
Примечание: * - различия достоверны по сравнению с контрольной группой (p≤0,05); **-различия достоверны по сравнению с контрольной группой (p≤0,01); ***-различия достоверны между I.2, II.2 и III.2 подгруппой (p≤0,01);**** - различия достоверны между I.1, II.1 и III.1 подгруппой (p≤0,01).
Уровень гепсидина меняется в зависимости от содержания ферритина, гемоглобина и сывороточного железа. Обнаружено снижение концентрации гепсидина у больных с лейомиомой матки, при сочетанной патологии и гиперпластическим процессом эндометрия во всех группах и свое минимальное значение данный показатель имеет в подгруппе пациентов II.2 (25,33 нг/мл) при уровне ферритина 19,77 нг/мл и сывороточного железа 12,59 мкм/л; и подгруппе III.2 (32,33 нг/мл и 26,88 нг/мл, 16,34 мкм/л соответственно).
У данной категории больных на фоне дефицита железа наблюдается снижение концентрации гепсидина, что вполне объяснимо с точки зрения его роли в метаболизме железа и стремлении организма восполнить запасы железа для обеспечения нормального процесса гемоглобинобразования.
Выводы
1. У женщин репродуктивного возраста с лейомиомой матки, аденомиозом и гиперплазией эндометрия кровотечение являются ведущими этиопатогенетическими факторами развития анемического синдрома.
2. Исследование показателей гемограммы для диагностики железодефицитной анемии, и особенно ее латентной стадии, является не достаточным и не дает полного представления о патогенетических механизмах формирования железодефицита у данной категории больных.
3. Определение содержания сывороточного железа и ферритина, а также общей железосвязывающей способность сыворотки крови, отражающих содержание железа в циркуляции и его депонированных формах является необходимым этапом для полноценной диагностики железодефицитных состояний. Снижение содержания сывороточного ферритина является одним из основных патогенетических механизмов формирования анемического синдрома у женщин репродуктивного возраста с различной патологией матки, осложненной кровотечением.
4. Определение концентрации растворимого трансферринового рецептора в сыворотке крови позволяет выявить латентную стадию дефицита железа.
5. Снижение содержания гепсидина в сыворотке крови у обследованных больных является проявлением защитной реакции организма направленной на усиление процесса всасывания железа в кишечнике и тем самым нивелировании развивающегося дефицита железа.
