Введение. Как известно, важное значение в генезе доброкачественных гиперпластических процессов молочных желез (ДГПМЖ) имеют нарушения циркадианных ритмов гонадотропных и стероидных гормонов [2,5-7,9,10]. Аналогичные гормональные нарушения выявлены у больных с синдромом поликистозных яичников (СПКЯ) [1-3,6-7].
Морфологические исследования [6,10] указывают, что при дисгормональных гиперплазиях в молочных железах происходят сложные патологические процессы, которые проявляются в расширении протоков, гиперплазии долек, фиброзировании стромы, метаплазии эпителия протоков, лимфатической инфильтрации, образовании кист. Однако, состояние молочных желез у больных СПКЯ представлено единичными работами [1-3].
При обследовании пациенток с ДГПМЖ нередко выявляются такие состояния, как гипотиреоз, гиперинсулинемия, ожирение, патология желудочно-кишечного и гепатобилиарного комплексов (ГБК) [2,3,6,7-10]. Соматический статус больных СПКЯ, как правило, отягощен подобными заболеваниями [1-3,5,7,10]. Ряд исследователей [3,4,6,8] показали, что при гиперпластических процессах эндометрия (ГПЭ) ДГПМЖ выявлены в 59,4% случаев. Это, несомненно, представляет теоретический и практический интерес при определении критериев диагностики и лечения ГПЭ у больных СПКЯ. В литературе отсутствуют данные о значимости в генезе параллельных структурных изменений молочных желез, нарушений гормонального гомеостаза и ГПЭ у больных СПКЯ.
Материалы и методы. В связи с этим под нашим наблюдением находилось 120 больных СПКЯ в возрасте от 22 до 37 лет (средний возраст 31,9±1,4 года) с длительностью бесплодия от 1 года до 12 лет (в среднем 5,3±1,2 года). У 61 (50,8%) больных была олигоменорея (задержка менструаций от 45 до 120 дней), у 30 (25%) – аменорея, у 12 (10%) – дисфункциональные маточные кровотечения (ДМК), у 17 (14,2%) – регулярные менструации через 28-30 дней.
Для объективной оценки состояния молочных желез проводилось комплексное обследование, включающее пальпаторное исследование молочных желез, маммографию, ультразвуковое исследование (УЗИ) молочных желез, лапароскопию и гистероскопию с последующим гистологическим исследованием биоптатов эндометрия.
Всем больным проводили тесты функциональной диагностики (ТФД), в периферической крови хемолюминисцентным методом определяли концентрацию фолликулостимулирующего гормона (ФСГ), лютеинизирующего гормона (ЛГ), пролактина (ПРЛ), тестостерона (Т), дегидроэпиандростерон-сульфата (ДГЭА-С), эстрадиола (Е2), прогестерона (П), 17-α-оксипрогестерона (17 α-ОП), инсулина (И), глобулина, связывающего половые стероиды (ГСПС), вычисляли индексы свободных андрогенов (ИСА) и свободных эстрогенов (ИСЭ).
Контрольную группу составили 20 здоровых женщин репродуктивного возраста.
На основании данных клинического, гормонального и ультразвукового исследований, а также результатов применения функциональных тестов (с дексаметазоном, адренокортикотропным гормоном - АКТГ и хориогонином) у больных выявлена яичниковая форма СПКЯ.
Результаты и обсуждение. У 120 больных были жалобы на нарушение репродуктивной функции (у 87,5% - на первичное, у 12,5% - вторичное бесплодие), у 93 (77,5%) – на нагрубание и боли в молочных железах, наиболее часто локализовавшиеся в верхне-наружных квадрантах, иррадиирующие в подмышечную область, лопатку, плечо.
Клиническое обследование молочных желез показало IV-V степени развития по Таннеру. Галакторея (+) отмечалась у 27 (22,5%) больных СПКЯ. У 46 (38,3%) больных индекс массы тела (ИМТ) составил в среднем 29,7±0,6 (норма – 23,1±0,1, р<0,05).
Молочные железы при пальпации представлялись негомогенными, с наличием уплотнений, часто болезненных. Подмышечные лимфоузлы ни в одном случае не определялись.
По ТФД у 83 (69,2%) больных обнаружена ановуляция, у 15 (12,5%) – недостаточность лютеиновой фазы (НЛФ), у 10 (8,3%) – чередование овуляторных циклов с НЛФ (1-3 цикла в год).
Данные, полученные при маммографическом обследовании больных СПКЯ в зависимости от характера нарушения менструальной функции, представлены в табл. 1.
Таблица 1. Результаты рентгенологического исследования молочных желез у больных синдромом поликистозных яичников в зависимости от характеристики менструальной функции
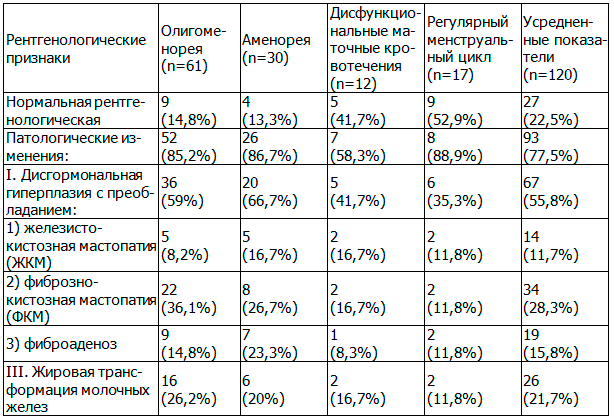
Из табл. 1 следует, что ДГПМЖ у больных СПКЯ возникают в 55,8% случаях, которые в 28,3% случаев представлены ФКМ, в 11,7% - ЖКМ, в 15,8% – фиброаденозом. Почти в одинаковом проценте случаев (85,2%; 86,7%; 88,9% соответственно) патологические изменения представлены у больных с олигоменореей, аменореей, регулярным менструальным циклом. Большой процент (59% и 66,7% соответственно) ДГПМЖ выявлен у больных с олигоменореей и аменореей по сравнению с больными с регулярным менструальным циклом (35,3%).
Рентгенологическая картина ФКМ характеризовалась грубым, крупно-петлистым рисунком стромы, наружный контур железистого треугольника представлялся фестончатым за счет фиброзирования связок Купера. На этом фоне определялись множественные округло-овальные просветления различных размеров, четко очерченные кисты. При заполненных кистах рентгенологически определялись плотные гомогенные тени с хорошо прослеживаемыми контурами, представляющие собой жидкостные кистозные полости. Нередко выявлялись многокамерные кисты с полициклическими очертаниями. Изменения чаще носили диффузный характер, реже имели вид узловатых образований. H. Vorher [10] объясняет механизм образования кист развитием внутрипротоковой и внутриальвеолярной соединительной ткани.
При УЗИ ФКМ отличалась значительной неоднородностью: участки железистой ткани с многочисленными тяжистыми структурами высокой эхогенности чередовались с жировыми инфильтратами в виде зон низкой эхогенности неправильной формы, без четких границ.
При фиброзной мастопатии на рентгенограммах дифференцировались хаотично либо пластообразно расположенные плотные гомогенные участки, отмечалась выраженная тяжистость, рисунок стремы был деформирован, в некоторых случаях подчеркнут. Иногда эти изменения локализовались преимущественно в преареолярной области и имели большую интенсивность затемнения на рентгенограммах, напоминающую вид матового стекла. Морфологически при фиброзной гиперплазии превалируют процессы, характеризующиеся внутрипротоковой пролиферацией, в результате которой происходит расширение протока и сужение его просвета, вплоть до полной облитерации.
Аденозы рентгенологически проявлялись в многочисленных мелкоочаговых уплотнениях, рассеянных в обеих железах, распределение которых соответствовало долькам или сегментам. Эти изменения локализовались в участках сохранившейся железистой ткани и особенно хорошо дифференцировались на фоне жировой ткани. При выраженном аденозе мелкоочаговые тени сливались, образуя плотные, довольно гомогенные конгломераты вследствие преобладания гиперплазии ацинусов и фиброза стромы. Морфологически аденоз представляет собой неосумкованную гиперплазию долек железистой ткани, пролиферацию миоэпителиальных клеток и соединительной ткани, протоки неравномерно расширены [2,10].
Гиперплазия железистой ткани часто сопровождалась выраженной пролиферацией соединительной ткани, обусловливающей наличие плотной фиброзной тяжистости. В наших наблюдениях гиперплазия железистой ткани носила преимущественно диффузный характер. Эхо-структура железистой ткани при аденозе характеризовалась однородностью. При этом толщина железистой ткани была значительно больше, чем у здоровых женщин данной возрастной группы.
7 женщинам ранее была произведена секторальная резекция по поводу фиброаденом молочных желез. Фиброаденомы молочной железы рентгенологически представляли собой образования округлой формы с фестончатыми, четко очерченными контурами, окруженными ободком просветления, обусловленным жировой тканью, что дает возможность четко визуализировать их на окружающем фоне. Морфологическим субстратом фиброаденомы является гиперплазированная железистая долька. На эхограмме фиброаденома выявлялась в виде образования пониженной однородной эхогенности (по сравнению с железистой тканью) правильной формы, с четкими и ровными контурами: задняя стенка образования была выражена значительно отчетливее, чем передняя и боковая.
У 2 (1,7 %) больных были выявлены солитарные кисты, которые визуализировались на рентгенограммах в виде теней овальной формы, четко очерченных, гомогенной плотности. Перифокального отека, изменений кожи и подкожной жировой клетчатки в зоне кисты не отмечалось. В обоих случаях солитарные кисты располагались на фоне ФКМ. Солитарные кисты визуализировались обычно на фоне измененной эхоструктуры молочной железы и представляли собой эхонегативные образования различных размеров, чаще округлой формы с четкими и ровными контурами, с резко выраженным акустическим эффектом дорсального усиления ультразвука и латеральной тенью.
Эхограмма нормальной молочной железы характеризовалась однородностью строения, хорошо визуализировались слои молочной железы. При этом выраженность подкожной жировой ткани и ретромаммарной клетчатки варьировала в зависимости от конституциональных особенностей обследуемых больных, фиброзная ткань имела вид тяжей.
Жировая трансформация молочных желез (ЖТМЖ) рентгенологически и морфологически проявляется плотной тяжистостью, либо плотными напластованиями, в основном в передних отделах желез. Основная часть органа представлена прозрачной для рентгеновских лучей жировой тканью. Морфологически при этой форме перестройки преобладают генерализованная дистрофия, разрастание соединительнотканного компонента. В результате происходит, с одной стороны, неравномерное расширение протоков, а с другой — сужение их просвета вплоть до полной облитерации. Наряду с этим в основном массиве железы отмечаются инволютивные процессы, в результате которых возрастает объем жировой ткани и уменьшается количество структурных элементов.
Данные, полученные при маммографическом обследовании больных СПКЯ в зависимости от характеристики менструального цикла, представлены в табл. 2.
Таблица 2. Результаты рентгенологического исследования молочных желез у больных синдромом поликистозных яичников в зависимости от характеристики менструального цикла
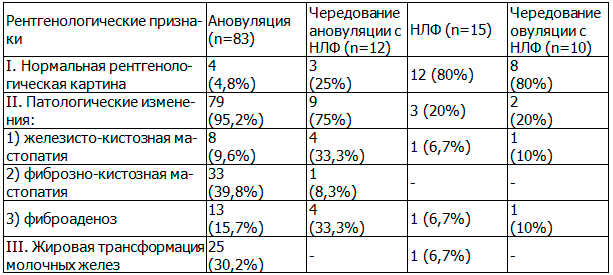
Из табл. 2 следует, что ДГПМЖ возникают у больных СПКЯ как с ановуляцией, так и на фоне чередования овуляции с НЛФ. Однако, ДГПМЖ в 4,8 раза чаще отмечались у больных с ановуляцией (95,2%) по сравнению с больными НЛФ (20%) и чередовании овуляции с НЛФ (20%). При ановуляции ФКМ была у 9,6%, ЖКМ – у 39,8%, фиброаденоз – у 16,9%, ЖТМЖ – у 30,2% больных. Согласно литературным данным [4-8], у пациенток с ановуляцией и ДМК имеют место длительные эстрогенные влияния, стимулирующие пролиферативные процессы в органах-мишенях.
Данные гормонального исследования в зависимости от маммографической диагностики заболеваний молочных желез у больных СПКЯ представлены в табл. 3.
Таблица 3. Концентрация пептидных и стероидных гормонов в зависимости от рентгеномаммографической диагностики заболеваний молочных желез у больных синдромом поликистозных яичников
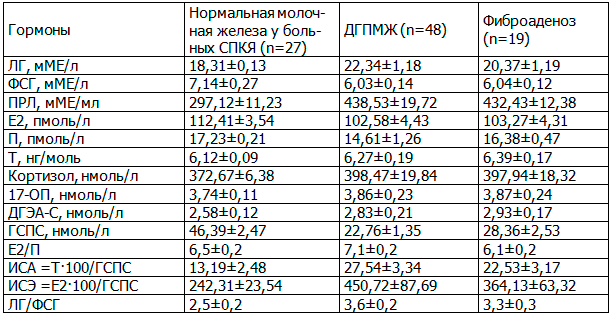
Таблица 4. Концентрация пептидных и стероидных гормонов в зависимости от рентгеномаммографической диагностики заболеваний молочных желез у больных синдромом поликистозных яичников
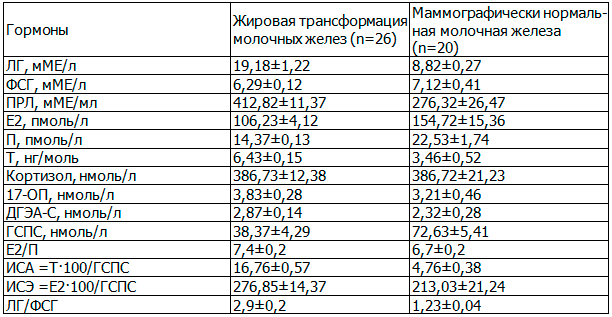
Из табл. 3 и 4 следует, что гормональные исследования позволили выявить у больных с ДГПМЖ, фиброаденозом, ЖТМЖ низкие концентрации ФСГ, Е2, П, ГСПС, высокие концентрации ЛГ, ПРЛ, Т, ДГЭА-С, ИСА, ИСЭ, нормальные концентрации кортизола, 17-ОП в крови, что свидетельствует о выраженных нарушениях регуляции гипоталамо-гипофизарно-яичниково-надпочечниковой системы по типу десинхронизации [3-6]. У больных с СПКЯ с рентгеномаммографичечки нормальной молочной железой концентрации ФСГ, ПРЛ, ДГЭА-С, ИСЭ в крови соответствовали нормативным данным.
Экспериментальные и клинические исследования показали, что Е2 стимулирует пролиферацию эпителия молочных желез [5,6,9]. Эстрогены осуществляют митогенный эффект, активируя протеины, вовлеченные в контроль клеточного цикла, и стимулируя экспрессию генов, необходимых для клеточного деления (протоонкогена с-mys). Наибольшая пролиферативная активность эпителия млечных протоков у человека наблюдалась в течение лютеиновой фазы, при которой наблюдается максимальная интенсивность синтеза ДНК, митозов у здоровых женщин [5,6]. Однако, П не влияет или снижает интенсивность пролиферации млечного эпителия. Эффект П на клеточный цикл определяется длительностью и дозой воздействия [5]. Таким образом, в патогенезе ДГПМЖ лежит механизм, заключающийся в недостаточном влиянии на ткани молочных желез П и избыточном воздействии Е2, обладающего митотическим эффектом на эпителий, стимулирующим влиянием на строму и кровоснабжение органа, способствующий дуктэктазии и формированию кист.
Соотношение гистологического состояния эндометрия и рентгеномаммографической диагностики заболеваний молочных желез у больных СПКЯ представлено в табл. 5.
Таблица 5. Соотношение гистологического состояния эндометрия и рентгеномаммографической диагностики заболеваний молочных желез у больных синдромом поликистозных яичников
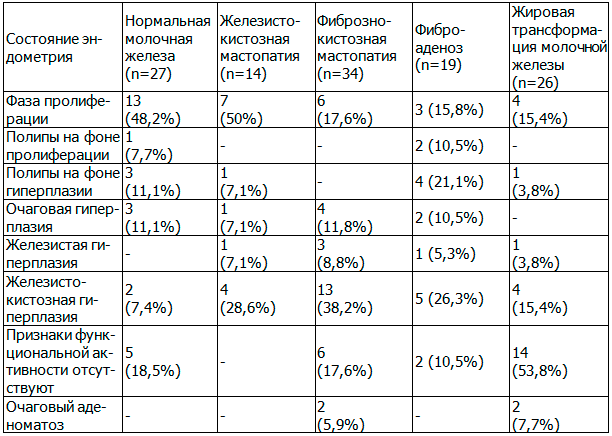
Из табл. 5 следует, что у больных СПКЯ с нормальной маммографической картиной характерны фаза пролиферации (48,2%) и отсутствие функциональной активности эндометрия (18,5%), для ФКМ – фаза пролиферации (50%) и железисто-кистозная гиперплазия эндометрия (28,4%), для ЖКМ – железисто-кистозная гиперплазия эндометрия (38,2%) и отсутствие функциональной активности эндометрия (17,6%), для фиброаденоза – полипы при гиперплазии (21,1%), железисто-кистозная гиперплазия эндометрия (26,3%), для ЖТМЖ – отсутствие функциональной активности эндометрия (53,8%) и железисто-кистозная гиперплазия эндометрия (15,4%). Проведенные исследования показали, что при ГПЭ у 100% больных СПКЯ наблюдается вовлечение в патологический процесс молочных желез.
Полипы эндометрия у больных, возможно, обусловлены тем, что в анамнезе подобных больных, как правило, отмечены хронические воспалительные процессы различной локализации. Возможно, эти процессы изменяют общую сенсибилизацию организма к собственным гормонам, вследствие чего в чувствительных к ним тканях происходит активация пролиферативных процессов [4,8].
В литературе имеются данные о роли гиперпролактинемии в генезе ДГПМЖ [2,6,9]. В эпителии молочной железы человека возможен локальный синтез ПРЛ, что делает возможным его ауто- или паракринное воздействие на клетки молочной железы [6,9]. ПРЛ способен воздействовать на процессы пролиферации, дифференцировки, а также способствовать «подвижности» клетки в ходе маммогенеза, ускорению прохождения клеткой клеточного цикла [6]. ПРЛ замедляет процесс программированной клеточной гибели, модулирует васкуляризацию в молочной железе, стимулирует в ней рост капилляров [6,9]. Функциональная гиперпролактинемия (521,63±38,56 мМЕ/мл) выявлена у 75 (62,5%) больных, из них галакторея (+) – у 27 (22,5%). У всех этих женщин отмечено снижение уровня Е2 (103,73±11,34 пмоль/л) и П (16,21±1,24 пмоль/л). У 49 (65,3%) из 75 больных с гиперпролактинемией на мамограммах выявлены ДГПМЖ: у 23 (30,7%) – ФКМ, у 12 (16%) – ЖКМ, у 14 (18,7%) – фиброаденоз, у 19 (25,3%) – ЖТМЖ.
При нормальном уровне ПРЛ (283,24±21,43 мМЕ/мл) ДГПМЖ выявлены у 17 (37,8%) из 45 больных: у 11 (24,4%) – ФКМ, у 2 (4,4%) – ЖКМ, у 5 (11,1%) – фиброаденоз, у 7 (15,6%) – ЖТМЖ. Обращает на себя внимание то, что, несмотря на нормальное содержание ПРЛ в крови, в 11 (24,4%) случаях выявлено отделяемое из сосков по типу молозива, в том числе и у больных с ЖТМЖ.
Полученные данные показывают, что при функциональной гиперпролактинемии ДГПМЖ у больных СПКЯ встречались в 1,7 раза чаще по сравнению с больными с нормопролактинемией (65,3% и 37,8% соответственно), галакторея выявлена в одинаковом проценте случаев у больных как с гипер-, так и нормопролактинемией (22,5% и 24,4% соответственно).
У 39 (32,5%) больных была выявлена патология ГБК, на изменение которого в развитии ДГПМЖ указывали ряд авторов [6,10]. У 30 (76,9%) из 39 больных с патологией ГБК выявлены ДГПМЖ: у 15 – ФКМ, у 8 – ЖКМ, у 7 – фиброаденоз. У 9 больных с сопутствующей патологией ГБК и ИМТ более 26 отмечена ЖТМЖ.
Ряд исследователей [4,6,7,9] считают, что в генезе неопластических изменений органов-мишеней являются высокий ИМТ, гипертензия и гиперинсулинемия. У 43 (35,8%) больных с ожирением (ИМТ более 26), транзиторной гипертензией и гиперинсулинемией (концентрация И в крови 12,21±1,31 мкЕД/мл, норма – 6,72±1,24 мкЕД/мл) ДГПМЖ выявлены в 31 (72,1%) случае: в 17 – ФКМ, в 6 – ЖКМ, в 8 – фиброаденоз. Вместе с тем в 12 (27,9%) случаях выявлена ЖТМЖ.
Проведенные исследования показали, что у 67 (55,8%) больных СПКЯ выявлены ДГПМЖ, у 59 (49,2%) – ГПЭ, которые в 100% случаев сочетаются с ДГПМЖ. При этом к основным факторам патогенеза сочетанного поражения молочных желез и эндометрия могут быть отнесены ановуляция, гиперпролактинемия, нарушения соотношения Е2/П, снижение концентрации ГСПС, повышение ИСЭ, заболевания ГБК, ожирение, гипертензия и гиперинсулинемия.
Не совсем ясным остается факт выявления ЖТМЖ у больных репродуктивного возраста. Это состояние ранее не рассматривалось как патологическое, что было обусловлено снижением риска злокачественной трансформации желез при подобных изменениях их структуры. У женщин в перименопаузе такое состояние объясняется возрастными перестройками, приводящими к угасанию функции желез. В случаях ановуляции у женщин репродуктивного возраста, возможно, происходят аналогичные процессы.
Не исключено, что при ЖТМЖ имеет место врожденное или приобретенное изменение чувствительности рецепторного аппарата молочных желез при сохранении его активности в эндометрии. С другой стороны, более частое выявление ЖТМЖ при патологии ГБК и ожирении позволяет предположить определенную роль в развитии этого процесса нарушенного обмена стероидов и других биологически активных веществ.
Таким образом, результаты исследования показывают необходимость обязательного обследования молочных желез у больных СПКЯ. На наш взгляд, к группе риска ГПЭ следует относить женщин, имеющих наряду с ожирением, гипертензией и гипергликемией ЖТМЖ, а также ФКМ. Вместе с тем полученные данные позволяют ввести определенную коррекцию в существующую схему лечебных мероприятий у больных СПКЯ, в том числе при выборе гормональных препаратов для индукции овуляции.
