Несмотря на большое число исследований, посвященных различным аспектам эндометриоза (ЭМ), до сих пор остаются невыясненными многие вопросы этиологии и патогенеза этого заболевания, взаимосвязи тяжести его течения со сдвигами метаболического, оксидативного, цитокинового статусов организма, отсутствуют данные о сравнительной информативности методов ранней диагностики патологии.
В настоящее время не вызывает сомнения тот факт, что обязательным компонентом патогенеза большинства патологических процессов различной этиологии и локализации являются повреждение и изменение свойств сосудистой стенки в результате первичного воздействия повреждающих факторов, а также при реализации вторичных эффектов биологически активных веществ, медиаторов клеточного и плазменного происхождения [7, 16].
Нарушения структуры и функций сосудов в условиях патологии проявляются развитием синдрома эндотелиальной дисфункции (ЭД) [7].
Как известно, основой ЭД является дисбаланс между продукцией вазодилатирующих, вазоконстрикторных, ангиопротективных, протромботических, антипролиферативных и пролиферативных факторов (NO, простациклин, тканевой активатор плазминогена, натрийуретические пептиды, эндотелин, тромбоксан А2, ингибитор тканевого активатора плазминогена и др.) [6].
Состояние эндотелия при патологических процессах на локальном и системном уровнях во многом опосредуется цитокинами, в частности, IL-1, IL-6, ТNF-α и др. [16].
Изменения цитокинового статуса способствуют активации, а в ряде случаев повреждению эндотелия, экспрессии факторов, влияющих на процессы гемостаза и фибринолиза, адгезии и агрегации форменных элементов крови, изменениям интенсивности неоангиогенеза и др. [6,7].
В свою очередь, сложные взаимодействия поврежденного эндотелия сосудов, клеток крови, элементов макрофагальной системы различных тканей организма, в целостном организме приводят к усилению продукции цитокинов [9].
Таким образом, ЭД является важнейшей предпосылкой для возникновения порочного круга, способствующего прогрессированию реакций повреждения в условиях патологического процесса.
В связи с этим целью работы явилось изучение патогенетической взаимосвязи нарушений цитокинового статуса и развития признаков ЭД при различных клинических формах генитального ЭМ.
Материалы и методы
Для решения поставленной задачи проведено одномоментное, пассивное, проспективное неконтролируемое исследование. Обследованы две группы больных: в первую группу вошли 24 пациентки с ЭМ первой стадии, во вторую - 31 пациентка с ЭМ второй стадии развития в возрасте от 18 до 45 лет. Критериями включения в исследования были результаты клинического, лабораторно-инструментального и ультразвукового обследования, характерные для ЭМ указанных стадий развития. Критериями исключения были беременность, эндокринные заболевания, злокачественные новообразования, легочная и сердечная недостаточности у пациенток. Группу сравнения составили 31 практически здоровых небеременных женщин, сопоставимых по возрасту с основными группами исследования.
Исследования пациенток проведены на базе гинекологических отделений ГУЗ «Областная клиническая больница» г. Саратова.
Оценка показателей содержания цитокинов, уровней маркеров ЭД в периферической крови больных женщин была проведена в момент поступления их в стационар до начала лечения на фоне выраженных клинических проявлений патологии.
Цитокиновый статус оценивали по содержанию IL-1β, IL-6, IL-10 и TNF-α в сыворотке периферической крови пациенток методом иммуноферментного анализа с использованием тест-систем фирмы Bender Medsystems (Австрия). Содержание простациклина, фактора Виллебранда (vWF) в сыворотке крови определяли иммуноферментным методом с использованием тест-систем фирмы Bender Medsystems (Австрия). [15,17].
Статистическая обработка результатов исследований была проведена с использованием пакета Statistica 6. Нормальность распределения вариационных рядов (соответствие закону Гаусса) проверяли с помощью критериев согласия Колмогорова-Смирнова и Шапиро-Вилкса. В качестве точечной оценки характеристики центра группирования значений случайной величины использовали медиану с вычислением 95% доверительного интервала, интерквартильные размахи (25-й и 75-й процентили). Сравнение двух независимых (несвязанных) групп осуществлялось с помощью непараметрического U-критерия Манна-Уитни для анализа малых выборок, позволяющего проверить гипотезу о равенстве средних рангов, а также двухвыборочного критерия Колмогорова-Смирнова для проверки гипотезы о принадлежности исследуемых групп к одной и той же генеральной совокупности. Если р<0,05, то нулевая гипотеза об отсутствии различий групп отклонялась и принималась альтернативная гипотеза о существовании различий групп с уровнем статистической значимости «р» [13].
Результаты и их обсуждение
Как показали результаты исследований, в период выраженных клинических проявлений патологии возникает повышение уровней IL-1β, IL-6, IL-10 и TNF-α в сыворотке периферической крови пациенток с первой стадией распространенности эндометриоидного процесса по отношению к соответствующим показателям цитокинового статуса группы сравнения (табл. 1).
Таблица 1. Изменения показателей цитокинового статуса у больных с различными стадиями эндометриоза
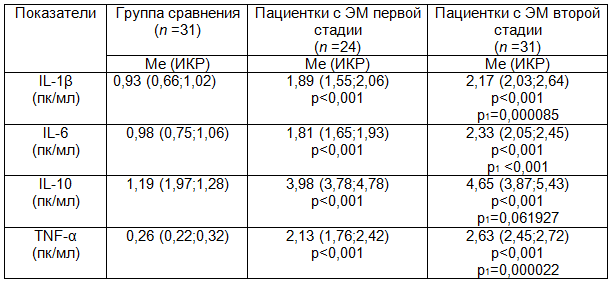
Примечания: здесь и далее р - по отношению к группе сравнения; р1 - по отношению к группе пациенток с первой стадией ЭМ.
Исследование нами уровней ТNF-α и IL-1β при ЭМ основано на свидетельствах литературы о том, что при различных патологических процессах инфекционного и неинфекционного происхождения ТNF-α и IL-1β способны изменять функциональное состояние эндотелия, активировать процессы свёртывания крови, стимулировать экспрессию тканевого и других факторов на эндотелии и моноцитах [1, 2, 14].
Как свидетельствуют данные литературы, IL-1β способен вызывать экзоцитоз лизосомальных ферментов и свободных кислородных радикалов фагоцитами. В качестве флогогена IL-1β вызывает дегрануляцию тучных клеток с высвобождением биологически активных веществ, влияет на активность эндотелиоцитов, стимулирует продукцию простациклина, участвует в регуляции системных иммунных реакций [12].
В состав мембран эндотелиальных клеток входят субъединицы, способные объединяться и формировать рецепторы для различных цитокинов. В частности, под влиянием медиаторов воспаления,
гормонов, бактериальных индукторов на поверхности эндотелия значительно возрастает экспрессия рецепторов к IL-1, через которые осуществляется регуляция тромбоцитарно-сосудистого и коагуляционного механизмов гемостаза, образование адгезивных молекул и др. [5, 8].
В ранний период развития острого воспаления возникает повреждение сосудистой стенки под влиянием провоспалительных цитокинов, в частности TNF-α. Важной особенностью эффектов TNF-α является усиление генерации активных форм кислорода и окиси азота цитотоксическими клетками, усиление экспрессии vWF, ингибиторов фибринолиза и др. [8, 10].
IL-6 является мультифункциональным цитокином, участвующим в развития типовых патологических процессов: воспаления, лихорадки, кахексии, лейкоцитоза, плазмоцитоза, гипергаммаглобулинемии, изменения продукции белковых маркеров острой фазы воспаления и др. При возбуждении высокоаффинных эндотелиальных рецепторов к IL-6 изменяется проницаемость эндотелия, усиливается экспрессия vWF и фактора роста эндотелия [9].
Как известно, механизмы продукции перечисленных цитокинов тесно взаимосвязаны между собой [11].
Таким образом, изученные нами цитокины оказывают прямые и опосредованные эффекты на структуру и функциональные свойства эндотелиальных клеток и играют важную роль в развитии ЭД. В связи с этим представлялось целесообразным сопоставить изменений цитокинового статуса при ЭМ различной степени с показателями, характеризующими состояние эндотелия, в частности - vWF и простациклина. Простациклин, обладающий свойствами вазодилататора и дезагреганта, является маркером ЭД, поскольку основным источником его синтеза является сосудистая стенка [16].
В работе установлено снижение уровня простациклина при ЭМ первой стадии по отношению к показателям группы здоровых женщин (табл. 2).
Таблица 2. Изменения маркеров эндотелиальной дисфункции у больных с различными стадиями эндометриоза
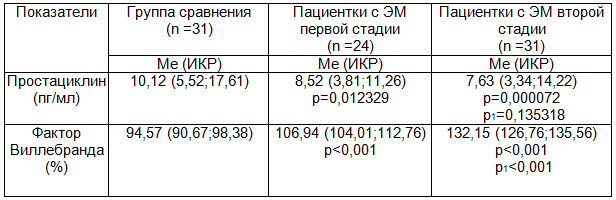
Известно, что vWF обнаруживается в эндотелии, субэндотелии, экстрацеллюлярном матриксе. Различные сосуды в разной степени обладают способностью усиливать продукцию vWF под влиянием патогенных факторов. Синтез и выделение vWF возрастает, в частности, под влиянием вазопрессина. Поскольку все стрессорные состояния сопровождаются увеличением продукции вазопрессина, то при стрессах, экстремальных состояниях тромбогенность сосудов возрастает, чему способствует повышение синтеза vWF [14].
Как оказалось, при ЭМ первой степени распространенности отмечалось увеличение уровня vWF по отношению к показателям группы сравнения, (табл. 2).
В последующих исследованиях представлялось целесообразным установить наличие зависимости тяжести кинических проявлений патологии и изменений содержания исследуемых цитокинов и маркеров ЭД в сыворотке крови больных.
Как известно, для второй стадии ЭМ свойственно распространение эндометриоидных элементов более чем на половину толщины миометрия [4]. Нарастает выраженность характерных для заболевания симптомов - тазовых болей, диспареунии, полименореи, дизурии, гематурии и других, которые существенно снижают качество жизни больных женщин [4].
Обращает внимание тот факт, что при увеличении тяжести клинических проявлений при ЭМ второй степени в наших исследованиях прогрессирующе нарастали уровни IL-1β, IL-6 и TNF-α не только по отношению показателей здоровых женщин, но и по сравнению с показателями группы пациенток с первой степенью ЭМ (табл. 1).
В то же время результаты наших исследований показали, что содержание противовоспалительного цитокина IL-10 в сыворотке крови пациенток второй группы оставалось высоким, однако не превышало показатели больных с первой стадией патологии (табл. 1).
Как известно, IL-10 относится к категории противовоспалительных цитокинов, подавляет функциональную активность макрофагов, Т-лимфоцитов, ингибирует продукцию провоспалительных цитокинов, секрецию иммуноглобулинов, уменьшает экспрессию антигенов главного комплекса гистосовместимости, продукцию IL-12 и интерферона [3].
При исследовании уровней маркеров ЭД обнаружено чрезмерное увеличение содержания простациклина и vWF как по отношению к соответствующим показателям группы сравнения, так и по сравнению с результатами исследований пациенток с первой стадией ЭМ (табл. 2).
Таким образом, по мере увеличения степени тяжести клинических проявлений эндометриоидного процесса происходило прогрессирование нарушений, свойственных ЭД.
Анализ полученных данных позволяет предположить наличие патогенетической взаимосвязи тяжести клинических проявлений патологии, повышения уровней провоспалительных цитокинов IL-1β, IL-6, TNF-α и развития признаков ЭД при различных клинических вариантах ЭМ.
Заключение
- Выявлена закономерность накопления IL-1β, IL-6, TNF-α и изменений уровней маркеров ЭД - простациклина и vWF при ЭМ различной степени распространенности.
- Сдвиги цитокинового статуса могут выступать связующим патогенетическим звеном между степенью тяжести эндометриоидного процесса и выраженностью ЭД на этапе выраженных клинических проявлений патологии.
- Определение содержания в сыворотке крови уровней IL-1β, IL-6, TNF-α и изменений содержания простациклина и vWF у больных с ЭМ может быть использовано в качестве дополнительных объективных диагностических критериев степени распространенности эндометриоидного процесса, что расширит возможности успешного выбора адекватной лечебной тактики.
