Введение. Актуальность исследования патогенеза функциональных кист яичников (ФКЯ) определяет высокая распространенность данной патологии среди женщин репродуктивного возраста (55,2% случаев), необходимость экстренной госпитализации и оперативного вмешательства при осложненном клиническом течении [1]. Рецидивирующее течение ФКЯ и низкая эффективность консервативного лечения могут становиться причиной инфертильности, а повреждения ткани яичника при оперативном лечении снижают овариальный резерв и негативно отражаются на результатах применения вспомогательных репродуктивных технологий у данных пациенток [2, 3]. Открытие роли факторов локальных внутрияичниковых механизмов паракринной регуляции в физиологическом течении фолликулогенеза и ангиогенеза позволяет более детально изучить цепочку регуляторных взаимодействий при различных патологиях [4, 5, 6, 7]. Изучение факторов паракринной регуляции взаимодействий между ооцитом и окружающими его клетками гранулезы позволит исследовать не только патогенез функциональных кист яичников, но и механизмы формирования сопутствующей овариальной недостаточности. Основными и наиболее изученными факторами взаимодействия в системе ово-соматического гистиона являются костный морфогенетический протеин (BMP) 15 [8, 9, 10], и коннексин (Cx) 37 [11].
Доказано, что фактор роста эндотелия сосудов (VEGF) является одним из важнейших факторов, обеспечивающих сосудистый рост в яичнике на этапах созревания и селекции фолликулов, а также фазах функционирования желтого тела [12].
Ангиогенез представляет собой сложный процесс взаимодействия стимулирующих и подавляющих сигналов, генерируемых множеством факторов микроокружения. VEGF стимулирует митогенную активность, подавляет апоптоз эндотелиоцитов, вызывает повышение сосудистой проницаемости. Кроме того, VEGF поддерживает транспорт энергетических субстратов в эндотелиоциты [13, 14, 15]. Интерес исследователей к изучению экспрессии данного фактора в патогенезе формирования ФКЯ обусловлен тем, что VEGF формирует стабильный кровоток в сосудах яичника, повышает проницаемость стенки микрососудов антрального фолликула с последующей аккумуляцией фолликулярной жидкости, ингибированием апоптоза [14, 15].
Цель исследования: изучить экспрессию BMP 15, Cx 37, VEGF при моделировании экспериментальных функциональных кист яичников.
Материал и методы. Экспериментальные животные – половозрелые самки крыс линии Wistar массой 180-220 г. I группа (основная, n=35) - моделирование функциональных кист яичников путем введения фолликулостимулирующего гормона. II группа (контроль, n=20) – интактные животные. Для формирования экспериментальных функциональных кист яичников экспериментальным животным вводился рекомбинантный ФСГ (рФСГ) 1,5 МЕ (производитель - «Индустрия Фармасьютика Сероно С.п.А.» Индустриальная зона Модугно, 1-70123 Бари, Италия) в течение 7 дней в первой половине дня внутримышечно в ягодичную область. Исследование одобрено Этическим комитетом ГБОУ ВПО СибГМУ Росздрава № 4356 от 30.11.2015.
Яичники экспериментальных животных фиксировали в 10% нейтральном формалине, заливали в парафин. Иммуногистохимическая методика исследования экспрессии BMP 15, Cx 37, VEGF включала в себя использование стрептавидин-биотиновой системы детекции Abcam®PLC (Великобритания) Rabbit Specific HRP/DAB (ABC) Detection IHC Kit. Для высокотемпературной демаскировки антигена. Результат определяли по коричневому окрашиванию цитоплазмы и мембраны. Полуколичественную оценку проводили по формуле H-score (1 х % слабо позитивных клеток) + (2 х % умеренно позитивных клеток) + (3 х % сильно позитивных клеток).
Методы статистики. Для статистической обработки и анализа результатов использовали программу IBM SPSS Statistics v.23.0 5. Для проверки формы распределения данных использовали разведочный анализ (критерий Шапиро-Уилка). Учитывая данные представленных выше критериев, проводилось исследование сравниваемых групп U-критерием Манна-Уитни (критический уровень значимости p=0,05).
Результаты. С применением методики иммуногистохимического анализа в яичниках дифференцированы маркёры взаимодействия ооцита и клеток гранулезы (BMP15, Cx37), а также фактор ангиогенеза VEGF. Экспрессия изучаемых факторов при моделировании ФКЯ оказывалась типичной. Для оценки степени экспрессии и её изменения у животных сравниваемых групп применялась методика H-score.
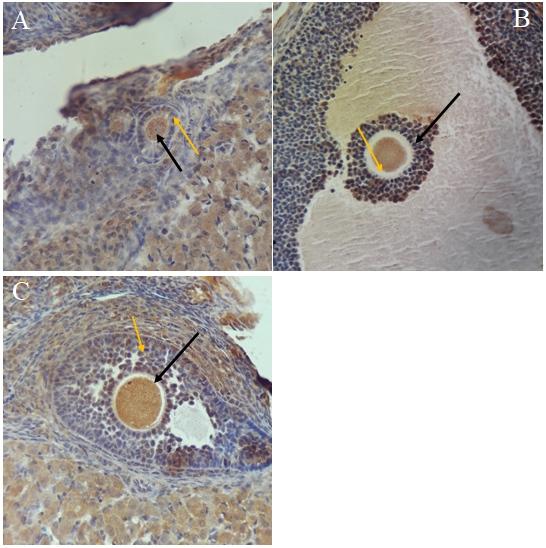
Рисунок 1. Экспрессия BMP 15 и Cx 37 на 7-е сутки эксперимента. Черная стрелка указывает на овоцит, желтая – на фолликулоцит. А - экспрессия BMP 15 в первичном фолликуле на 7 сутки моделирования ФКЯ; В - экспрессия BMP 15 в третичном фолликуле на 7 сутки моделирования ФКЯ; С - экспрессия Cx 37 во вторичном фолликуле на 7 сутки моделирования ФКЯ. Окраска DAB, докраска гематоксилином. Ув. Х 400.
Экспрессия BMP-15 выявлялась в овоцитах, фолликулоцитах яйценосного бугорка, тека-клетках, стромальных клетках коркового вещества, лютеоцитах желтого тела, поверхностных эпителиоцитах. В овоцитах примордиальных (ПФ) и первичных фолликулов (ПРФ), а также в овоцитах растущих фолликулов с начальными признаками атрезии, в которых половая клетка была сохранна, интенсивность экспрессии была наиболее выраженной, в овоцитах вторичных (ВРФ) и третичных фолликулов (ТРФ) – наименее выраженной. Фолликулярный эпителий окрашивался менее интенсивно, экспрессия усиливалась соответственно стадии развития фолликулов. На 7-е сутки введения ФСГ увеличивалась интенсивность иммуноокраски овоцитов всех типов фолликулов (рис. 1А, рис. 1В). В ранние сроки опыта (7-е сутки) в ПФ повышалась интенсивность окраски эпителиоцитов гранулёзы, во ВРФ и ТРФ изменений не обнаруживалось. К 15-м суткам опыта экспрессия BMP-15 снижалась во всех типах фолликулов, а к 30-м соответствовала таковой в контроле (рис. 2).
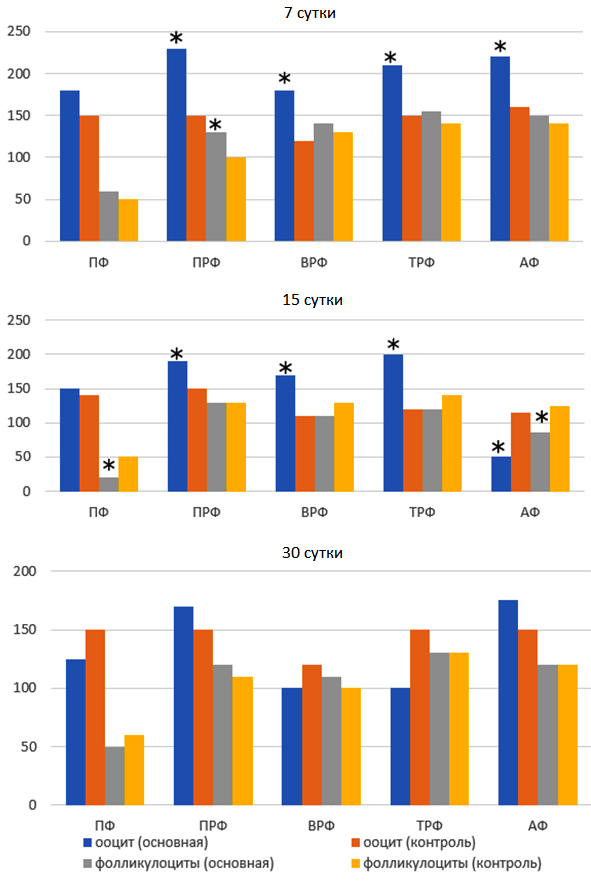
Рисунок 2. Экспрессия BMP 15 в ооцитах и фолликулярном эпителии различных типов фолликулов (H-score, M).
Примечание: ПФ – примордиальные фолликулы, ПРФ – первичные фолликулы, ВРФ – вторичные фолликулы, ТРФ – третичные и зрелые фолликулы, АФ – атретические фолликулы и тела, * – значимые отличия от контроля тестом Манна-Уитни (критическое p=0,05).
Экспрессия Cx 37 была выявлена в ооцитах, zona pellucida, висцеральных фолликулоцитах, клетках кумулюса, отдельных лютеоцитах и эндотелиоцитах сосудов яичников крыс. Ооциты окрашивались более интенсивно, чем фолликулоциты (рис. 1С). Динамика изменения интенсивности окраски овоцитов и фолликулоцитов соответствовала стадии развития фолликулов. Экспрессия Cx 37 усиливалась в конце преантральной стадии. Фолликулы антральной и преовуляторной стадии (ВРФ и ТРФ) окрашивались диффузно, что связано с неравномерной иммунолокализацией маркёра в фолликулоцитах, снижением экспрессии фактора в ооците.
При моделировании ФКЯ с помощью введения ФСГ отмечалась волнообразная динамика окрашивания ооцитов, аналогичная контролю, более выраженная в ооцитах ВРФ и ТРФ на 7-х сутках эксперимента (рис. 3). Фолликулярный эпителий ПРФ окрашивался слабее контроля. От 15-х до 30-х суток опыта экспрессия белка щелевого взаимодействия в ооцитах не отличалась от таковой в контроле, однако снижение иммунной окраски в фолликулоцитах отмечалось до 30-х суток эксперимента.
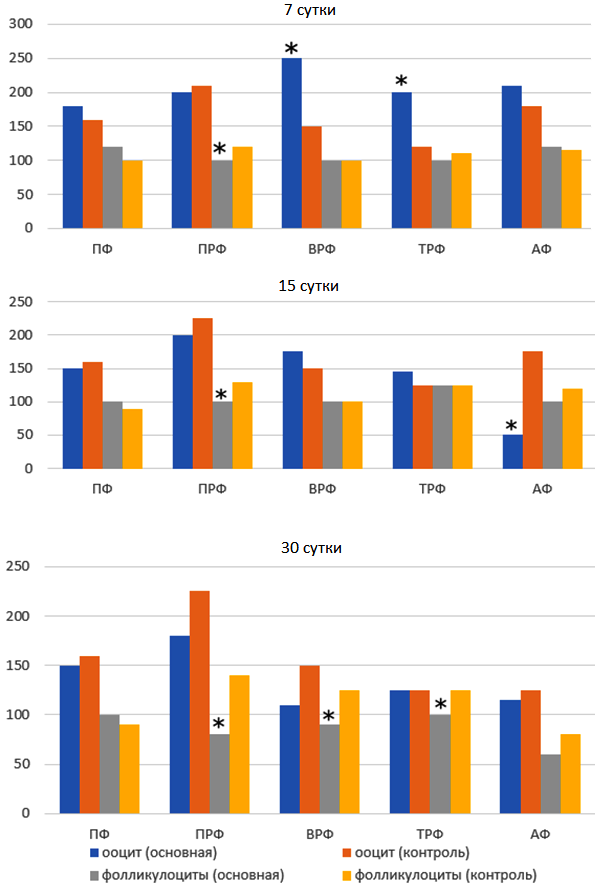
Рисунок 3. Экспрессия Cx 37 в ооцитах и фолликулярном эпителии различных типов фолликулов (H-score, M). Примечание: аналогично предыдущей диаграмме.
Экспрессия VEGF проявлялась в виде коричневого окрашивания мембраны и цитоплазмы фолликулоцитов и клеток эндотелия. Выявлена высокая частота положительной экспрессии VEGF в эндокриноцитах функциональных кист яичника. Иммунопозитивное окрашивание слабой и умеренной интенсивности наблюдалось на поверхности ооцитов (мембранное) и лютеоцитах желтого тела. На 7-е сутки моделирования ФКЯ экспрессия фактора была максимально выраженной в фолликулоцитах растущих фолликулов, с 15-х суток экспрессия VEGF не отличалась от контроля (таблица 1). Экспрессия маркера в эндотелиоцитах на 30-е сутки не отличалась от контроля.
Таблица 1. Экспрессия VEGF (H-score, Me; Q25-Q75)
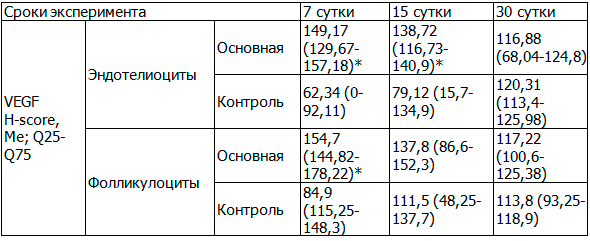
Примечание: 1 Ме – медиана; Q25 и Q75– 25- и 75 процентили, соответственно; *- выявлены различия в сравнении с контролем со значимостью р < 0,05.
Обсуждение и выводы. Исследование впервые установило изменения факторов паракринной регуляции ово-соматического взаимодействия и ангиогенеза при формировании экспериментальных функциональных кист яичников. При моделировании ФКЯ на 7-е сутки введения рФСГ выявлено повышение экспрессии BMP 15 в ооцитах во всех типах растущих фолликулов и Cx 37 в антральных фолликулах. К 15-м суткам опыта экспрессия BMP 15 наиболее выражена в ооцитах растущих фолликулов, появляется в примордиальных, снижается в фолликулах с признаками атрезии, в которых половая клетка была сохранна. В фолликулоцитах первичных фолликулов наблюдается снижение Cx 37, усиление экспрессии BMP 15. На 30-е сутки эксперимента высокая экспрессия BMP 15 сохраняется в ооцитах первичных фолликулов.
Роль BMP 15 заключается в росте и дифференцировке клеток гранулезы и теки на гонадотропин-независимой стадии фолликулогенеза [8]. Подтверждением является максимальная экспрессия данного фактора в преантральных фолликулах в проведённом исследовании, что согласуется с данными литературы [8]. ВМР-15 синтезируется овоцитом. Генеральная концепция последних лет заключается в том, что в регуляции преантральных стадий фолликулогенеза, включая многослойные фолликулы, главную роль играет сам овоцит. Овоцит человека экспрессирует большие количества регуляторных белков GDF-9 и BMP-15, которые способны стимулировать рост многослойных фолликулов в условиях in vitro и осуществлять защиту клеток фолликула от апоптоза. Считается, что указанные вещества, синтезируемые овоцитом, стимулируют митозы фолликулярных эпителиоцитов и пространственное оформление слоев фолликулярного эпителия в первичных многослойных фолликулах, при этом существует определенная динамика их синтеза в течение половых циклов. Усиление экспрессии BMP 15 предотвращает апоптоз клеток гранулёзы, что проявляется активацией фолликулярного роста, увеличением растущих фолликулов.
Важным событием в развитии первичных фолликулов, способствующим активации пролиферации и гипертрофии эпителиальных клеток, является начало экспрессии белков группы коннексинов и образование межклеточных щелевых контактов (GJ) между овоцитом и клетками фолликулярного эпителия [11]. Благодаря этим контактам осуществляется диффузия ионов, метаболитов и потенциальных сигнальных единиц (цАМФ, Са2+) в овоцит и обратно – к клеткам фолликулярного эпителия.
Полагают также, что белковые субстраты группы коннексина-37 используются овоцитом для трофики, а в последующем совместно с другими регуляторными сигналами реинициируют мейоз. Как и в примордиальных фолликулах, овоциты первичных фолликулов пребывают в состоянии блока мейоза, несмотря на то что рост половых клеток существенно активизируется.
В ходе формирования фолликулярной полости (кавитации) в клетках фолликулярного эпителия облигатно экспрессируются кит-лиганд, а в овоците – Сх37. Если в регионе фолликула данные белки отсутствуют, полостной фолликул не развивается, и возникают ановуляторные формы бесплодия.
В проведенном исследовании было выявлено усиление экспрессии Сх37 в ооцитах полостных фолликулов на 7-е сутки, что является необходимым условием для нормального течения поздних стадий фолликулогенеза, и характерно для доминантного фолликула до овуляции. Экспрессия протеина в фолликулярном эпителии первичных фолликулов снижается, однако не приводят к нарушению возобновления мейоза в ооците растущего фолликула [11].
На 15-е сутки эксперимента экспрессия BMP 15 в ооцитах всех типов растущих фолликулов наиболее выражена по сравнению с контролем и 7-ми сутками. Следует отметить появление значимо более высокой экспрессии BMP 15 в ооцитах уже со стадии примордиальных фолликулов, что согласуется со вступлением избыточного количества фолликулов в рост.
На 30-е сутки опыта сохраняется высокая экспрессии BMP 15 в первичных фолликулах, что соотносится с завершением цикла фолликулогенеза. По данным литературы, ВМР 15 и Cx37 являются протекторами клеток гранулезы не только от апоптоза, но и преждевременной лютеинизации [9, 10]. В проведённом исследовании экспрессия BMP 15 и Cx 37 в ооцитах ВРФ и ТРФ не отличается от таковых в контроле, но снижается по сравнению с предыдущими точками опыта.
Белок VEGF – один из основных стимуляторов ангиогенеза и повышения проницаемости сосудов [13]. Полученные результаты согласуются с опубликованными иммуногистохимическими исследованиями, показавшими повышенную экспрессию VEGF в стенке функциональных кист яичников [15]. Усиление процессов ангиогенеза (повышением экспрессии VEGF) в ранние сроки моделирования функциональных кист связано с усилением пролиферации фолликулоцитов, что является одним из звеньев патогенеза ФКЯ и ответом на стимуляцию фолликулярного эпителия ФСГ.
Заключение. Усиление экспрессии факторов ово-соматического взаимодействия (BMP 15 и Cx 37) и ангиогенеза (VEGF) в ранние сроки моделирования функциональных кист согласуется с усилением пролиферации фолликулоцитов.
