Талассемии являются самым частым генетическим гематологическим заболеванием в мире. Передаваясь аутосомно-рецессивным путем, гетерозиготная форма талассемии проявляется носительством этого заболевания, а гомозиготная форма- хронической гемолитической анемией. В результате повторяющихся гемотрансфузий у больных талассемией увеличивается количество железа в организме [1].
В организме человека основным регулятором метаболизма железа является молекула гепсидина. Гепсидин-это пептидный гормон, большей частью синтезируемый печенью, циркулирующий в крови и выделяемый почками. Гепсидин уменьшает всасывание железа в тонком кишечнике, тормозит выход железа из макрофагов, поглотивших старые эритроциты, в плазму и препятствует мобилизации железа из его депо в печени. Вопреки тому, что гепсидин, являясь основным регулятором метаболизма железа, препятствует поступлению железа в организм и его высвобождению из макрофагов, при талассемии и других видах анемий, протекающих с неэффективным эритропоэзом, высокий уровень железа и низкий уровень гепсидина наталкивает на мысль о наличии других механизмов регуляции. Обнаружение в случае врожденных дисэритропоэтических анемий, талассемий и других заболеваний, протекающих с неэффективным эритропоэзом, высоких значений growth differentiation factor 15 (GDF 15), относящегося к семейству TGF-β (transforming growth factor) и играющего важную роль в делении, дифференциации и регенерации тканей, позволяет предположить его возможную роль в эритропоэзе и метаболизме железа [2, 3]. Подавление GDF 15 синтеза гепсидина дает возможность предположить о наличии связи между этой молекулой и эритропоэзом и возможном взаимодействии с клетками микроокружения костного мозга [4].
Известно, что микроокружение костного мозга влияет на образование полноценных клеток крови из гематопоэтических стволовых клеток. Известно, что мезенхимальные стволовые клетки, являющиеся основным компонентом микроокружения, могут дифференцироваться в поддерживающие клетки во главе с остеобластами и адипоцитами, обеспечивая стромальную поддержку гематопоэтическим клеткам, а также способны регулировать дифференциацию и деление гематопоэтических клеток. Мезенхимальные стволовые клетки оказывают влияние на гематопоэтические клетки путем взаимодействия клетка-клетка, клетка-матрикс, а также посредством секреторных факторов, продуцируемых мезенхимальными стволовыми клетками [5].
В этом исследовании было предположено наличие значительных изменений в микроокружении костного мозга у пациентов с большой талассемией и другими заболеваниями, протекающими с неэффективным эритропоэзом, и была поставлена цель изучить физические, антигенные, секреторные особенности и особенности дифференциации мезенхимальных стволовых клеток костного мозга. Также была поставлена цель наряду с исследованием мезенхимальных стволовых клеток изучить их секреторные факторы, особенно GDF-15, у пациентов с большой талассемией, перенесших трансплантацию гематопоэтических стволовых клеток, до и после трансплантации.
Для осуществления этого исследования было получено разрешение соответствующих комиссий по этике (№ FON 09/33-198). Исследование было поддержано отделом научных исследований медицинского факультета Университета Хаджеттепе (проект № 5014)
Mатериалы и методы
В этом исследовании был изучен костный мозг 10 пациентов с большой талассемией до трансплантации гематопоэтических стволовых клеток. Был сравнен костный мозг 6 пациентов после трансплантации с контрольной группой, состоящей из костного мозга 8 здоровых доноров. После разморозки замороженного костного мозга были проведены иммунофенотипирование, проточная цитометрия и культивирование мезенхимальных стволовых клеток. Кроме того, была исследована дифференциация мезенхимальных стволовых клеток (остеогенная и адипогенная) и с помощью надосадочной взвеси культуры мезенхимальных стволовых клеток в плазме костного мозга был определен уровень фактора GDF15, предполагаемого регулятора эритропоэза.
Изоляция мезенхимальных стволовых клеток и их размножение в культуре:
Изъятые образцы костного мозга были распределены по стерильным пробиркам и центрифугированы в течении 10 минут при 2300 об/мин. После определенных манипуляций в пробирки объемом 75 см3 были посажены клетки для роста и для получения 4x103 клеток /cm2.
На этом рисунке отражено размножение клеток до 3 пассажей [6].
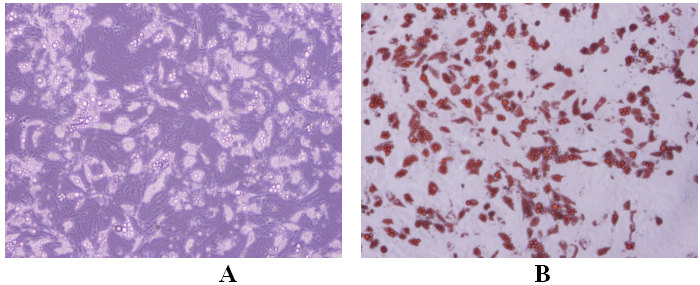
Рис. 1. Вид мезенхимальных стволовых клеток, размножающихся в среде, при рассмотрении в инвертированный микроскоп (случай 2) (А: увеличение в 4 раза, В: увеличение в 10 раз).
Иммунное фенотипирование мезенхимальных стволовых клеток исследование проведено с помощью проточной цитометрии
Клетки, изолированные из костного мозга человека, были идентифицированы с помощью антител в аппарате проточной цитометрии [6] и проанализированы с помощью аппарата проточной цитометрии FACS Aria (BD Biosciences, USA).
Оценка способности мезенхимальных стволовых клеток к дифференциации:
Для оценки адипогенной и остеогенной способности к дифференциации мезенхимальных стволовых клеток в культуру клеток были добавлены соответствующие стимуляторы. Стимулированные к дифференциации клетки были гистохимически окрашены и морфологически изучены.
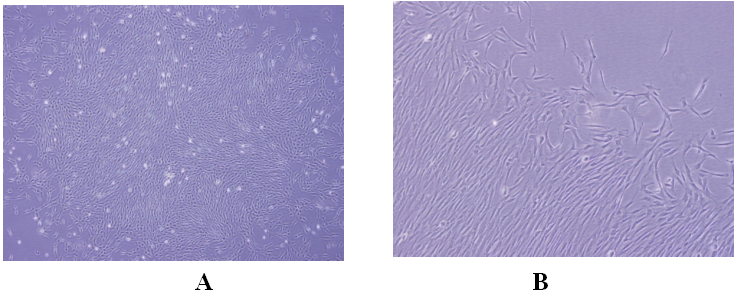
Рис. 2. Образование в последующие дни в мезенхимальных стволовых клетках, стимулированных в адипогенной среде, круглых жировых капель и их положительная окраска красителем Oil Red O (A: адипогенные клетки,не покрашенные Oil Red O. 10x, B: адипогенные клетки, покрашенные Oil Red O).
Исследование плазмы костного мозга и надосадочной взвеси культур с помощью метода ELİSA
Образцы надосадочной взвеси культур мезенхимальных стволовых клеток, изъятые у доноров и реципиентов до и после трансплантации костного мозга и плазма костного мозга этих образцов были исследованы с помощью Duo-Set Enzym-linked immunosorbent assay (ELİSA), специально разработанного для изучения фактора роста и дифференциации GDF 15.
Обсуждение. Мезенхимальные стволовые клетки играют важную роль в захвате стромой гематопоэтических стволовых клеток (экстрацеллюлярным матриксом и стромальными клетками), дифференциации предшественников гематопоэтических клеток в зрелые клетки под влиянием различных секреторных факторов, образование резерва стволовых клеток вследствии ингибирования путем задержки развития стволовых клеток в фазе G0 клеточного цикла,самообновление или мобилизация, миграция в другие ткани при необходимости.7,8 Таким образом, мезенхимальные стволовые клетки, являясь важным компонентом микроокружения костного мозга, играют важную роль в регулировании нормального гематопоэза. Предполагается, что исследование мезенхимальных стволовых клеток костного мозга при различных заболеваниях кроветворной системы поможет обнаружить механизмы регуляции и обеспечения нормального гематопоэза. Наряду с возросшим интересом к мезенхимальным стволовым клеткам, подавляющее большинство исследований проводится с образцами мезенхимальных стволовых клеток здоровых испытуемых и изъятых из различных областей. С другой стороны наличие такой патологии гематопоэтических клеток, как большая талассемия, навело на мысль о наличии возможных компенсаторных/адаптивных изменений в мезенхимальных стволовых клетках, являющихся компонентами микроокружения костного мозга, исследование которых приведет к лучшему пониманию механизмов развития патологии крови.
В нашем исследовании были изучены мезенхимальные стволовые клетки костного мозга пациентов, перенесших трансплантацию гематопоэтических стволовых клеток по поводу талассемии мажор, а также сопоставлены результаты с контрольной группой, состоящей из здоровых пациентов. При сравнении результатов морфологического, иммунофенотипического исследований, осуществленных для характеризации мезенхимальных стволовых клеток, а также их способности к дифференциации в адипоциты и остеокласты с результатами нормальных контрольных образцов не было обнаружено значительных различий. В образцах, изъятых у 3 пациентов, наше внимание привлекло образование эритроидной колонии на поверхности мезенхимальных стволовых клеток, и,по крайней мере до конца пассажа 0, отмечалась их жизнеспособность,из чего был сделан вывод о том,что мезенхимальные стволовые клетки оказывают стромальную поддерживающую функцию эритропоэтическим клеткам.
Зная особенности синтеза растворимого фактора, являющегося одним из важнейших особенностей мезенхимальных стволовых клеток, как поддерживающей ткани, и предполагая как наличие возможных различий между пациентами с талассемией мажор и контрольной группой, так и лучшее отражение адаптационных изменений, в исследовании был изучен уровень GDF 15 - одного из веществ, влияющих на эритропоэз и метаболиз железа. Желая отразить микроокружение костного мозга, этот фактор был изучен в плазме костного мозга, кроме того, с целью выяснения роли мезенхимальных стволовых клеток, была использована надосадочная взвесь культур клеток.
Исследования, проведенные в последние годы, подтвердили важную роль гепсидина и GDF 15 в метаболизме железа. Предполагая высокий уровень этого вещества при неэффективном эритропоэзе-состоянии, сопровождающимся высокими значениями депо железа, мы столкнулись с полной противоположностью.
В результате наше внимание сосредоточилось на других возможных механизмах, играющих роль в метаболизме железа. GDF 15 является одним из представителей в-семейства TGF. Обладает сходством на 15-29% с другими представителями этого семейства,но дает повод предположить наличие возможной отличной, присущей только этому веществу, роли. GDF 15 ингибирует позднюю фазу активации макрофагов, ингибирует пролиферацию незрелых предшественников гематопоэза, препятствует росту различных опухолей, оказывает антиангиогенное действие, участвует в эмбриогенезе,остеогенезе и гематопоэзе.10 Наряду с тем, что GDF 15 синтезируется многими тканями в литературе нет данных о том, что является источником этого вещества при состояниях, сопровождающихся неэффективным эритропоэзом.
В этом исследовании, учитывая его возможное влияние на эритропоэз и ингибирование синтеза гепсидина, был изучен уровень GDF 15 в плазме костного мозга и надосадочной взвеси культуры мезенхимальных стволовых клеток.
Танно с коллегами в результате своих исследований [13] обнаружили в сыворотке пациентов большой талассемией высокий уровень GDF 15. В образцах сывороток этих же пациентов были обнаружены, наряду с высоким уровнем GDF 15, высокие уровни ферритина, эритропоэтина, растворимых рецепторов трансферрина, одновременное подавление экспрессии мРНК гепсидина в гепатоцитах пациентов с большой талассемией, обнаружено предотвращение супрессии гепсидина путем снижения уровня GDF 15. В результате, наше внимание привлекло влияние GDF 15 на метаболизм железа и особенно на подавление синтеза гепсидина [11].
И вновь Рамирез с коллегами у пациентов с РАРС [12], Финкенштед и товарищи у пациентов с недостаточностью пируваткиназы [13], Тамари и соратники у пациентов с врожденной дисэритропоэтической анемией типа 1 обнаружили высокий уровень GDF 15. Был проанализирован уровень GDF 15 в сыворотки и костном мозге при заболеваниях, протекающих с неэффективным эритропоэзом, но в литературе не было обнаружено сведений об исследовании синтеза GDF 15 мезенхимальными стволовыми клетками микроокружения в состоянии неэффективного эритропоэза.
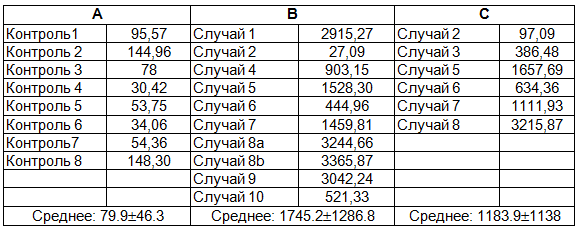
В исследовании при сравнении с контрольной группой были обнаружены более высокие значения GDF 15 в плазме костного мозга у пациентов с большой талассемией. При исследовании надосадочной взвеси культур мезенхимальных стволовых клеток было обнаружено, что при полном отсутствии GDF 15 в контрольной группе, у некоторых пациентов в экспериментальной группе наблюдался высокий уровень GDF 15. В образцах пассажа 0, в которых были обнаружены эритроидные колонии, в 4 из 6 случаев был обнаружен высокий уровень GDF 15, что натолкнуло на мысль о том, что имеет место его синтез предшественниками эритроидного ряда. Выявление высокого уровня GDF 15 в надосадочной взвеси культур мезенхимальных стволовых клеток у некоторых пациентов натолкнуло на мысль об контролировании этого уровня функциями микроокружения костного мозга. Поддерживание мезенхимальными стволовыми клетками количества GDF 15 на определенном уровне может говорить об ингибирующей или стимулирующей функции. GDF 15 приводит к значительному снижению уровня гепсидина,тем самым способствуя накоплению железа в организме [11]. Накопленное избыточное количество железа, наряду с нарушением функций паренхиматозных органов, также приводит к нарушению функционирования микроокружения костного мозга. В этом случае предполагается, что мезенхимальные стволовые клетки, являющиеся важным компонентом микроокружения костного мозга, играют определенную роль в регуляции уровня GDF 15 с целью протекции себя и окружения от этого патологического накопления.
Для осуществления нормального эритропоэза необходим GDF 15. В одном из проведенных исследований было показано,что вслед за снижением уровня GDF 15 наблюдалось снижение нормальной дифференциации эритроидных предшественников [12]. В случае неэффективного эритропоэза значительное увеличение уровня GDF 15 говорит об снижении чувствительности предшественников эритропоэза к GDF 15 или об попытке задержать усиленный апоптоз, наблюдающийся в этом случае. В зависимости от вида неэффективного эритропоэза,в случае необходимости мезенхимальные стволовые клетки также могут принимать участие в синтезе GDF 15. Высокий уровень GDF 15 в надосадочной взвеси культур мезенхимальных стволовых клеток у части исследуемых пациентов можно связать с этим предположением. В нормальном костном мозге при наличии физиологических условий содержится незначительное количество GDF 15 [12]. В нормальных условиях это незначительное количество GDF 15 поддерживается мезенхимальными стволовыми клетками, а при наличии патологических процессов - предшественниками эритроидного ряда.
В итоге предполагается, что мезенхимальные стволовые клетки,являясь важным компонентом микроокружения костного мозга и играя активную роль в случае неэффективного эритропоэза,при необходимости участвуют в регуляции эритропоэза путем синтеза цитокинов. С этой точки зрения высокий уровень GDF 15 в надосадочной взвеси культуры мезенхимальных стволовых клеток у некоторых пациентов с большой талассемией до и после трансплантации гематопоэтических стволовых клеток говорит об обеспечении и осуществлении нормального эритропоэза. Наряду с этим очевидна необходимость в большем количестве исследований.
Tаблица 1. Уровни GDF 15 в плазме костного мозга. А: контрольная группа, В: до трансплантации гематопоэтических стволовых клеток, С: после трансплантации гематопоэтических стволовых клеток. Случай 8а:1. трансплантации гематопоэтических стволовых клеток, случай 8б: 2. трансплантации гематопоэтических стволовых клеток