Введение. В настоящее время изучению эффективности применения физических факторов в хирургии и травматологии уделяется значительное внимание практических врачей и научной общественности. Одним из вариантов практической реализации подобных технологий является использование генератора холодной плазмы, содержащей монооксид азота, реализованный в настоящее время в форме аппарата «Плазон» [1-4]. Несмотря на проведенные ранее исследования, направленные на оценку эффективности указанной лечебной технологии на различных моделях, ее молекулярно-клеточные механизмы изучены недостаточно полно [2].
Рассматривая эффекты NO-терапии, проводимой с помощью аппарата «Плазон», следует выделить два основных компонента: непосредственно монооксид азота, обладающий целым рядом различных биологических эффектов [5-13], так и сама холодная плазма, являющаяся его носителем в газовой фазе. Согласно данным последних десятилетий, последняя также не служит инертным веществом для биологических объектов [14, 15]. В частности, установлено, что она способна приводить к уничтожению микроорганизмов на различных поверхностях [16, 17], хирургических инструментах [14, 18] и даже на бумажных конвертах [19]. С другой стороны, применение холодной плазмы может быть дополнительным методом оптимизации течения раневого процесса [1, 3, 20-22].
В свою очередь второй компонент лечебного воздействия – оксид азота – оказывает многогранное биологическое действие, являясь молекулярным биорегулятором во всех функциональных системах организма [5-7, 10]. В частности, некоторыми авторами в экспериментальных и клинических условиях установлена его саногенетическая активность для ран различной локализации и этиологии [1, 3, 4, 22].
В связи с этим, целью исследования служила оценка действия монооксида азота (NO) на цельную кровь здоровых доноров.
Материалы и методы. Изучен характер реакции цельной консервированной крови на воздействие холодной плазмы, насыщенной оксидом азота. Для этого производили непосредственный барботаж образцов крови (5 мл) газообразным агентом (суммарная доза оксида азота 80 мкг) в течение 2 минут [23]. Генерацию холодной плазмы, насыщенной оксидом азота (концентрация вещества в газовом потоке в выбранных условиях – 800 мкг/л) выполняли аппаратом «Плазон» (Россия). Экспозиция после воздействия составляла 3 минуты. Контролем выступал образец, на который не оказывали никаких воздействий. Эксперимент повторяли десятикратно.
В донорской консервированной крови спектрофотометрическим методом определяли активность лактатдегидрогеназы (ЛДГ) в прямой и обратной реакциях по методу Г.А. Кочетова, альдегиддегидрогеназы (АлДГ) – по методу Б.М. Кершенгольца, Е.В. Серкиной. Активность супероксиддисмутазы (СОД) оценивали по Т.В. Сироте. Содержание белка уточняли по модифицированному методу Лоури. Уровень лактата в плазме крови и эритроцитах определяли с помощью анализатора SuperGL Ambulance. Показатели кислотно-щелочного равновесия и парциальное давление газов крови устанавливали с помощью автоматического анализатора ABL-77.
Результаты обрабатывали с использованием программы Statistica 6.0.
Результаты и обсуждение. Проведенные эксперименты позволили установить, что нитроксилирование крови газовым потоком, генерируемым аппаратом «Плазон», существенно изменяет уровень оцениваемых показателей. Так, рассматриваемый физический фактор оказывал значимое влияние на функционирование большинства ферментных систем (рис. 1). Так, в частности, установлено статистически значимое снижение активности ЛДГ в прямой реакции (на 39 и 15% соответственно; p<0,05) на фоне повышения активности последнего энзима в обратной реакции (на 86%; p<0,05). Выявленные сдвиги косвенно свидетельствует о снижении энергетических ресурсов эритроцитов.
К адаптивным NO-индуцированным изменениям также следует, на наш взгляд, отнести выраженное снижение активности одного из основных компонентов ферментного звена антиоксидантной системы крови – супероксиддисмутазы (на 39% относительно контрольного уровня; p<0,05). С учетом того, что действие на биологическую среду холодной плазмы и NO сопряжено с гиперпродукцией в ней свободных радикалов [20], данная тенденция может отражать нейтрализацию последних изучаемым энзимом и иметь компенсаторное значение.
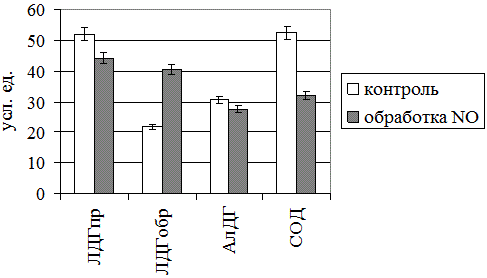
Рис. 1. Влияние газообразного оксида азота на активность ферментных систем крови (ЛДГпр и ЛДГобр – прямая и обратная реакции лактатдегидрогеназы соответственно, АлДГ – альдегиддегидрогеназа, СОД - супероксиддисмутаза)
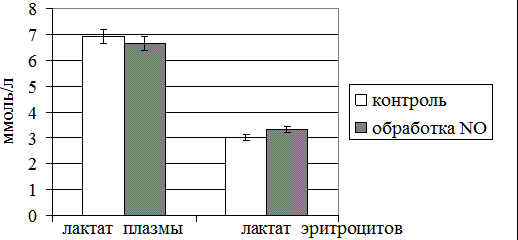
Рис. 2. Уровень лактата плазмы крови и эритроцитов при воздействии оксидом азота
NO-зависимые метаболические перестройки, в частности приводящие к нарушению физиологического функционирования ЛДГ в эритроцитах со смещением в сторону активации обратной реакции обуславливают разнонаправленную динамику концентрации лактата в плазме и эритроцитах (рис. 2). Так, в первом биообъекте (плазме крови) регистрировали минимальное снижение содержания исследуемого метаболита (на 6%), тогда как во втором – четкую тенденцию к нарастанию (на 11%; p<0,05). С наших позиций, выявленные сдвиги активности ЛДГ и лактата эритроцитов могут рассматриваться как предпосылки гипоксического состояния, смоделированного in vitro при действии высоких доз оксида азота на цельную кровь здоровых людей.
Также представляют интерес данные, касающиеся динамики парциального давления углекислого газа и кислорода в крови при ее нитроксилировании газовым потоком, генерируемым аппаратом «Плазон» (рис. 3). Выявленные изменение активности ЛДГ в прямой и обратной реакциях и нарастание уровня лактата в эритроцитах, указывающие на формирование энергодефицита, предположительно должны были сочетаться с падением парциального давления кислорода в крови, однако нами зарегистрирована противоположная тенденция – увеличение значения данного показателя на 107%. Подобная картина, по нашему мнению, связана не с самим оксидом азота, а с особенностями «носителя» газовой фазы – холодной плазмы, которая содержит в себе значительное количество молекулярного кислорода в метастабильном состоянии и атомарного кислорода [14, 20, 21]. Растворение последних и обеспечивало наблюдаемый в эксперименте эффект гипероксигенации, сочетающейся со снижением парциального давления углекислого газа.
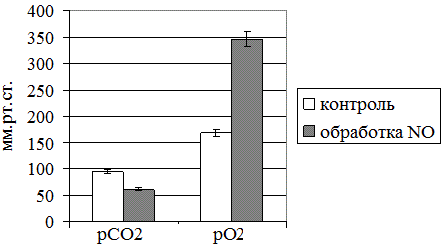
Рис. 3. Парциальное давление кислорода и углекислого газа в крови при ее обработке оксидом азота
Кроме того, установлено, что нитроксилирование крови приводило к минимальному закислению среды (ΔpH=–0,08), снижению уровня биокарбонатов плазмы (на 44% относительно исходного уровня; p<0,05) и повышению уровня калия в ней (ΔК+=0,43 ммоль/л). Важно подчеркнуть, что при обработке образцов цельной крови монооксидом азота визуально наблюдается эффект «потемнения», который может быть обусловлен метгемоглобинообразованием.
Заключение. Таким образом, обработка цельной крови здоровых доноров холодной плазмой, содержащей высокие концентрации оксида азота, способствовала ряду сдвигов энергетического метаболизма, ионного состава и кислотно-щелочного равновесия в биологическом субстрате. Кроме того, нитроксилирование крови в использованном режиме, оказывая преимущественное влияние на состояние эритроцитов, демонстрирует признаки метгемоглобинообразования. Оценка характера действия данного фактора на биосистемы, а также уточнение эффективных и безопасных доз оксида азота позволят более подробно расшифровать механизмы его эффекта и оптимизировать применение изучаемого аппарата.
