Апластическая анемия (АА) АА является одним из самых тяжелых заболеваний системы крови с высокой летальностью, характеризующаяся выраженным угнетением эритро-, тромбо-, гранулопоэза и, как следствие, гипоклеточностью костного мозга с замещением нормальных ростков кроветворения жировой тканью, а также развитием панцитопенией в периферической крови. Глубокая трехростковая цитопения развивается в результате угнетения кроветворения вследствие иммунной агрессии, направленной на клетки-предшественники гемопоэза [1, 10].Благодаря достижениям экспериментальной и клинической гематологии за последние годы установлено, что одним из важных звеньев патогенеза заболевания является дизрегуляция Т- и В-клеточной системы иммунитета. Изучение этого механизма в последние годы вызывает все большее внимание ученых в связи с эффективностью проводимой иммуносупрессивной терапии. Работы последних лет были направлены на оценку состояния Т-клеточного звена иммунитета у пациентов с АА [6, 20]. В результате исследований было установлено повышение количества зрелых и активированных Т-лимфоцитов с фенотипом супрессоров-киллеров, инверсия хелперно-супрессорного соотношения, увеличение продукции цитокинов (интерферона g, фактора некроза опухолей a), обладающих ингибирующим действием на гемопоэтические клетки костного мозга [3, 5, 16].Однако работ, посвященных изучению В-клеточного звена иммунной системы при АА, в современной литературе недостаточно. В результате исследования лимфоцитов селезенки, экспрессирующих CD20+, у больных отмечено увеличение процентного содержания В-клеток в группе пациентов с благоприятным прогнозом заболевания [5]. Тем не менее, сведений об особенностях распределения данной популяции лимфоцитов в этом органе в зависимости от тяжести и длительности патологического процесса в доступной литературе не встретилось.Проблема лечения пациентов с АА до настоящего времени остается актуальной. Исходя из аутоиммунного характера заболевания, перспективным и патогенетически обоснованным методом терапии является аллогенная трансплантация костного мозга. Второй способ лечения включает в себя комплексную иммунодепрессивную терапию [19]. В определенных случаях (отсутствие эффекта, рецидивы, высокая зависимость от гемотрансфузий, непереносимость препаратов) клиницисты используют спленэктомию.Необходимость хирургического вмешательства при АА до сих пор обсуждается. Известно, что одним из механизмов влияния операции на течение болезни считается удаление большой массы активированных лимфоидных клеток, участвующих в патогенезе заболевания. При этом доказано, что после спленэктомии у больных частично восстанавливаются показатели периферической крови и снижается зависимость от гемотрансфузий.Тем не менее, вопросы изменения гистоархитектоники селезенки при данной нозологии в литературе представлены единичными работами. Кроме того, исследования различных групп лимфоцитов и их функционального состояния при данной патологии выполнялись преимущественно в костном мозге и периферической крови [9, 12, 13]. Для более полного понимания роли селезенки в патогенезе заболевания целесообразно изучение ее популяционного состава в гистологических срезах лмфоидного органа с применением современных методов исследования, таких как иммуногистохимия [2, 8, 11, 14, 15, 18, 19]. Полученные данные дополнят установленные ранее гистологические изменения селезенки, а также помогут отразить степень ее вовлечения в патологический процесс АА.Таким образом, целью настоящей работы явилось изучение особенностей CD20+ В-клеточной популяции у больных АА в зависимости от тяжести заболевания и длительности патологического процесса.При исследовании проведен анализ 33 больных АА, которые находились на лечении в гематологической клинике Кировского НИИ гематологии и переливания крови за период 1992-2015 г. Медиана возраста пациентов на момент установления диагноза составила 31 год. Количество лиц мужского пола было в 2 раза больше, чем женского (22 против 11 соответственно). Все больные получали комплексное лечение, включающее введение метилпреднизолона, циклоспорина-А, циклофосфамида. Спленэктомию осуществляли на 4-7 сутки от начала терапии глюкокортикоидами. Компоненты крови и сопроводительное лечение применяли по общепринятым правилам [4].Диагноз и тяжесть АА устанавливали на основании общепринятых критериев [4]: нетяжелую степень АА (НАА) диагностировали при гранулоцитопении >0,5·109/л, тяжелую АА (ТАА) определяли по наличию в периферической крови гранулоцитопении <0,5·109/л и тромбоцитопении <20·109/л. Сверхтяжелая (очень тяжелая) степень отличалась только одним признаком - гранулоцитопенией <0,2·109/л; вследствие малого числа больных с данной степенью патологического процесса (n=3), пациенты со сверхтяжелой формой заболевания в наших исследованиях были объединены с больными, имеющих тяжелую степень АА.Из 33 обследуемых у 13 пациентов (39,4%) была установлена НАА и у 20 (60,6%) - ТАА. В зависимости от длительности предоперационного периода все обследуемые были разделены на две группы: с продолжительностью от начала заболевания до спленэктомии 2 месяца (1-я группа, n=23) и более 2 месяцев (2-я группа, n=10). Пациенты во всех группах не отличались по возрасту. После спленэктомии у обследованных определяли массу удаленной селезенки; проводку образцов послеоперационного материала выполняли общепринятым способом. Статистически значимых различий по массе лимфоидного органа в зависимости от тяжести заболевания или длительности патологического процесса выявлено не было.Сравнительный анализ проводили с образцами селезенок (судебно-медицинские вскрытия), взятыми от 20 лиц, скончавшихся скоропостижно и не имевших в анамнезе заболеваний системы крови. Медиана возраста составила 55 лет. Мужчин было 12, женщин - 8.Исследования секционного материала проводились на парафиновых гистологических срезах толщиной 3-5 мкм по стандартной методике окраски: гематоксилином и эозином. Для идентификации CD20+ В-лимфоцитов селезенки использовали иммуногистохимический метод окрашивания по стандартной методике с использованием первичного антитела CD20 фирмы “Dako” (Дания) в готовом разведении (“ready to use”), а также систему визуализации EnVISION, PEROXIDASE (DAB+) фирмы “Dako” (Дания). При просмотре препаратов антиген-позитивные клетки распознавали по окрашиванию их в специфический желто-коричневый цвет.Морфометрическую оценку количества В-клеток выполняли с помощью светового микроскопа и программного обеспечения анализа изображений ImageScope Color, версии М с окуляром х10, при объективе х100. Исследования проводили в 20 полях зрения для каждого образца. Исходя из полученных результатов, вычисляли массу CD20+ лимфоцитов по разработанной на основании патента формулы [7].Для статистической обработки результатов применялась программа SPSS for Windows Version 19.0. Достоверность различий между показателями в сравниваемых группах оценивали с использованием непараметрических двусторонних критериев Краскела-Уоллеса, Манна-Уитни и учетом поправки Бонферони при множественных сравнениях. Различия считали статистически значимыми при уровне р<0,05. Результаты исследований представлены с указанием медианы, а также нижнего (25%) и верхнего (75%) квартилей для каждой группы.При исследовании гистологических срезов было отмечено, что В-лимфоидная популяция превалировала в белой пульпе селезенки как у больных АА, так и в группе сравнения. Причем, большее количество этих клеток было выявлено в лимфоидных узелках, меньшая их доля локализовалась в маргинальной зоне. В красной пульпе исследуемые клетки обнаруживались в большем количестве, по отношению к группе сравнения (рис. 1 и 2).
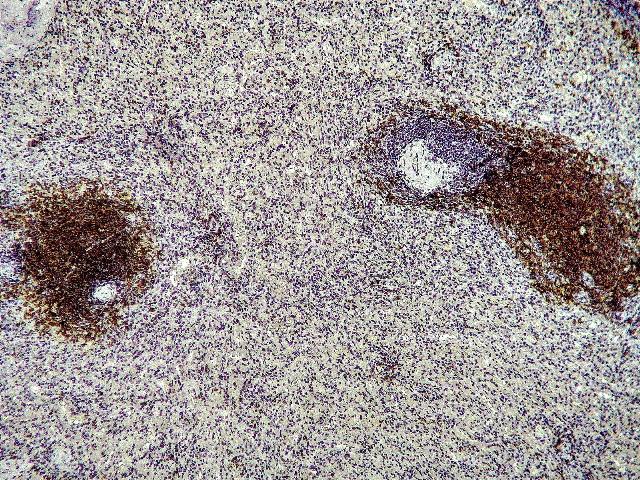
Рис. 1. Селезенка (больной М., 27 лет, диагноз: апластическая анемия): распределение В-клеточных элементов (CD20+) в белой и красной пульпе. Окраска CD20, Clone L26, «Dako», ИПМ. Ок. х10, об. х10.
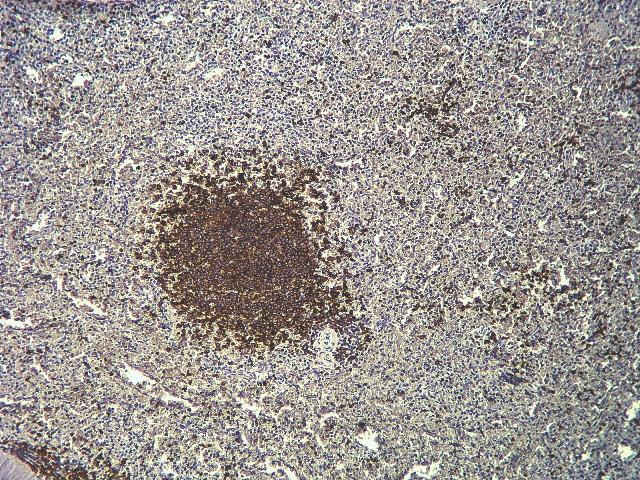
Рис. 2. Селезенка человека, возраст 28 летЖ распределение В-клеточных элементов (CD20+) в белой и красной пульпе. Окраска CD20, Clone L26, «Dako», ИПМ. Ок. х10, об. х10.
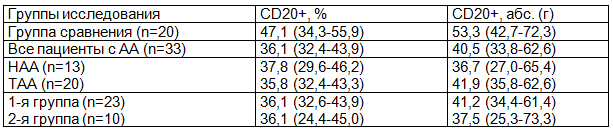
В результате морфометрических исследований было установлено статистически значимое увеличение содержания CD20+-экспрессирующих клеток в селезенке у всех больных АА (табл. 1). Причем повышение относительного числа исследованных лимфоцитов было отмечено как при нетяжелой, так и при тяжелой формах заболевания по отношению к группе сравнения (р<0,05). Однако, при оценке этих же данных в абсолютных значениях, достоверные различия были получены только у пациентов с ТАА (р<0,05).
Таблица 1. Среднее содержание популяции CD20+ В-лимфоцитов в селезенке при АА
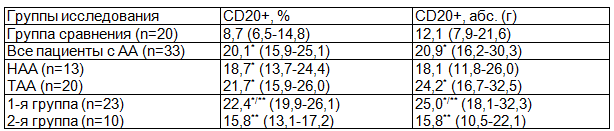
Примечание: здесь и далее * - статистическая значимость различий по отношению к данным группы сравнения; ** - статистическая значимость различий между данными 1 и 2 групп.
Вместе с тем, при анализе В-клеточной популяции у больных в различные сроки проведения операции выявлено, что у обследуемых 1 группы количество CD20+ лимфоидных элементов было выше по сравнению с контрольной группой (р<0,05). У больных второй группы имелась лишь тенденция к увеличению содержания В-лимфоцитов (р>0,05). Кроме того, у лиц 2 группы определялось достоверно более низкое количество этих клеток по отношению к пациентам, предоперационный период которых был менее продолжительным.
При более подробном исследовании содержания CD20+ В-клеток в функциональных зонах селезенки было выявлено статистически значимое повышение их относительного и абсолютного количества в красной пульпе у всех больных АА вне зависимости от тяжести заболевания по сравнению с контрольной группой (табл. 2).
Таблица 2. Количество CD20+ В-лимфоцитов у пациентов с АА в красной пульпе селезенки
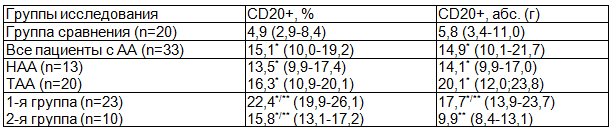
Увеличение относительных значений числа исследованных лимфоцитов было выявлено и у лиц с АА в различные сроки проведения спленэктомии (<0,05). При этом более высокие показатели были характерны для пациентов, прооперированных в первые месяцы течения заболевания.
Вместе с тем, в результате оценки полученных данных в абсолютных величинах, достоверное повышение числа В-клеточной популяции было отмечено только у обследуемых 1 группы. У больных с продолжительностью АА более 2 месяцев до удаления селезенки было определено достоверное снижение количества CD20+клеток по отношению к пациентам с менее коротким предоперационным периодом (р<0,05).
В результате анализа CD20+-экспрессирующих клеток в белой пульпе селезенки достоверных различий по их количественному составу между больными АА и группой сравнения получено не было (табл. 3).
Таблица 3. Количество CD20+ В-лимфоцитов у больных АА в белой пульпе селезенки
Таким образом, при АА наблюдалось повышение содержания иммунокомпетентных В-клеток в красной пульпе селезенки, как во вторичном органе иммуногенеза. Причем, увеличение количества В-лимфоидной популяции было более выражено у больных с тяжелой формой заболевания. Более высокие показатели процентного содержания CD20+ лимфоцитов у пациентов 1 группы, возможно, свидетельствуют об активации гуморального звена иммунитета в первые месяцы развития болезни. Некоторое снижение CD20+-экспрессирующих лимфоцитов у лиц с продолжительностью АА более 2 месяцев отражает последующее истощение данной популяции клеток в селезенке в процессе болезни вне зависимости от тяжести болезни. Данное явление обосновывает необходимость подключения к иммуносупрессивной терапии препаратов иммуноглобулинового ряда.
Кроме того, из представленной работы видно, что пересчет морфометрических показателей в абсолютные значения с учетом массы селезенки наиболее точно отражает изменения, происходящие в этом лимфоидном органе.
