В настоящее время установлено, что генетические аномалии гемостаза ответственны за развитие тромбозов в 80-90% случаев. Мутация пятого фактора (ФV) Лейдена выявляется у 20% пациентов с тромботическими осложнениями, другие дефекты антикоагулянтной системы (дефицит антитромбина III (AT III), дефицит протеина S и протеина С) – в 20% случаев, синдром липких тромбоцитов – в 14% случаев, а антфосфолипидный синдром (АФС) – в 25% [1, 2, 6]. По данным мировой литературы, на каждые 1000 родов приходится 2-5 случаев тромботических осложнений. До 50% венозных тромбозов возникают у женщин до 40 лет, как правило, они связаны с беременностью [7, 10]. В России смертность от тромбоэмболических осложнений колеблется от 1,5 до 2,7 на 10 000 родов и в структуре материнской смертности составляет от 2,8 до 18,3% [3, 4, 5, 8]. По Узбекистану данных нет, так как подобных исследований не проводилось.
Изучение осложнений течения беременности за последние годы, значительно расширили представления о наследственных приобретенных формах тромбофилии, которые могут быть основной причиной осложненной беременности [1, 4, 10].
У женщин, в акушерском анамнезе которых имеются привычное невынашивание беременности, поздние репродуктивные потери, тяжелые формы преэклампсии, плацентарная недостаточность, преждевременная отслойка нормально расположенной плаценты (ПОНРП), повторные попытки экстракорпоральной оплодотворение (ЭКО), протромботические генетические мутации и полиморфизмы наблюдаются в большинстве случаев с преобладанием комбинированных и гомозиготных форм [7, 9].
Беременные с развитием тромбоза в анамнезе более подвержены риску мертворождения, многие врожденные аномалии коагуляции крови могут передаться плоду, в случае тромбообразования в плаценте со стороны плода. Учеными до конца не установлено, увеличивается ли риск патологии плаценты из-за материнской или плодовой тромбофилии, однако исследования последних лет свидетельствуют о важной роли наследственности плода в общем риске тромбоза [7].
Поиск наиболее эффективных методов ведения пациенток с наследственными и приобретенными тромбофилиями имеет большое практическое значение в снижении частоты и степени тяжести важнейших гестационных осложнений, перинатальной и материнской заболеваемости и смертности.
Целью нашей работы явилось проведение комплексного исследования по изучению роли генетической тромбофилии в патогенезе преждевременной отслойке нормально расположенной плаценты у беременных женщин.
Материалы и методы исследования. Работа основана на изучении результатов анализа ДНК (дезоксирибонуклеиновая кислота) 70 беременных c преждевременной отслойкой нормально расположенной плаценты (ПОНРП) (основная группа) наблюдавшихся в Республиканском перинатальном центре Министерства Здравоохранении Республики Узбекистан (РПЦ МЗ РУз).
Для постановки диагноза применяли общеклинические, гемостазиологические, функциональные методы обследования.
Для контрольной группы приглашены 75 добровольцев, включая 45 беременных женщин, с нормальным течением беременности и 30 условно здоровых женщин, родивших 2-3 детей без каких либо осложнений.
При выполнении работы применялись различные реактивы и ферменты. Экстракцию геномной ДНК из лимфоцитов периферической крови проводили в соответствии с методикой Сэмбрук и др. с модификацией [10]. Метод полимеразно-цепной реакции (ПЦР) проводилась на программируемых термоциклерах фирмы «Applied Biosystems» (США) и Corbet (Rotor - Gene, QUAGEN, Германия).
Кроме обычного ПЦР - анализа каждого маркера, в работе впервые был использован мультиплексный ПЦР - анализ, т.е. одновременная амплификация трех различных участков геномной ДНК, метод, разработанный в лаборатории молекулярной гематологии Гематологического научного центра Российской академии медицинских наук (заведующий лабораторией к.б.н. Судариков А.Б.).
Результаты и обсуждение. Ген метилентетрагидрофолатредутаза (МТГФР) кодирует аминокислотную последовательность фермента МТГФР, играющего ключевую роль в метаболизме фолиевой кислоты. У женщин с мутантным генотипом во время беременности вследствие дефицита фолиевой кислоты происходит активация микротромбообразования, что приводит к нарушению маточного - фетоплацентарного кровообращения и таким образом значительно повышается риск развития преждевременной отслойки нормально расположенной плаценты с массивными кровотечениями.
Нами в целях определения клинико-диагностической значимости полиморфизмов С677Т в гене МТГФР, для риска развитие ПОНРП было проведено молекулярно-генетическое исследование у 145 пациенток, 70 из которых составили пациентки с ПОНРП (основная группа) и 75 женщин с нормальной репродуктивной функцией (контрольная группа).
Согласно полученным данным (табл. 1), среди обследованных пациенток с ПОНРП мутация гена МТГФР С677Т была выявлена у 32 из 70 женщин (45,7%), а в контрольной группе у 51 из 75 (68,0%). В основной группе статистически незначимо реже встречался благоприятный гомозиготный генотип (СС) – 54,3%, в то время как в контроле – 68,0% (Х2=2,3; Р=0,06) (табл. 2). Из 32 женщин с мутацией C677T гена МТГФР, 5 (7,1%) были носительницами гомозиготной и 27 (38,6%) - гетерозиготной мутации. Частота гетерозигот С/Т была несколько выше в группе пациентов с ПОНРП по сравнению с контрольной группой (38,6 и 32% соответственно). Согласно рассчитанному коэффициенту соотношения шансов риск развития ПОНРП среди больных почти в 1,3 раза выше, чем группа контроля (OR=1,3; 95% CI 0,674 - 2,643). Однако, полученные различия, оказались статистически недостоверными (Х2=0,7; Р=0,2).
Как и предполагалось, в контрольной группе носительство мутации гена МТГФР во всех случаях имело гетерозиготный характер. Гомозиготные формы искомых мутаций в изучаемой группы не были обнаружены. Разумеется, что гомозиготная форма этой мутации характеризуется клинической манифестацией различных тромботических эпизодов в молодом возрасте, а данный контингент женщин в контрольную выборку не входил. При этом, сравнительный анализ распределения генотипов данного маркера между исследуемых группах показал, что доля лиц с гомозиготным мутантным генотипом “Т677Т” более чем в 5 раза достоверно превышала таковую в контрольной группе (7,1 % против 0% в контроле, Х2=5,5; Р=0,01) (табл. 2).
Таблица 1. Распределение аллелей и генотипов полиморфизма C677T гена МТГФР среди женщин с ПОНРП
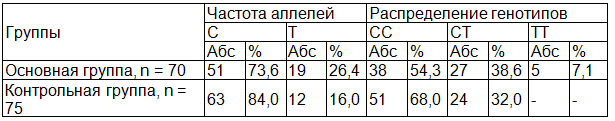
*- различие статистически достоверное (р<0,05).
Таблица 2. Частота встречаемости сложных генетических комбинаций среди женщин с ПОНРП
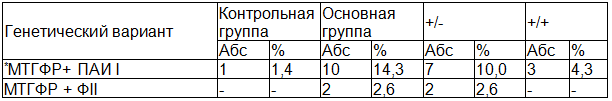
Примечание: общая частота МТГФР+ИАПI *Х2=8,7; Р=0,002; OR=12,3; 95% CI 1,535 – 99,07. Общая частота МТГФР+ФII Х2=2,2; Р=0,07.
Наблюдалось статистически значимое отклонение и в распределения благоприятного аллеля - C и неблагоприятного аллеля - T в основной и контрольной группах, что соответствовала цифрам 73,6% и 26,4% против 16,0% и 84,0%, соответственно (Х2=4,7; Р=0,01; OR=1,8; 95%CI 1,06-3,354) (табл. 2).
Таким образом, полученные результаты свидетельствуют о важном вкладе ключевого гена фолатного цикла МТГФР (генотипа Т677Т) в этиологию и риск развития ПОНРП у женщин. Известно, что гипергомоцистеинемия является фактором риска развития нарушений нормального развития беременности. При этом в метаболизме гомоцистеина кроме гена МТГФР важную роль играют и ферменты фолатного обмена MТР, MTРР. В связи с этим дальнейшим представляет интерес исследование у пациенток с ПОНРП содержания уровня гомоцистеина во взаимосвязи с различными полиморфными вариантами этих генов фолатного обмена.
Для того чтобы оценить комбинированный вклад сочетаний «функционально неблагоприятных» и «протективных» генотипов полиморфных маркеров «МТГФР С677Т», «ФII 20210G/A», «ФV G1691A» и ИАП I (ингибитор активатор протромбиназы) в формирование ПОНРП нами был проведен анализ частот гаплотипов (“ген-генных взаимодействий”) в группе пациенток с ПОНРП и группе контроля. Полученные результаты, приведены в табл. 2.
Таким образом, сравнительный анализ распределения полиморфизма С677T гена МТГФР у женщин с ПОНРП в зависимости от частоты проявлении показал, что различия в частотах встречаемости генотипов между обследованными подгруппами носили недостоверный характер (Р>0.05).
Полученные нами данные по частоте встречаемости полиморфизма G20210A гена протромбина соответствуют результатам исследования доноров русской популяции [5]. Ассоциация наследственных факторов тромбофилии с невынашиванием беременности у женщин в русской популяции, где частота встречаемости G и А аллелей была равна 0,99 и 0,01 можно говорить о значительном сходстве в распределении генотипов и аллелей полиморфизма G20210А гена ФII в этих популяциях (табл. 3). Кроме того, данная мутация более характерна только в некоторых популяциях Европы и белых американцев. Среди африканцев и представителей монголоидной расы данная мутация встречается очень редко.
Таблица 3. Распределение аллелей и генотипов полиморфизма G20210A гена ФII среди женщин с ПОНРП
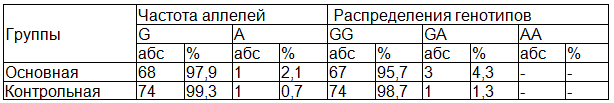
Для выявления возможной ассоциации полиморфизма гена ФV-Лейден с развитием ПОНРП у женщин был проведен сравнительный анализ частот аллелей и генотипов изученных генов между выборкой больных и контрольной группой.
Из всех обследованных 70 пациенток с ПОНРП мутантная аллель - Лейден гена ФV была обнаружена в 4 случаях (5,7%). При этом носительство лейденской мутации гена ФV во всех случаях имело гетерозиготный характер. Гомозиготная форма искомой мутации в изучаемой группе популяции обнаружена не была. В контрольной группе данная мутация не было выявлена (табл. 3).
Частоты распределения генотипов G/G, G/A и А/А данного генетического маркера в изученной основной группе составили 94,3, 5,7 и 0%, соответственно. Частоты этих генотипов в изученных I и II подгруппах больных не отличались между собой – 97,1, 2,9 и 0%. Эти данные показывают, что существенного различия в частоте встречаемости аллелей и генотипов гена ФV с учетом частоты проявлений ПОНРП не отмечено.
У пациентов с ПОНРП зарегистрирована мутация Лейдена в 5,7 %, что в 5 раз превышает данные показатели в контрольной группе (0%) (Х2=4,4; Р=0,02).
Оценка особенности распределения аллельных вариантов гена ФV, среди больных с ПОНРП и контроля, показала, что различия в частотах встречаемости мутантного аллеля “ФV 1691A” между обследованными группами также достигли критического уровня статистической значимости (Х2=4,3; Р=0,02).
К настоящему времени описан ряд полиморфных маркеров гена ПАИ-1. Наиболее часто в исследованиях используется мононуклеотидный полиморфный маркер типа делеция/вставка, расположенный в промотерной области в положении – 675 (4G(-675)5G).
В табл. 4 представлены результаты анализа распределения аллелей и генотипов полиморфизма 675 4G/5G гена ИАП-1 в контрольной группе и у пациентов с ПОНРП. Суммарная частота встречаемости полиморфизма 4G/5G гена ИАП-1 среди женщин с ПОНРП и контроля составили 58,5% (51,4% - гетерозигота и 7,1% - гомозигота) и 39,0% (все гетерозиготы), соответственно.
Таблица 4. Распределение аллелей и генотипов полиморфизма 4G/5G гена PAII среди женщин с ПОНРП
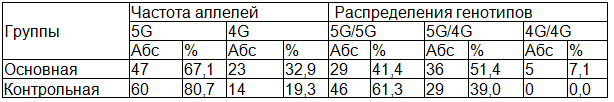
Согласно рассчитанному коэффициенту соотношения шансов вероятность развития венозного тромбоэмболических осложнений в исследуемой группе больных женщин была более чем в 2 раза достоверно выше по сравнению с контрольной группой (Х2=5,0; Р=0,01; OR=2,1; 95% CI 1,08 – 4,106).
Таким образом, высокая частота полиморфизма 4G/5G гена ИАП-1 у обследованных пациенток с ПОНРП позволила нам рассматривать его в качестве важнейшего этиопатогенетического фактора развития акушерских осложнений у женщин, что диктует необходимость подбора оптимальной и безопасной терапии, направленной на компенсацию нарушений.
Вывод. Таким образом, полученные результаты могут свидетельствовать о доминирующей роли одновременного носительства аллелей наследственной тромбофилии “МТГФР С677Т+ИАПI 4G/5G”, как одного из ключевых факторов риска развития тромбозов. Продукты этих генов непосредственно или опосредованно могут влиять на патогенетические процессы развитие акушерских осложнений у беременных женщин. Координированное участие механизмов, вовлеченных в патогенез эндотелиальной дисфункции и активацию плазменного звена гемостаза, в формировании риска развития тромбоза и его осложнений, по-видимому, является характерным для случаев носительства мутаций в генах ФV свертывания крови и МТГФР. Однако необходимо подчеркнуть что, полученные нами результаты раскрывают лишь некоторые генетические аспекты возникновения акушерских осложнений у женщин. Для получения более полной картины участие генетических факторов в патогенезе акушерских осложнений, считаем необходимым исследовать полиморфизмы других генов наследственной тромбофилии, а также других систем и их сочетанное влияние на патогенетические процессы развития тромбоза и его осложнений в формировании наследственной предрасположенности к развитию ПОНРП у беременных женщин.
