Как известно, тромбоцитопатии представляют собой обширную группу заболеваний, возникающих в результате качественной неполноценности и нарушения функции кровяных пластинок - тромбоцитов. Именно с ней связано большинство кровоизлияний и кровотечений неясного генеза. Данная патология является довольно распространенной. Так, частота тромбоцитопатий в популяции составляет приблизительно 6,5-7% [3]. Среди наследственных геморрагических диатезов регистрируемые тромбоцитопатии занимают по частоте первое место - 36% от общего числа больных. Часто встречаются различные вторичные нарушения функции тромбоцитов, обусловленные гемобластозами, болезнями печени и почек, токсическими и лекарственными воздействиями, массивными переливаниями крови, ДВС-синдромом (синдромом диссеминированного внутрисосудистого свертывания крови), активизацией фибринолиза и многими другими причинами [1].
Диагностика и дифференцировка тромбоцитопатии базируются на комплексном исследовании системы гемостаза. Такие как определение функций кровяных пластинок, оценке содержания в них и реакции освобождения тромбоцитарных факторов и гранул, определении числа, размера, морфологии и ряда других свойств этих клеток, а также мегакариоцитов [5].
В патогенезе геморрагических диатезов особое место отводится состоянию метаболизма тромбоцитов. Нарушение функционирования этой системы, развивающееся при патологических процессах в организме, может определять клинику, характер течения и исход заболевания [3, 4].
Много исследований проведено по изучению различных аспектов метаболизма в клетках периферической крови при патологических состояниях [7, 11,12]. Наиболее информативными ферментами клеток периферической крови вполне обосновано считаются ключевые окислительно-восстановительные ферменты [4, 6]. В связи с этим показатели активности ферментов могут служить объективным критерием оценки метаболического состояния организма, эффективности проводимого лечения, прогноза.
Изучение метаболизма тромбоцитов возможно при цитохимическом исследовании активности внутриклеточных ферментов. Многими авторами [1, 2, 10] отмечено, что цитохимический метод определения активности ферментов тромбоцитов следует рассматривать как высокоинформативный, объективный и доступный способ оценки состояния тромбоцитарного звена системы гемостаза.
В тромбоцитах содержится кислая фосфатаза (КФ), сукцинатдегидрогеназа (СДГ), альфа-глицерофосфатдегидрогеназа (α-ГФДГ), лактатдегидрогеназа (ЛДГ). По данным исследований, у здоровых людей между отдельными ферментными системами существуют прямые корреляционные связи. Выявлена прямая зависимость между активностью митохондриальной α-ГФДГ и СДГ при степени достоверности коэффициента корреляции Р<0,01. Наличие тесной связи этих ферментов можно предполагать, учитывая близкую локализацию дегидрогеназ во внутренней мембране митохондрий [7]. Поскольку СДГ является одним из ферментов цикла трикарбоновых кислот, а α-ГФДГ представляет собой митохондриальный компонент α-глицерофосфатного шунта, возможно координация активностей этих ферментов отражает взаимодействие цикла Кребса и α-глицерофосфатного шунта. Ключевым ферментом гликолиза, участвующим в обратимой реакции превращения пировиноградной кислоты в молочную является лактатдегидрогеназа (ЛДГ).
Целью исследования явилось изучение состояния окислительно-восстановительных ферментов в тромбоцитах при тромбоцитопатиях.
Материалы и методы исследования. Всего под наблюдением находились 67 юношей. Из них 21 здоровых юношей – контрольная группа, 46 юношей - больные различной формой тромбоцитопатией. Наследственной формой заболевания страдали 23 юношей, приобретенной - 23 человек. Форма заболевания диагностировалась на основании клинико-анамнестических, лабораторно-гемостазиологических данных [5]. Цитохимические методы исследования ферментов тромбоцитов были основаны на образовании гранул формазана при реакции фермента с соответствующим субстратом в присутствии солей тетразолия (по методу Нарциссова Р.П. в модификации Островской Л.В.) [7,9].
Данные выражались в условных единицах (у.е.). Активность дегидрогеназ в тромбоцитах (при использовании в качестве акцептора паранитрофиолетового тетразолия) выражалась количеством гранул формазана в 50 клетках. Определение кислой фосфатазы было основано на реакции азосочетания. Активность фермента выражалась индексом Кеплоу (Kaplow).
Результаты исследования и их обсуждение. При анализе активности исследуемых ферментов выявлено достоверное повышение активности СДГ (на 27,8% по сравнению с контролем, p<0,001), ЛДГ (на 19,5% по сравнению с контролем, p<0,001) и КФ (на 47,3% по сравнению с контролем, p<0,001) у пациентов с приобретенной тромбоцитопатией (ПТ), тогда как активность α-ГФДГ была снижена (на 7,9% по сравнению с контролем, p<0,001).
Иная картина наблюдалась у больных с наследственной тромбоцитопатией (НТ). При этой форме активность СДГ снижалась на 14,7% по сравнению с контролем, (Р<0,001), что свидетельствует о снижении активности энергетических процессов в цикле Кребса. Причиной этого можно считать анемическую гипоксию и накопление в клетках продуктов пероксидации мембранных липидов и их предшественников - реактивных форм кислорода [7]. Активность α-ГФДГ также снижалась (на 13,9% по сравнению с контролем, p<0,001). Учитывая, что этот фермент катализирует в процессе гликолиза обратимую реакцию образования дигидрооксиацетонфосфата из α – глицерофосфата, являясь составной частью α – глицерофосфатного шунта, снижение его активности свидетельствует о нарушении синхронности процесса биологического окисления и гликолиза. Активность ферментов ЛДГ (на 8,3% по сравнению с контролем, p<0,001) и КФ (на 18,8% по сравнению с контролем, p>0,05) была выше контрольных значений (табл. 1).
Таблица 1. Ферментативная активность тромбоцитов у юношей с тромбоцитопатиями (у. е.)
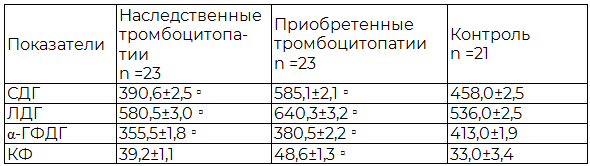
Примечание: □ - степень достоверности по сравнению с контрольной группой: Р<0,001.
Проведенные исследования показали значительное изменение ферментного профиля тромбоцитов, выраженное нарушение окислительно-восстановительных процессов у юношей с тромбоцитопатией. Так, активность СДГ достоверно снижена у больных с НТ (Р<0,001), но вместе с тем повышена у больных с приобретенными формами заболевания. Это свидетельствует о том, что в группе больных с НТ выражен дефицит энергообразования. Повышение же активности этого фермента в группе больных с ПТ свидетельствует о том, что компенсаторные возможности организма у них по выработке энергии, т.е. энергосинтетические возможности не исчерпаны. В связи с этим, в ответ на агрессивные факторы, обусловленные патологией, активность СДГ повышается с целью возмещения повышенных затрат энергии и нормализации нарушенных окислительно-восстановительных процессов.
Мы полагаем, что при тромбоцитопатии нарушения активности изученных ферментов связаны как с основным заболеванием, так и гипоксией, причем их появление, по мнению ряда авторов, предшествует функциональным нарушениям. Имеющиеся изменения в митохондриях тромбоцитов прогрессируют и закономерно приводят к нарушениям в них процессов биологического окисления, снижению интенсивности клеточного дыхания и энергетического обеспечения, к дефициту АТФ и развитию деструктивных процессов в клетке.
Подтверждением дисбаланса метаболизма тромбоцитов является повышение в них активности ЛДГ, конечного и обратимого продукта гликолитического распада глюкозы. Так, в тромбоцитах больных с НТ увеличивается активность лактатдегидрогеназы на 8,3% (Р<0,001) и на 19,5% в группе с ПТ (Р<0,001), что усугубляется с прогрессированием гипоксии. У больных с наследственной патологией активность этого фермента составила 580,5±3,0 у.е. (Р<0,001), а у больных с приобретенной патологией активность ЛДГ показала еще большее повышение (640,3±3,2 у.е., Р<0,001), что свидетельствует о глубокой дисфункции метаболизма тромбоцитов и о явной активации процессов анаэробного окисления в них [6].
О высокой способности тромбоцитов к окислительному фосфорилированию, и о том, что основную энергию тромбоциты получают в результате гликолиза, свидетельствуют работы Федотовой Г.Г. [10].
Проведенные нами исследования показали значительное нарушение окислительно-восстановительных процессов, а также процессов сопряженности окислительного фосфорилирования и гликолиза, о чем свидетельствует снижение активности α-ГФДГ в обеих группах. Так, в группе больных с наследственной патологией, этот показатель составил 355,5±1,8 у.е. (Р<0,001), а у больных с приобретенной патологией активность α-ГФДГ составила 380,5±2,2 у.е. (Р<0,001).
Более выраженное повышение активности КФ в группе больных с ПТ безусловно объясняется наличием у них часто рецидивирующих хронических заболеваний, которые благодаря выраженной интоксикации и прогрессирующим нарушениям метаболизма и явились основной причиной развития тромбоцитопатии. У больных с НТ этот показатель существенно не изменен, хотя тенденция к повышению активности КФ все же имеется (39,2±1,1 у.е., Р>0,05).
Выводы. Таким образом, изучение активности ряда ключевых окислительно-восстановительных ферментов в тромбоцитах периферической крови показало значительное нарушение их активности и метаболического потенциала, а также существенное снижение энергетических процессов в них, что, на наш взгляд, является одной из важнейших патогенетических причин нарушения функциональной активности тромбоцитов у больных тромбоцитопатией. Это обстоятельство диктует необходимость включения в комплексное лечение больных с тромбоцитопатией препаратов, корригирующих обменные процессы, как в целом, так и клеточный метаболизм, а также производящих детоксикационный эффект, что, безусловно, улучшит функциональную активность тромбоцитов и улучшит их гемостазиологические возможности.
