Актуальность. Преэклампсия (ПЭ) остается одной из основных причин материнской и перинатальной заболеваемости и смертности [1,9]. Согласно наиболее признанной гипотезе, формирование ПЭ происходит на ранних сроках беременности: ряд предрасполагающих факторов приводят к нарушению инвазии трофобласта, развитию ишемии плаценты с формированием эндотелиальной дисфункции, синдрома системного воспалительного ответа (ССВО) и полиорганной недостаточности [7,6,9].
На сегодняшний день ключевым звеном патогенеза ПЭ является эндотелиальная дисфункция [5,6,11]. В результате нарушения функции эндотелиальные клетки продуцируют прокоагулянты, вазоконстрикторы и факторы роста, что приводит к изменению баланса тромбогенных и тромборезистентных свойств, спазму сосудов. Гипоксия, которая развивается в тканях маточно-плацентарного комплекса на фоне нарушения кровотока, вызывает локальное повреждение эндотелия, которое в последующем приобретает генерализованный характер [1,6].
Процессы коагуляции и воспаления тесно связаны между собой и играют ключевую роль в развитии многих заболеваний. Активация свертывающей системы крови в ответ на воспаление служит защитным механизмом, однако при ССВО теряет свое адаптивное значение. При ССВО замыкается порочный круг процессов воспаления и коагуляции, которые, действуя в совокупности и взаимно активируя друг друга, формируют тяжелейшую клиническую картину вплоть до развития полиорганной недостаточности [6]. Роль активаторов эндотелия при ПЭ могут выполнять различные субстанции, в том числе эндотелиальные антитела, липопротеиды низкой плотности (ЛПНП), перекиси липидов, адгезивные молекулы, цитокины [6,9].
Таким образом, на сегодняшний день изучение показателей системы гемостаза и липидного статуса, как маркеров эндотелиальной дисфункции, несомненно, актуально, так как эти параметры могут быть использованы в качестве предикторов ПЭ и критериев ее тяжести.
Целью нашего исследования является изучение показателей системы гемостаза и липидограммы у беременных с умеренной и тяжелой ПЭ.
Материалы и методы исследования. Нами проведено исследование «случай-контроль» 44 беременных женщин, которые получали стационарное лечение в родильном доме Клиники ГБОУ ВПО ЮУГМУ Минздрава России. Критерием включения беременных в исследование явилось информированное согласие женщины. Критерии исключения: онкологические заболевания, ВИЧ-инфекция, туберкулез, тяжелая соматическая патология, психические заболевания, хронический алкоголизм, наркомания. План исследования соответствует законодательству РФ, международным этическим нормам и нормативным документам исследовательских организаций, а также одобрен этическим комитетом ГБОУ ВПО ЮУГМУ Минздрава РФ. Изучены особенности течения беременности и исходы родов. Клинико-лабораторное исследование всех беременных проводилось в третьем триместре беременности.
В зависимости от наличия/отсутствия ПЭ и степени ее тяжести [9] выделены: 1 группа (контрольная) – 14 женщин, течение беременности которых не осложнилось развитием ПЭ; 2 группа – 16 беременных с умеренной ПЭ; 3 группа – 14 пациенток с тяжелой ПЭ. Средний возраст женщин 1-й группы составил 27,00±1,67 лет, 2-й - 27,63±1,05, 3-й - 30,36±1,64.
У всех беременных, которые участвовали в исследовании, определены: Д-димер (Turbo D-Dimer – экспресс-метод) – твердофазный хемилюминесцентный иммуноферментный анализ (сэндвич) с использованием моноклональных мышиных антител к Д-димеру с использованием анализатора IMMULITE 2000 (DPC, США); протромбиновый индекс (ПТИ) - определение времени свертывания плазмы при добавлении тромбопластина и хлорида кальция (Тсоаg, Ирландия); антитромбин III - метод на основании использования синтетического хромогенного субстрата и инактивации фактора Ха («Технология-Стандарт», Барнаул); активированное частичное тромбопластиновое время (АЧТВ) – коагулометрический метод с использованием синтетических фосфолипидов с добавлением тонкоизмелченного кремния в качестве активатора («Технология-Стандарт», Барнаул); фибриноген - оптический метод, регистрирующий образование сгустка при добавлении тромбина, имидазоловый буфер (Тсоаg, Ирландия); XIIа-зависимый фибринолиз (мин) – мануальный метод («Технология-Стандарт», Барнаул); эуглобулиновый фибринолиз (мин) – мануальный метод («Технология-Стандарт», Барнаул); растворимые фибрин-мономерные комплексы (РФМК) – мануальный метод с добавлением в плазму крови раствора фенантролина («Технология-Стандарт», Барнаул); оценка агрегации тромбоцитов на оптическом агрегометре ChronoLOG (США): с аденозин-5/-дифосфорной кислотой динатриевой солью (АДФ) 5 мкг/мл («Технология-Стандарт», Барнаул); коллегеном (лиофино высушенная фракция из богатой коллагеном ткани человека) 20 мг/мл. («Технология-Стандарт», Барнаул); адреналином (эпинефрин) 10 мкг/мл («Технология-Стандарт», Барнаул); ПТИ - определение времени свертывания плазмы при добавлении тромбопластина и хлорида кальция (Тсоаg, Ирландия); фибриноген - оптический метод, регистрирующий образование сгустка при добавлении тромбина, имидазоловый буфер (Тсоаg, Ирландия); триглицериды (ТГ), холестерин общий (ХО) - колориметрический ферментативный энзиматический метод (Human, Германия); липопротеиды высокой плотности (ЛПВП) - колориметрический ферментативный энзиматический метод с предварительным осаждением ЛПНП и хиломикронов (Human, Германия). Количество тромбоцитов определяли по общепринятой методике в сухих мазках крови, окрашенных по Романовскому-Гимзе, подсчет клеток проводился в 5 полях относительно 1000 эритроцитов.
Все статистические расчеты были выполнены с помощью пакетов программ: SPSS 12.1, Statistica for Windows 6.0, STADIA 6.3 Prof. Для определения средних тенденций использовали методы описательной статистики с получением оценок математических ожиданий, дисперсий и мод всех переменных во всех обследуемых группах. Для оценки различий между группами обследуемых применен аппарат проверки статистических гипотез с использованием критерия Манна-Уитни при уровне значимости критерия 0,05. Для изучения степени корреляционной зависимости между показателями использовался непараметрический корреляционный анализ с расчетом коэффициента непараметрической корреляции Спирмена.
Результаты исследования. При изучении числа тромбоцитов у обследованных нами беременных оказалось (табл. 1), что у пациенток с ПЭ данный показатель был достоверно ниже в сравнении с контрольной группой, наиболее низким он был при тяжелой ПЭ. По данным ряда авторов, при ПЭ время жизни тромбоцитов существенно снижено, что может способствовать развитию тромбоцитопении. Кроме того, повышение размеров тромбоцитов при ПЭ также свидетельствует об их ускоренном метаболизме и быстром разрушении [6].
Таблица 1. Показатели гемостаза беременных контрольной и клинических групп
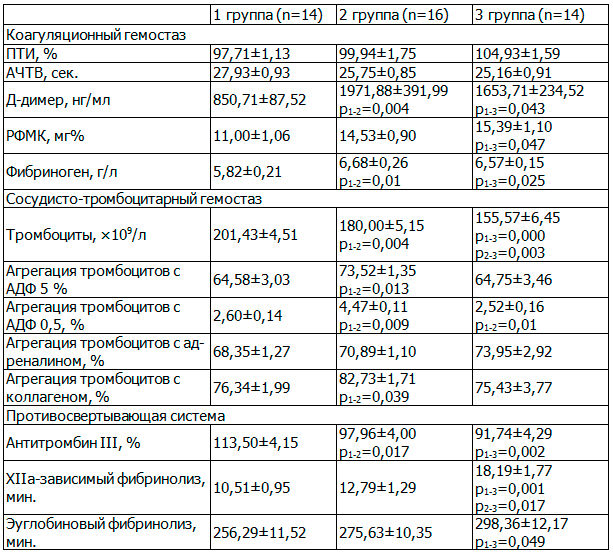
Примечание: здесь и далее использован критерий Манна-Уитни.
Нами установлено (табл. 1), что при умеренной ПЭ повышена индуцированная (с АДФ, адреналином, коллагеном) агрегация тромбоцитов в сравнении с нормативными показателями во время беременности, показатели агрегация тромбоцитов с АДФ и коллагеном были статистически значимо выше аналогичных контрольной группы. В сравнении с нормой при беременности при тяжелой ПЭ зарегистрировано повышение агрегации тромбоцитов с адреналином. Обращает на себя внимание отсутствие достоверных отличий показателей агрегации тромбоцитов пациенток с тяжелой ПЭ и беременных группы контроля. Агрегация тромбоцитов с АДФ 0,5 при тяжелой ПЭ оказалась достоверно меньше в сравнении с аналогичным показателем при умеренной ПЭ. По литературным данным, при развитии ПЭ кроме тромбоцитопении с выраженным анизоцитозом, обнаружены повышение количества функционально активных тромбоцитов, усиление их адгезивно-агрегационной способности [17]. Благодаря адгезии активированных лейкоцитов к тромбоцитам происходит запуск цитокинового каскада, активируются как система гемостаза, так и воспалительный ответ [6]. В условиях системного воспаления под воздействием тромбина, эндотоксина, цитокинов происходит активация тромбоцитов и выброс стимуляторов агрегации [6]. Считается, что гиперагрегация тромбоцитов с АДФ говорит о повышении их первичной агрегации, гиперагрегация с ристомицином - о повреждении субэндотелия сосудов, а с коллагеном - характеризует фазу секреции (нарастание количества активированных кровяных пластинок) [8]. При тяжелой преэклампсии и эклампсии развивается тромбоцитопатия потребления, характеризующаяся гипоагрегацией и тромбоцитопенией [6]. Снижение агрегационных и адгезивных свойств этих клеток связано с падением чувствительности пластинок к индукторам, а также со снижением продукции тромбоцитов [13].
Маркерами внутрисосудистой активации системы гемостаза являются РФМК, комплекс тромбин-антитромбин III, продукты деградации фибрина, D-димер, значительно превышающие аналогичные показатели у женщин с неосложненным течением беременности [3,4,6,16]. Согласно результатам нашего исследования, при ПЭ в сравнении с группой контроля отмечено увеличение маркеров активации гемостаза (таблица 1): показатель Д-димер был повышен при умеренной и тяжелой ПЭ, РФМК – только при тяжелой ПЭ. По данным Макацария А.Д. (2011) уровень Д-димера является прогностическим признаком нарастания тяжести ПЭ [6]. Portelinha A. et al. (2009) выявили повышение уровня Д-димера у женщин, анамнез которых был отягощен наличием ПЭ [18]. Dusse LM et al. (2013) зарегистрировали повышение показателя Д-димер только при тяжелой ПЭ [16]. Однако согласно результатам исследования Xiong Y. et al. (2011) в сравнении с нормальной беременностью при ПЭ показатель Д-димер снижается [21]. Мы не выявили достоверных отличий данного показателя при ПЭ разной степени тяжести.
Согласно данным современной литературы уровень фибриногена является одной из лабораторных детерминант, наиболее значимо связанных с осложненным течением беременности [6,7,11]. Действительно, уровень фибриногена у беременных с ПЭ (табл. 1) оказался выше физиологической нормы при беременности и превышал аналогичный показатель контрольной группы. Установлено, что по мере увеличения тяжести ПЭ нарастает уровень гиперфибриногенемии. Фибриноген способствует формированию воспалительного ответа - стимулирует экспрессию провоспалительных цитокинов TNF-α и IL-1β на мононуклеарных клетках и активируют продукцию хемокинов эндотелиальными клетками и фибробластами.
В сравнении с контрольной группой (табл. 1) при умеренной ПЭ отмечено снижение активности АТ III. При тяжелой ПЭ кроме снижения антитромбина III был замедлен эуглобулиновый и XIIа-зависимый фибринолиз. Согласно данным литературы, АТ III обладает противовоспалительным действием: напрямую связывается с лейкоцитами и способствует снижению экспрессии рецепторов цитокинов и хемокинов, активирует экспрессию противовоспалительного цитокина IL-10. При развитии ССВО наблюдается уменьшение активности всех естественных антикоагулянтов. Снижение уровня АТ III при системном воспалении связано с повышенным потреблением антикоагулянтных факторов в условиях активации коагуляционного каскада, разрушением под действием эластазы (продукта активированных нейтрофилов), а также с нарушением его синтеза, что является проявлением негативной острофазовой реакции при воспалении [6]. Результаты нашего исследования о снижении уровня АТ III при ПЭ согласуются с данными Xiong Y. et al. (2011) [21], Demir C. et al. (2010) [14].
Таким образом, при ПЭ отмечена активация тромбоцитарного и прокоагуляционного звеньев системы гемостаза с развитием хронического ДВС-синдрома, который является одной из главных причин интравиллезного тромбоза, нарушения маточно-плацентарного кровотока, возникновения плацентарной и полиорганной недостаточности [12].
Согласно данным литературы, при ПЭ содержание ТГ, неэтерифицированных жирных кислот, ХО, ЛПОНП, ЛПНП значительно выше, а уровень ЛПВП ниже, чем при неосложненной беременности [6]. Ишемия плаценты, активированные лейкоциты, изменения липидного спектра, гипергомоцистеинемия, характерные для беременных с ПЭ, приводят к развитию оксидативного стресса в организме матери, который неотделим от процессов воспаления [6]. Свободно-радикальные реакции с участием миелопероксидазы превращают ЛПНП в окисленные, что приводит к активации иммунной системы с запуском воспалительной реакции [1,2,19], что способствует нарастанию степени тяжести ПЭ [1,6]. Показано, что белок острой фазы С-реактивный белок (СРБ) способен специфически связываться с модифицированными частицами ЛПНП и ЛПОНП [10,19], а связанный СРБ способен активировать комплемент [20]. При ПЭ уровень свободных жирных кислот увеличен уже с 15-20 недель беременности, до начала ее клинических проявлений [1]. Повышенный уровень свободных жирных кислот способствует уменьшению уровня простоциклина, снижению противотоксических свойств альбумина за счет связывания с ним [1]. Свободные жирные кислоты обладают высокой токсичностью и способностью к образованию свободных радикалов кислорода [6]. Отмечено, что при ПЭ жирные кислоты активно поглощаются эндотелиальными клетками и эстерифицируются в ТГ [1], которые приводят к запуску воспалительного ответа, активируют иммунную систему, повышают риск тромбообразования с повреждением клеток и тканей [2,15].
Мы изучили показатели липидограммы при ПЭ (табл. 2).
Таблица 2. Показатели липидограммы у беременных контрольной и клинических групп
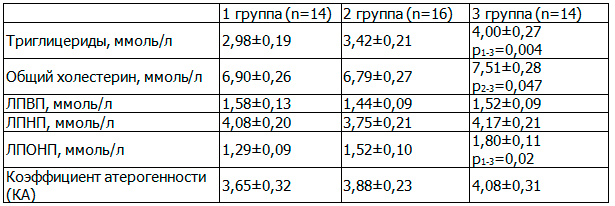
Установлено, что показатели триглицеридов и ЛПОНП у пациенток с тяжелой ПЭ оказались достоверно выше, чем в контрольной группе. Кроме того, в этой группе уровень общего холестерина превышал аналогичный показатель при умеренной ПЭ.
Мы решили изучить степень корреляционной связи (табл. 3) показателей системы гемостаза и липидограммы.
Таблица 3. Корреляционные связи показателей системы гемостаза и липидограммы беременных контрольной и клинических групп
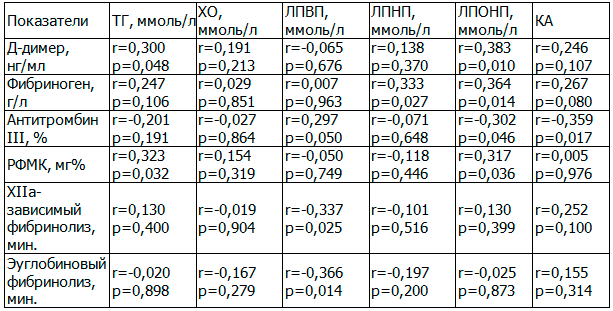
Провоспалительные показатели липидограммы (ТГ, ЛПНП и ЛПОНП) имеют положительные корреляционные связи с уровнем Д-димера, РФМК, фибриногена и отрицательные корреляционные связи с активностью АТ III. Установлены положительные корреляции ЛПВП (эффективный антиоксидант с противовоспалительными свойствами) с показателем АТ III и отрицательные с показателями активности фибринолиза, что свидетельствует о возможности использования указанных параметров в качестве маркеров тяжести ПЭ.
Результаты нашего исследования еще раз подтверждают тесную взаимосвязь нарушений липидного обмена, оксидативного стресса, изменений в системе гемостаза, эндотелиальной дисфункции и воспалительного ответа, играющих ключевую роль в развитии и нарастании тяжести ПЭ. Таким образом, показатели коагуляционного и сосудисто-тромбоцитарного гемостаза, противосвертывающей системы и липидограммы можно использовать в качестве критериев тяжести ПЭ.
Выводы
- При умеренной ПЭ зарегистрировано снижение количества тромбоцитов и повышение их индуцированной (с АДФ, адреналином, коллагеном) агрегации, выявлены маркеры активации гемостаза (увеличение Д-димера, фибриногена, снижение активности антитромбина III).
- Тяжелая ПЭ в сравнении с умеренной характеризуется более выраженным снижением количества тромбоцитов со склонностью к дезагрегации (повышение агрегации с адреналином, снижение с АДФ 0,5), значительными гиперкоагуляционными сдвигами (увеличение Д-димера, РФМК, фибриногена, снижение активности антитромбина III, замедление эуглобулинового и XIIа-зависимого фибринолиза) и дислипидемией провоспалительного характера (повышение уровня общего холестерина, триглицеридов, ЛПОНП).
- Провоспалительные показатели липидограммы (триглицериды, липопротеиды низкой и очень низкой плотности) имеют положительные корреляционные связи с уровнем Д-димера, РФМК, фибриногена и отрицательные корреляционные связи с активностью антитромбина III. Установлены положительные корреляции уровня липопротеидов высокой плотности с показателем антитромбина III и отрицательные с показателями активности фибринолиза, что свидетельствует о возможности использования указанных параметров в качестве маркеров тяжести ПЭ.
