Усиление внутрисосудистого свертывания крови наблюдается при различных формах патологии инфекционной и неинфекционной природы [8, 13, 20].
Развитие острого воспаления сопровождается сложным взаимодействием клеток крови, эндотелия сосудов, элементов макрофагальной системы различных тканей организма и др. Клеточные и сосудистые реакции в очаге воспаления и целостном организме приводят к усилению продукции цитокинов, изменению активности ферментных систем плазмы крови, в том числе факторов системы свертывания и фибринолиза [6, 8, 13, 20, 23].
Следует отметить, что на начальных этапах развития воспалительного процесса внутрисосудистое свертывание крови может носить защитно-приспособительный характер, поскольку тромбообразование способствует реализации ограничительной роли очага воспаления и препятствует распространению патогенной микрофлоры, токсинов, продуктов деструкции тканей из очага воспаления по всему организму. В тоже время нарушения регионарного кровообращения и микроциркуляции в воспаленном органе сопровождается недостаточным поступлением в очаг воспаления гуморальных бактерицидных факторов, биологически активных веществ, лекарственных препаратов, нарушением удаления из очага метаболитов, токсинов. Застрой крови в очаге воспаления усугубляет реакции дезадаптации и повреждения за счет развития циркуляторной гипоксии, энергодефицита, декомпенсированного метаболического ацидоза, электролитных расстройств и др. [1,5,19].
Таким образом, нарушения коагуляционного потенциала крови при развитии острого воспалительного процесса, в том числе, в придатках матки, может оказать значительное влияние на тяжесть течения, степень распространения патологических изменений в органах и тканях, прогноз развития осложнений и исход заболевания.
Активация тромбоцитарно-сосудистого и коагуляционного гемостаза изучена и при различных формах акушерско-гинекологической патологии (гестозы, злокачественные, воспалительные поражения женских половых органов, невынашивание беременности, мертвый плод и др.) [4,10,12,14,16,21].
Однако до настоящего момента отсутствуют систематизированные сведения о патогенетической взаимосвязи нарушений коагуляционного потенциала крови и развития системного воспалительного ответа при остром сальпингоофорите.
В связи с этим целью работы явилось изучение нарушений механизмов коагуляционного гемостаза, их патогенетической взаимосвязи с изменением содержания провоспалительных цитокинов, С3-, С4-фракций комплемента в периферической крови женщин при остром сальпингоофорите.
Материалы и методы. Для решения поставленной задачи проведено одномоментное, пассивное, проспективное неконтролируемое исследование. В основную группу вошли 35 пациенток в возрасте от 18 до 40 лет с острым сальпингофоритом. Группу сравнения составили 30 практически здоровых небеременных женщин, сопоставимых по возрасту с женщинами основной группы исследования. Критериями включения в основную группу исследования были результаты клинического, лабораторно-инструментального и ультразвукового обследования, характерные для острого сальпингоофорита. Критериями исключения из исследования были беременность, эндокринные заболевания, злокачественные новообразования, легочная и сердечная недостаточности у пациенток.
Исследования пациенток основной группы проведены на базе гинекологических отделений №1 и №2 ГУЗ «Областная клиническая больница» г. Саратова.
Оценка интегративных показателей состояния коагуляционного гемостаза, фибринолиза, цитокинового статусов женщин основной группы была проведена в момент поступления их в стационар до начала лечения на фоне выраженных клинических проявлений патологии.
Показатели коагуляционного гемостаза и фибринолиза исследованы коагулометрическими методами посредством коагулометра серии Thrombotimer фирмы Behnk-Elektronik (Германия), а также общепринятыми мануальными методами с применением реагентов фирмы «Ренам» (Россия) [2,11,17]. Цитокиновый статус оценивали по содержанию IL-1β и TNF-α в сыворотке периферической крови пациенток методом иммуноферментного анализа с использованием тест-систем фирмы Bender Medsystems (Австрия). Содержание С-3 и С-4 фракций комплемента в сыворотке крови определяли иммунотурбодиметрическим методом количественного определения с использованием реактивов фирмы Sentinel (Италия) [24,25].
Статистическая обработка результатов исследований была проведена с использованием пакета Statistica 6. Нормальность распределения вариационных рядов (соответствие закону Гаусса) проверяли с помощью критериев согласия Колмогорова-Смирнова и Шапиро-Вилкса. В качестве точечной оценки характеристики центра группирования значений случайной величины использовали медиану с вычислением 95% доверительного интервала, интерквартильные размахи (25-й и 75-й процентили). Сравнение двух независимых (несвязанных) групп осуществлялось с помощью непараметрического U-критерия Манна-Уитни для анализа малых выборок, позволяющего проверить гипотезу о равенстве средних рангов, а также двухвыборочного критерия Колмогорова-Смирнова для проверки гипотезы о принадлежности исследуемых групп к одной и той же генеральной совокупности. Если р<0,05, то нулевая гипотеза об отсутствии различий групп отклонялась и принималась альтернативная гипотеза о существовании различий групп с уровнем статистической значимости «р» [15].
Результаты и их обсуждение. Как показали результаты исследований, в период выраженных клинических проявлений острого сальпингоофорита возникает активация внутреннего механизма формирования протромбиназы. На это указывает укорочение активированного частичного тромбопластинового времени свертывания (АЧТВ) по сравнению с группой здоровых женщин (табл. 1).
Одновременно установлено возрастание протромбинового индекса, свидетельствующее об уменьшении протромбинового времени свертывания плазмы крови пациенток по сравнению с аналогичным показателем контрольной группы, что указывает на избыточную активацию внешнего механизма формирования протромбиназы, в частности VII плазменного фактора при остром сальпингоофорите (табл. 1).
Наряду с нарушением первой фазы свертывания крови у больных с клиническими проявлениями острого сальпингоофорита было установлено укорочение тромбинового времени свертывания плазмы, которое характеризует конечный этап процесса свертывания – превращение фибриногена в фибрин под действием тромбина.
Известно, что показатель тромбинового времени во многом взаимосвязан с концентрацией фибриногена в плазме и наличием продуктов деградации фибрина [2,9].
Как оказалось, активация прокоагулянтных механизмов у больных с острым сальпингоофоритом сопровождалось увеличением содержания в плазме крови фибриногена, продуктов паракоагуляции – растворимых фибрин-мономерных комплексов (РФМК), а также Д-димеров - продуктов расщепления поперечно-сшитого нерастворимого фибрина (табл. 1). В то же время не обнаружено значительных изменений активности XIIа- калликреин-зависимого фибринолиза (табл. 1).
Таблица 1. Изменения показателей коагуляционного гемостаза и активности системы фибринолиза у больных с острым сальпингоофоритом
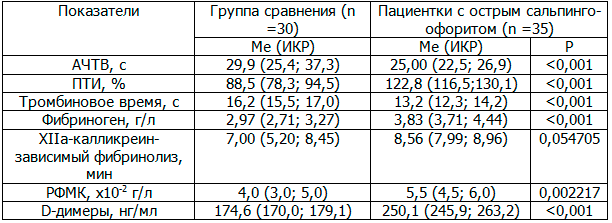
Примечание: здесь и далее Ме - медиана, ИКР – интерквартильный размах (нижний и верхний квартили - 25%; 75%); р – относительно группы сравнения.
До настоящего момента механизмы сдвигов коагуляционного потенциала крови у больных с острым сальпингоофоритом остаются в значительной мере неизученными.
Из работ отечественных и зарубежных авторов известно, что провоспалительные цитокины обладают способностью изменять адгезивно-агрегационные свойства тромбоцитов, эритроцитов, инициировать экспрессию эндотелием факторов, участвующих в регуляции процесса свертывания крови и активности фибринолиза [3,19].
Так, важнейшим регулятором сосудисто-тромбоцитарного гемостаза, свертывания крови и фибринолиза является IL-1β, который ингибирует образование дезинтегрина, металлопротеиназы эндотелиальными клетками и гепатоцитами, увеличивает содержание стимуляторов агрегации, прокоагулянтов, ингибиторов фибринолиза, в частности фактора Виллебранда и фактора активации тромбоцитов [7,18].
IL-1β и TNF-α активируют процесс свертывания крови, стимулируя экспрессию тканевого фактора на эндотелиоцитах и моноцитах, препятствуя образованию тромбомодулина, уменьшая активирующие влияния на протеин С [19].
В связи с этим было целесообразным выяснить, не выполняют ли провоспалительные цитокины роль посредников, обеспечивающих реализацию прокоагулянтных эффектов при остром воспалении придатков матки. Для частичного решения этого вопроса исследовано содержание IL-1β, TNF-α в периферической крови женщин в период выраженных клинических проявлений острого сальпингоофорита.
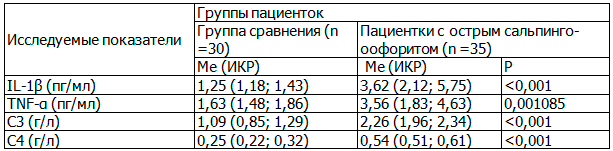
Как показали результаты, у женщин с острым воспалительным процессом в придатках матки до начала комплексного лечения было обнаружено значительное увеличение содержания провоспалительных цитокинов в плазме крови. Так, уровень IL-1β превышал аналогичный показатель плазмы крови женщин группы сравнения в 2,9 раза (p =0,000…), уровень TNF-α — в 2,2 раза (р=0,001085) (табл. 2).
Обнаруженное нами увеличение уровней IL-1β и TNF-α в крови больных женщин свидетельствует о том, что в условиях инфекционного воспалительного процесса в придатках матки происходит локальная и системная активация антиген-стимулированных макрофагов, NK-клеток, лимфоцитов, нейтрофилов и других клеток – продуцентов провоспалительных цитокинов.
Полученные нами данные об одновременной активации внешнего и внутреннего пути формирования протромбиназной активности, а также превращения фибриногена в фибрин и увеличение уровней IL-1β и TNF-α в плазме крови больных свидетельствуют о том, что указанные провоспалительные цитокины стимулируют прокоагулянтные сдвиги в период выраженных клинических проявлений острого сальпингоофорита.
Одновременно у больных с острым сальпингоофоритом была обнаружена активация системы комплемента, что подтверждалось значительным увеличением содержания в сыворотке крови пациенток С3-фракции – в 2,1 раза (p<0,001), 4-фракции – в 2,2 раза (p <0,001) по сравнению с аналогичными показателями здоровых женщин (табл. 2).
Таблица 2. Показатели содержания провоспалительных цитокинов и С3, С4-фракций системы комплемента в сыворотке крови пациенток с острым сальпингоофоритом
Как известно, в очаге острого воспаления происходит закономерная активация системы комплемента, обусловленная включением классического и альтернативного каскадов, тесно взаимосвязанных с активацией XII фактора Хагемана, калликреин-кининовой системы, тромбоцитов, образованием иммунных комплексов и т.д. В зоне альтерации очага острого воспаления развивается метаболический ацидоз, что сопровождается активацией С3-фракции и усилением свертывания крови по внутреннему механизму [5,8,9].
При развитии воспаления IL-1 и TNF-α также поддерживают процессы активации комплемента, обеспечивая выброс из моноцитов, макрофагов и эндотелиальных клеток ингибитора активатора плазминогена, тканевого фактора, что сопровождается агрегацией тромбоцитов [22].
Протеолитические ферменты системы комплемента стимулируют выделение биологически активных веществ из тромбоцитов, микро-, макрофагов, тучных клеток, вызывают ретракцию эндотелиальных клеток, что способствует адгезии и агрегации тромбоцитов на обнаженном коллагене сосудистой стенки. Активированные тромбоциты и лейкоциты замыкают порочный круг, индуцируя образование новых порций активных фракций комплемента, в частности С3а [3].
Анализ полученных данных позволяет сделать вывод о патогенетической взаимосвязи повышения уровней провоспалительных цитокинов IL-1β и TNF-α, С3-, С4-фракций комплемента и прокоагулянтных сдвигов в острый период воспалительного процесса в придатках матки.
Заключение:
- Выявлена патогенетическая взаимосвязь между накоплением IL-1β, TNF-α, С3-, С4-фракций системы комплемента и активацией прокоагулянтных механизмов в крови женщин, страдающих острым сальпингоофоритом.
- Система комплемента может выступать связующим патогенетическим звеном между сдвигами цитокинового статуса и активацией механизмов коагуляционного гемостаза на этапе выраженных клинических проявлений острого воспалительного поражения придатков матки.
- Определение содержания в сыворотке крови уровней IL-1β, TNF-α, С3-, С4-фракций комплемента у больных с острым сальпингоофоритом может быть использовано для прогнозирования развития и своевременной коррекции сдвигов коагуляционного потенциала крови, что расширит возможности успешного выбора адекватной лечебной тактики и своевременного предупреждения развития осложнений воспалительного процесса.
