Введение. Кровотечение является грозным осложнением, а в ряде случаев и фатальным как при оперативных вмешательствах, так и при соматической патологии, ранениях и механических травмах.
Отсутствие эффективных способов гемостаза нередко ограничивает возможности хирургического способа лечения и может служить причиной смерти больного от профузного кровотечения в интраоперационном, а также в раннем послеоперационном периодах [1-4].
В хирургии таза ранение магистральных сосудов приносит меньше хлопот, нежели кровотечение из пресакрального венозного сплетения.
Для остановки такого вида кровотечения используют, как правило, механические (тугая тампонада зоны крестца через промежностную рану баллонами и компрессами, наложение кровоостанавливающих «кнопок», клипс, гвоздей; электрокоагуляция, аргон) и биологические способы (сварка фрагмента сальника или мышцы, использование комбинированных рассасывающихся гемостатических желатиновых губок, цианакрилатного клея и их производных, окисленной целлюлозы, коллагена), или их сочетания. Однако данные методы имеют свои недостатки, такие как низкая надежность, большая кровопотеря и продолжительность процедуры [5-16].
Новым эффективным методом остановки кровотечения является использование пористых пластин из никелида титана.
Цель исследования. В условиях эксперимента описать гемостатический механизм при использовании пористых пластин из никелида титана.
Материалы и методы. В качестве материала для изготовления пористой пластины использовался сплав на основе никелида титана, приготовленный методом самораспространяющегося высокотемпературного синтеза (СВС).
Эксперимент проводился на беспородных половозрелых белых крысах массой 200-250 г.
Уход за экспериментальными животными и их содержание в условиях вивария были стандартными и соответствовали требованиям приказов “Санитарные правила по устройству, оборудованию и содержанию вивариев” No1045–73 от 06.04.1973, а также No1179 от 10.10.1983 МЗ СССР, No267 от 19.06.2003 МЗ РФ, “Правилам по обращению, содержанию, обезболиванию и умерщвлению экспериментальных животных”, утвержденным МЗ СССР (1977) и МЗ РСФСР (1977), принципам Европейской конвенции (Страсбург, 1986) и Хельсинкской декларации всемирной медицинской ассоциации о гуманном обращении с животными (1996) [17-18].
Под общей анестезией выполнялась лапаротомия, рассекалась брюшина малого таза ниже бифуркации общих подвздошных сосудов, параллельно прямой кишке слева. Искусственно травмировались ветви хвостовой вены, в зону создаваемого кровотечения после осушивания устанавливалась пластина среднепористого никелида титана (с размером пор 300 - 450 мкм), с проницаемостью 12∙10-9, площадью 0,8 -1,2 см2. Производилось механическое прижатие пластины к крестцовым позвонкам в течение 2-3 мин до остановки кровотечения. Осуществлялся контроль на эффективность гемостаза (отсутствие подтекания крови из-под пластины), и надежность фиксации импланта (пинцетом). Вывод из эксперимента проводился равными партиями в сроки: 1сут, 1 нед (что важно для оценки риска отсроченных\поздних кровотечений)
Проводилась электронная микроскопия с исследованием поверхности пластины, ее слома для определения заполнения пористой структуры тканью. Светооптической микроскопии подвергались ткани вокруг пластины после ее эксцизионного извлечения с окраской гематоксилином Гарриса и эозином. Для выявления коллагеновых волокон и оценки их зрелости дополнительно окрашивали по Mallory
Результаты и обсуждение. При электронной микроскопии - к концу 1 суток эксперимента помимо свежих эритроцитарных масс, наличие которых обусловленно извлечением пластины из тела животного, на поверхности и, особенно, в порах пластины, обнаружены рыхлые паутинообразные тяжи фибрина со склеенными слабо и четко контурируемыми эритроцитами (рис.1).

Рис. 1. Электронная микроскопия поверхности пластины при увеличении *1000 через 1 сут эксперимента. На поверхности и, особенно, в порах пластины, определяются рыхлые паутинообразные тяжи фибрина со склеенными эритроцитами.
При окраске по Mallory в сгустке фибрин представлен массами бледно сиреневыми мелкозернистыми массами и светло-голубыми тонкими переплетающимися волокнами (рис. 2.). В соединительной ткани, вдоль сосудов встречается много лейкоцитов, среди которых преобладают полиморфноядерные. Их количество около сгустка больше, чем в других участках.
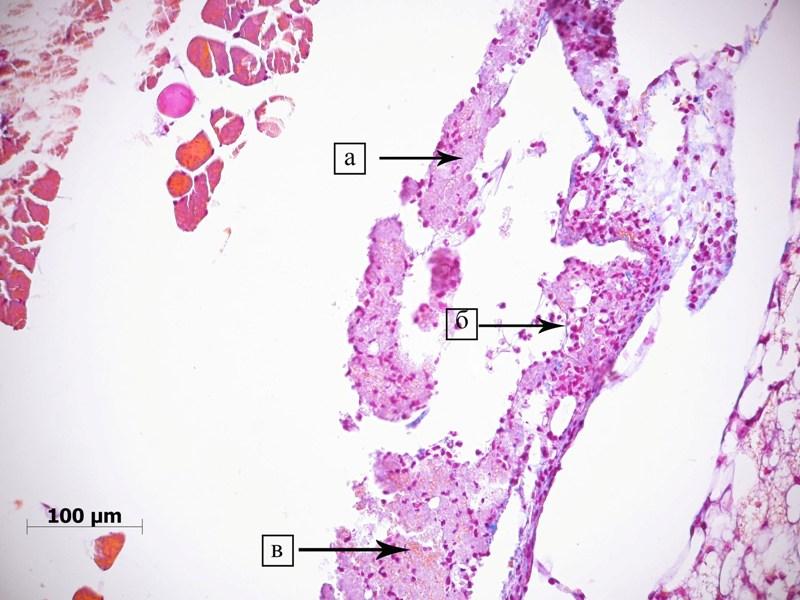
Рис. 2. Мышцы таза крысы после удаления пористого имплантата из никелида титана в 1 сутки эксперимента. Сгусток, сформировавшийся на поверхности имплантата. Сгусток образован преимущественно фибрином (а), лейкоцитами (б) и небольшим количеством эритроцитов (в). Окраска по Mallory.
Таким образом, через 1 сутки после «манипуляции», в месте имплантации формируются смешанные кровяные свертки. Наблюдаются признаки воспаления в виде венозного застоя (гиперемии) и воспалительного инфильтрата.
К концу 1 недели идет организация сгустка, при этом развивается выраженная экссудативная реакция. В порах пластины тяжи фибрина более оформленные, толстые со слабо контурируемыми и бесформенными эритроцитами (рис.3).

Рис. 3. Электронная микроскопия слома пластины при увеличении *1000 через 1 нед. эксперимента. Тяжи фибрина более оформленные.
Наблюдаются изменения и в сгустке. Он становится более рыхлым, лейкоцитов в нем меньше, чем на предыдущем сроке. Фибрин представлен оформленными переплетающимися нитями. (рис 4.)
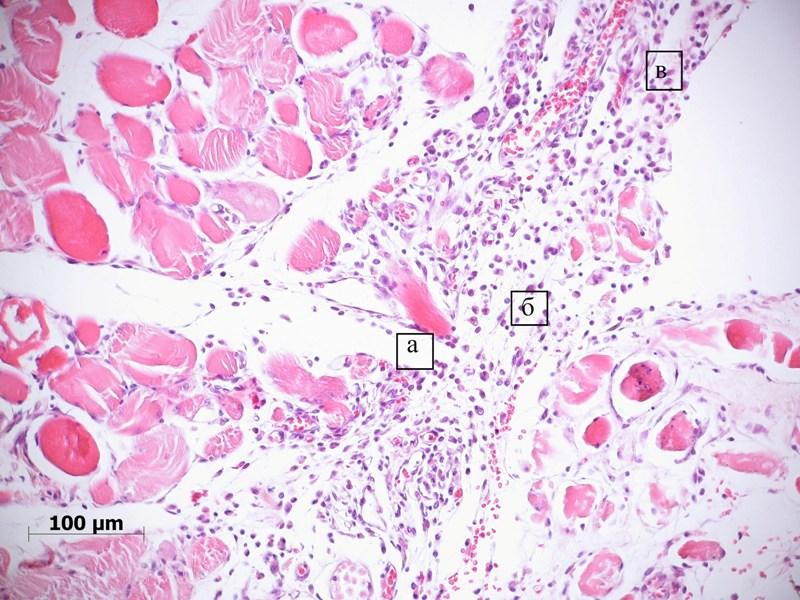
Рис. 4. Мышцы таза крысы после удаления пористого имплантата из никелида титана на 7-е сутки эксперимента. Врастание молодой соединительной ткани со стороны эндомизия в сторону имплантата (а). Выраженный лейкоцитарный инфильтрат (б) и гиперемия сосудов (в) в рыхлой соединительной ткани. Окраска гематоксилином и эозином.
Таким образом, к концу 1 недели наблюдаются признаки организации сгустка, при этом развивается выраженная экссудативная воспалительная реакция.
Обсуждение. Объемные трехмерные пористые элементы являются наиболее перспективными биоконструкциями. Они имеют оптимальную физико-химическую поверхность, обеспечивать начальную адгезию необходимого количества клеток, большое поровое пространство, адекватный размер пор и необходимое распределение пор по размерам для стимуляции пролиферации клеток и повышения их жизнеспособности. Что особо важно, имеют взаимосвязанную открытую (проникающую) поровую систему для обеспечения питания и вывода метаболитов [19].
Принцип 3D-скаффолдов заложен и в нашем методе остановки венозного кровотечения, основанной на всех уникальных свойствам пористого-проницаемого сплава на основе никелида титана: адгезия в зоне кровотечения, капиллярность и смачиваемость кровью (адсорбция белков и активация тромбоцитов), созревание сгустка и его ретракция в порах пластины с дополнительной самофиксацией, биоинертность и долговечность [20-23].
Выводы:
Исходя из физико-технических свойств используемого материала, а также полученных морфологических данных после имплантации пластин в зону кровотечения из пресакрального венозного сплетения можно утверждать следующее:
- Пористый материал из никелида титана обладает собственными адгезивными свойствами.
- Пластина хорошо смачивается жидкими средами организма, позволяя тканевой жидкости и эритроцитам быстро проникать вглубь, за счет регулируемых в ходе синтеза распределения пор по размерам.
- Непосредственно в пористой структуре имплантата образуются сгустки крови.
- Формирующиеся в порах имплантата никелида титана сгустки крови организуются с образованием рыхлых волокон фибрина к концу 1 суток после имплантации, благодаря чему пластина дополнительно самофиксируется на участке кровотечения. Все это обеспечивает надежный гемостаз и снижает риск отсроченного кровотечения в этой области. Формирование более зрелых волокон фибрина выявляется к концу 1 недели после имплантации.
Авторы заявляют об отсутствии финансирования при проведении исследования.
Авторы заявляют об отсутствии конфликта интересов.
