Вирус папилломы человека (ВПЧ) представляет собой одну из самых распространенных в мире групп вирусов, поражающих кожу и слизистые оболочки организма. Выявлено более 120 типов ВПЧ. Семейство состоит из вирусов «низкого онкогенного риска», связанных с доброкачественными новообразованиями, например бородавками и папилломами, и вирусов 16 и 18 «высокого онкогенного риска», вызывающих онкологические заболевания шейки матки в 80% случаях[8].
Папилломавирусная инфекция (ПВИ), вызываемая вирусом папилломы человека, - одна из наиболее часто встречающихся вирусных инфекций у детей, что определяет актуальность изучения папилломавирусной инфекции у детей [3].
Многообразие форм клинического проявления папилломавирусной инфекции связано с ткане- и типоспецифичностью вируса. Как известно определенный тип вируса папилломы поражает специфичную для него ткань-мишень. В связи с этой особенностью ВПЧ - инфекцию дифференцируют в соответствии с локализацией поражений: кожные и генитальные, а степень их выраженности зависит от индивидуальных особенностей ребенка. Причина клинической манифестации этой инфекции и ее рецидивирующего течения – наличие нарушений в иммунной системе.
В последнее время были предприняты значительные усилия для выяснения роли иммунной системы человека при папилломавирусной инфекции. Развитие папилломавирусной инфекции тесно связано с иммунным статусом инфицированного организма. Инфекция вызывает иммунодефицит и снижает противовирусную защиту, что способствует персистенции вируса папилломы человека [2]. Рядом исследователей дается разноречивая оценка роли различных звеньев иммунитета, как гуморального, так и клеточно-опосредованного, в развитии данного заболевания [5,9]. Выраженная связь иммунологических реакций с атипичной пролиферацией эпителия указывает на влияние клеточного и гуморального иммунитета на процессы, поддерживающие существование фоновых и предраковых заболевании, а также провоцирующие их рецидивы.
К сожалению, проблема вируса папилломы человека в России в течение многих лет оставалась вне поля зрения специалистов. Отношение, сложившееся у многих специалистов к папилломавирусной инфекции кожи как редко встречающейся кожной патологии, является одним из факторов значительного увеличения числа больных детей в последнее десятилетие. Это было связано с недостаточными возможностями лабораторной диагностики и слабым пониманием патогенетических механизмов заболевания. Кроме того, участились случаи появления на коже папиллом, обусловленных вирусом папилломы человека высокого онкогенного риска. До сих пор не существует четко определенной системы медицинской помощи детям со специфическими инфекциями [6].
Также остается открытым для исследований вопрос тактики лечения папилломавирусной инфекции у детей. В современной научной литературе предлагается множество способов лечения клинических проявлений ПВИ (криодеструкция, электродеструкция, лазерная вапоризация, радиохирургическое удаление), но ни одна из методик не является приоритетной при выборе тактики лечения ребенка в силу высокого риска побочных эффектов и осложнений, технической сложности выполняемых манипуляций [1]. Проведенный нами анализ современной литературы показывает, что наиболее эффективным методом лечения бородавок можно считать комбинированный метод, включающий деструкцию видимых поражений и иммунотерапию. Несмотря на множество предложенных локальных методов лечения остается высокой частота рецидивирования патологического процесса, что диктует необходимость поиска лекарственных средств, повышающих эффективность лечения.
Таким образом, высокая частота встречаемости папилломавирусной инфекции среди маленьких пациентов, отсутствие надежных методов лечения и частое рецидивирование инфекции делают данную проблему в дерматологии одной из наиболее актуальных.
Литературные данные свидетельствуют о тесной зависимости состояния здоровья детей от региональных экологических условий. До настоящего времени малоизученным остается вопрос о воздействии аномальных геомагнитных полей, возникающих в регионах с крупными подземными залежами железосодержащих руд, такими как Курская магнитная аномалия, где значения магнитного поля превышают фоновые в других регионах в 4-5 раз [4]. Наиболее восприимчивым к действию аномальных абиотических факторов в силу физиологической незрелости адаптационных систем является растущий организм. Магнитное поле оказывает негативное влияние на функциональное состояние многих систем детского организма и изменяет характер и интенсивность его ответной реакции.
Характер течения папилломавирусной инфекции в условиях воздействия аномальных магнитных полей и особенности реакции иммунной системы при этом практически не изучены. Представляет интерес также разработка методов фармакологической коррекции, позволяющих скомпенсировать влияние этих факторов на организм.
Цель исследования: оценить клинико-иммунологическую эффективность комплексной терапии папилломавирусной инфекции кожи у детей, проживающих в регионах с различным уровнем геомагнитного поля.
Материалы и методы исследования
В исследовании принимали участие 120 больных, которые соответствовали следующим критериям: дети в возрасте от 3 до 9 лет были поделены на две категории: от 3 до 5 лет и от 7 до 9 лет. В связи с возрастными различиями иммунологических показателей. В каждую группу входило по 60 детей с установленным диагнозом папилломавирусная инфекция кожи D23, не получавших терапию препаратами цитокинов (интерлейкинами 1 и 2, эритропоэтином, интерфероном и его индукторами) в течение одного предшествующего месяца, с отсутствием потребности в системном назначении глюкокортикостероидов и отсутствием терапии глюкокортикостероидами в течение 1 предшествующего месяца.
Родители всех детей заполняли информированное согласие на участие ребенка в исследовании. На первом этапе были изучены: индивидуальные карты развития детей, амбулаторные карты, собран анамнез, проведен анализ данных клинико-параклинического обследования, целенаправленное анкетирование детей и родителей.
После оценки соответствия пациентов критериям отбора с помощью рандомизации (вероятностный метод выборки) больные были разделены следующим образом: дети 1-й группы в возрасте от 3 до 5 лет и 7-9 лет клинически здоровые, проживающих в городе Курске при фоновых значениях геомагнитного поля (ГМП контроль), дети 2-й, 3-й, 4-й и 5-й групп имели установленный диагноз папилломавирусная инфекция кожи. При этом дети 2-й и 4-й группы проживали в городе Железногорске, в регионе с аномальным магнитным полем (АМП), дети 3-й и 5-й групп проживали в городе Курске. В опытных группах 2 (группа АМП –коррекция) и 3 (группа ГМП – коррекция) помимо криодеструктивного метода проводили по схеме иммунокоррекцию папилломавирусной инфекции кожи препаратом интерферона «Генферон Лайт». В 4-й (группа АМП сравнения) и 5-й (группа ГМП сравнения) группах дети не получали иммуномодулятор: для лечения использовался метод криодеструкции.
Детям с папилломавирусной инфекцией кожи, проживающих в городах Курске и Железногорске, с целью иммунокоррекции ректально вводили препарат интерферона «Генфероном Лайт» по следующей схеме: по 1 суппозиторию 2 раза в день с 12-часовым интервалом в течение 10 дней до деструкции и в течении 10 дней по 1 суппозиторию 2 раза в день после деструкции. Затем в течение 1-3 месяцев – по 1 суппозиторию ректально на ночь через день. Разовая доза для детей старше 7 лет «Генферон Лайт» составляла 250 000 МЕ, до 7 лет 125 000 МЕ.
Исследование состояния клеточного и гуморального звена иммунитета в группах проводили до начала лечения и по его окончании через 3 месяца. Функциональное состояние иммунной системы оценивали методом непрямой иммунофлуоресценции на основании количественного определения субпопуляций лимфоцитов с использованием набора реагентов «Клоноспектр» («МедБиоСпектр», Россия) и уровня иммуноглобулинов IgM, IgG, IgA в сыворотке крови методом иммуноферментного анализа с помощью наборов реагентов «Микроанализ IgM», «Микроанализ IgG», «Микроанализ IgА» («Синтэко», Россия).
Уровень в крови α- и γ-ИФН определяли методом твердофазного иммуноферментного анализа с помощью наборов реагентов «Альфа-Интерферон-ИФА-Бест», «Гамма-Интерферон-ИФА-Бест» («Вектор Бест», Россия). Концентрацию в сыворотке крови ИЛ-2 и ИЛ-8 определяли методом твердофазного иммуноферментного анализа с помощью наборов «IL-2» и «IL - 8» («BioSource International», США), содержание ФНО-α оценивали с помощью реагентов «Альфа-ФНО-ИФА-Бест» («Вектор-Бест», Россия). Достоверность различий исследованных показателей определяли с использованием парного и непарного t-критерия Стьюдента [7].
Результаты исследования и их обсуждение
Исследование показателей иммунной системы установило, что у больных детей в возрастной группе от 3 до 5 лет, проживающих в городе Железногорске (АМП до лечения), уровень ИЛ 8, ФНОα, Ig A, Ig M, Ig G достоверно превышал данные группы контроля (ГМП контроль) (таблица 1). У больных детей той же возрастной группы, проживающих в городе Курске (ГМП до лечения) от контрольных значений отличались (были выше) только концентрация ФНО-α , ИЛ 8, Ig A и Ig M (таблица 2). Сопоставление же иммунологических показателей у детей этой возрастной группы с папилломавирусной инфекцией кожи, проживающих в регионах с различным уровнем напряженности геомагнитного поля выявило более высокие значения γ-ИФН, ИЛ 8, ФНО-α, Ig A, Ig M и Ig G у детей в городе Железногорске.
Таблица 1. Иммунологические показатели у детей 3-5 лет с папилломавирусной инфекцией кожи, проживающих в Железногорске до и после лечения
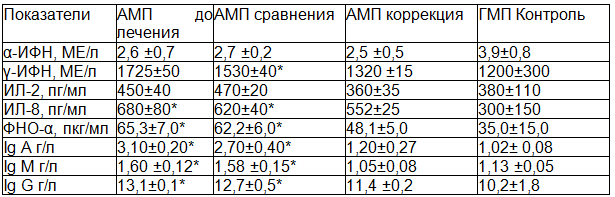
Примечание: здесь и далее достоверные результаты при сравнении с показателями контрольной группы: * - р< 0,05; ** - р<0,01.
Таблица 2. Иммунологические показатели у детей 3-5 лет с папилломавирусной инфекцией кожи, проживающих в Курске до и после лечения
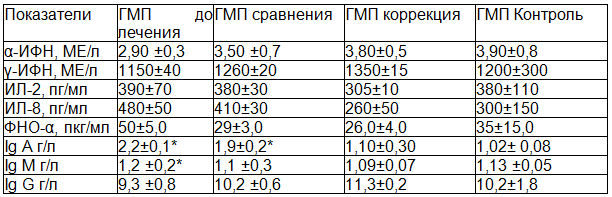
Исследование показателей иммунной системы у больных детей в возрастной группе от 7 до 9 лет, проживающих в городе Железногорске (АМП до лечения), показало, что уровень ИЛ 8, ФНО–α, Ig A и Ig M достоверно превышал данные группы контроля (ГМП контроль) (табл. 3). У больных детей в той же возрастной группе, проживающих в городе Курске (ГМП до лечения), от контрольных значений отличались (были выше) только концентрация ИЛ 8, Ig A и Ig M (табл. 4). Сопоставление же иммунологических показателей у детей этой возрастной группы с папилломавирусной инфекцией кожи, проживающих в регионах с различным уровнем напряженности геомагнитного поля, выявило более высокие значения γ-ИФН, ИЛ 8, ФНО-α, Ig A, Ig M и Ig G у детей в городе Железногорске.
Таблица 3. Иммунологические показатели у детей 7-9 лет с папилломавирусной инфекцией кожи, проживающих в Железногорске до и после лечения
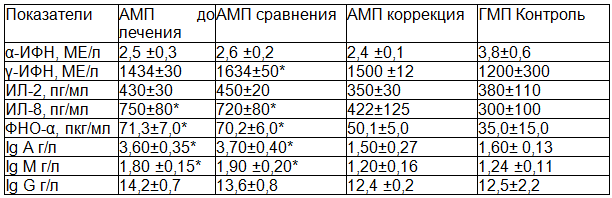
Таблица 4. Иммунологические показатели у детей 7-9 лет с папилломавирусной инфекцией кожи, проживающих в Курске до и после лечения
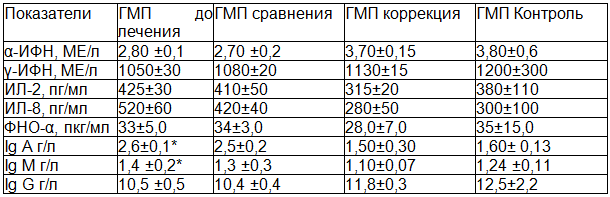
После проведения терапии с использованием криодеструкции изменения исследованных иммунологических показателей у детей города Курска (ГМП сравнения) не отмечалось, тогда как у детей города Железногорска (АМП сравнения) регистрировалось увеличение концентрации γ-ИФН в возрастной группе от 7до 9 лет.
Включение в состав комплексной терапии препарата «Генферон Лайт» у детей в возрасте от 3 до 5 лет в группе ГМП – коррекции позволило нормализовать содержание Ig M и Ig G. В той же возрастной категории в группе АМП – коррекции уровня контроля достигли концентрация ФНО-α, Ig A и Ig M. Сопоставление значений исследованных иммунологических показателей у детей этой возрастной группы города Курска и города Железногорска после терапии с использованием «Генферон Лайт» выявило у пациентов города Железногорска более высокие значения ФНО-α, Ig А и более низкие - α-ИФН.
Включение в состав комплексной терапии препарата «Генферон Лайт» у детей в возрасте от 7 до 9 лет в группе ГМП – коррекции позволило нормализовать содержание Ig A и Ig M. В той же возрастной категории в группе АМП – коррекции уровня контроля достигли концентрация ИЛ 8, ФНО-α, Ig A и Ig M. Однако, сопоставление значений исследованных иммунологических показателей у детей этой возрастной группы города Курска и города Железногорска после терапии с использованием «Генферон Лайт» выявило у пациентов города Железногорска более высокие значения γ-ИФН, ФНО-α и более низкие - α-ИФН.
Переносимость «Генферон Лайт» в представленных дозах была хорошей у всех детей. Побочных реакций выявлено не было. Положительная динамика иммунологических показателей сопровождалась благоприятными изменениями клинических симптомов.
Таким образом, развитие папилломавирусной инфекции у детей, проживающих в регионе Курской магнитной аномалии в условиях постоянного воздействия геомагнитного поля повышенной напряженности, приводит к возникновению более выраженных нарушений иммунной защиты по сравнению с пациентами региона с фоновым значением геомагнитного поля. Традиционная терапия с использованием криодеструкции позволяет скорректировать исходно измененные иммунологические показатели у детей города Курска, но практически не оказывает никакого воздействия на показатели жителей города Железногорска. Включение в терапию дополнительно иммуномодулятора «Генферон Лайт» позволило добиться корректирования вторичного иммунодефицита. Это является результатом того, что в состав препарата «Генферон Лайт» входит рекомбинантный человеческий интерферон альфа-2b, вырабатываемый Escherichia coli, в которую методами генной инженерии введен ген интерферона альфа-2b человека. Интерферон альфа-2b оказывает противовирусное, иммуномодулирующее, антипролиферативное и антибактериальное действие. Иммуномодулирующее действие проявляется, в первую очередь, усилением клеточно-опосредованных реакций иммунной системы, что повышает эффективность иммунного ответа в отношении вирусов. В то же время необходимо отметить, что значение ряда показателей детей города Железногорска даже после достигнутой их нормализации в результате комплексной терапии по-прежнему отличались от значений детей аналогичной группы города Курска.
