Задержка роста плода (ЗРП) является одной из важнейших проблем современного акушерства и перинатологии и обуславливает высокий уровень смертности в перинатальный период [7]. Несмотря на широкий спектр методов прегравидарной подготовки и ведения беременности, частота возникновения задержки роста плода не снижается и колеблется в диапазоне 3-23% [2, 5, 27]. Внутриутробное развитие задержки роста плода обуславливает формирование хронических форм патологии и инвалидности у детей, таких как слепота и детский церебральный паралич [1, 3, 4, 26]. Известно, что наличие ЗРП при беременности обуславливает уровень здоровья и качество жизни взрослого человека. Доказана связь ЗРП с повышенным риском метаболического синдрома, сердечно-сосудистых заболеваний, ожирения, диабета типа II в зрелом возрасте, астмы, ранней менопаузы у женщин [14, 20, 36]. Формирование задержки роста плода является универсальной реакцией в ответ на воздействие различных неблагоприятных факторов.
Патогенез ЗРП многогранен и до конца не изучен. Развитие синдрома задержки роста плода сопровождается нарушением регуляции иммунных реакций и ведет к дисбалансу адаптивного иммунитета. Известно, что при ЗРП наблюдаются существенные изменения антителозависимых реакций иммунной системы матери, начиная с ранних сроков гестации [6, 8]. При беременности, осложненной задержкой роста плода, возрастает антигенная нагрузка на организм женщины, что связывают с неполноценностью функционирования плацентарных барьеров [7]. Это может обусловливать формирование длительно-живущих В-клеток памяти.
В норме иммуногенез CD27+ В-клеток памяти обусловлен антиген зависимыми механизмами [15]. Известно, что в динамике гуморального иммунного ответа формируются два компартмента В-клеток памяти: плазматические клетки, продуцирующие антитела (эффекторные клетки памяти) и центральные клетки памяти, способные генерировать и пополнять пул плазматических клеток в результате антиген зависимых механизмов [25, 32, 38, 39]. Кроме того, центральные В-клетки памяти принимают участие в презентации антигена Т-лимфоцитам, продуцируют широкий спектр цитокинов и хемокинов [32]. Периферические CD19+ В-клетки памяти определяет поверхностная экспрессия CD27 и дифференциальная экспрессия IgD, которая часто используется для разделения на так называемые, «непереключенные» (Non-switched) CD27+IgD+ и CD27+IgD- «переключенные» (Switched) клетки памяти [25].
Часть В-лимфоцитов, которые прошли процессы гипермутагенеза, переключения изотипов иммуноглобулинов на IgG и IgA, созревание афинности антител, но потеряли возможность экспрессировать поверхностные рецепторы IgD, называются «переключенными» В-клетками памяти [25]. Известно, что образование CD27+IgD- В-клеток памяти и плазматических клеток происходит в герминативных центрах фолликулов преимущественно селезенки под воздействием Т-зависимых антигенов и при участии ТFH [8, 22, 30, 31, 34]. Ранее существовало разногласие в вопросе формирования CD27+IgD- В-лимфоцитов памяти: ряд авторов считал, что возникновение В-клеток памяти определялось низкой силой связи BCR с антигеном в динамике иммунного ответа, другие высказывали противоположное мнение [12, 42]. Последние литературные данные свидетельствуют, что «переключенные» CD27+IgD- В-лимфоциты памяти несут на своей поверхности BCR, обладающий высоким сродством к антигену, что и обеспечивает быстрый и мощный иммунный ответ при повторной встрече с антигеном [22, 31, 38].
«Непереключенные» В-лимфоциты памяти продолжают экспрессировать IgD рецепторы в сочетании с поверхностными IgM и не проходят дальнейшего этапа переключения изотипов иммуноглобулинов [15, 38]. Считается, что формирование «непереключенных» CD27+IgD+ периферических В-лимфоцитов памяти протекает экстрафолликулярно из активированных В-клеток, под действием сильных сигналов от CD4+ Т-клеток в начале реакции на антигенную стимуляцию [8, 31, 41]. Известно, что CD27+IgD+ В-клетки участвуют в иммунных реакциях против переносимых кровью Т-независимых антигенов [22], а также при повторной инфекции с мутантными версиями исходного патогена [38]. Известна роль непереключенных В-клеток памяти в защите от инфекции, вызванной Streptococcus pneumoniae [16, 33]. Было высказано мнение о высокой фенотипической и функциональной схожести CD27+IgD+ В-клеток с клетками маргинальной зоны селезенки [23, 37, 39, 41]. Некоторые авторы называют CD27+IgD+ В-лимфоциты «Натуральными Эффекторными В-клетками» или «IgM-памяти», подчеркивая их сходство с клетками врожденного иммунитета [22, 41]. Но главное различие двух исследуемых пулов клеток памяти заключается в их функциональной активности [38]. Известно, что быстрый и мощный антителозависимый иммунный ответ обеспечивается за счет класса «переключенных» В-лимфоцитов, которые способны быстро генерировать пул плазматических клеток в ответ на повторное поступление антигена [17, 22, 24]. «Непереключенные» В-клетки памяти при повторной антигенной стимуляции поступают в герминативные центры, где и проходят дальнейший процесс дифференцировки и созревания [22, 29]. Исследование CD27 позитивных В-клеток памяти касались ответа иммунной системы при болезнях соединительной ткани, аутоиммунных патологиях [18, 19], иммунодефицитах [28], при паразитарных инвазиях [10], онкологических заболеваниях [21].
При беременности особенности содержания периферических CD27+ В-лимфоцитов памяти практически не изучались. Имеются данные о сниженном содержании CD27+ В-клеток памяти в периферической крови у женщин с бесплодием, вступающих в программу ЭКО [13]. Имеются данные, что у женщин, беременность которых осложнилась преэклампсией, определялось снижение уровня CD27+ В-клеток памяти в периферической крови [40]. Однако, характер дифференцировки периферических В-лимфоцитов памяти при беременности, осложненной ЗРП, не изучался.
Целью исследования было изучить особенности дифференцировки В-лимфоцитов памяти при беременности, осложненной задержкой роста плода.
Материалы и методы исследования. Всего было обследовано 64 беременные женщины в 32-36 недель гестации. Основную группу составили 44 беременные женщины с установленным диагнозом ЗРП (общая группа ЗРП). Ретроспективно женщины основной группы были разделены в зависимости от наличия признаков ЗРП и ее тяжести у новорожденных. Была выделена группа женщин, имевших при беременности диагноз ЗРП, который подтвердился у новорожденных (ЗРП→ЗРП) - 34 человека. Данную группу беременных впоследствии подразделили в зависимости от тяжести проявлений ЗРП у детей при рождении: женщины, родившие детей с легкой степенью ЗРП и ЗРП умеренной и тяжелой степени (10 и 23 беременных соответственно). Отдельную группу составили 10 беременных с ЗРП по данным УЗ-исследования, но родивших детей без признаков ЗРП (ЗРП→нормотрофия). Группу контроля составили 20 женщин, с неосложненным течением беременности.
Материалом для исследования служила периферическая венозная кровь. Клетки выделяли традиционным методом скоростного центрифугирования в градиенте плотности фиколл-урографин (d-1,078). Определение особенностей содержания CD19+ В-лимфоцитов памяти осуществляли методом трехцветной проточной цитофлюориметрии на проточном цитофлюориметре FACSCantoII, результаты оценивали в программе FACSDiva (Becton Dickinson, USA). Исследовали уровень периферических CD19+CD27+IgD± В-клеток памяти, а также процентное содержание CD19+CD27+IgD+ «непереключенных» и CD19+CD27+IgD- «переключенных» В-лимфоцитов памяти. В работе использовали моноклональные антитела анти-CD19 PerCP-Cy5.5 (eBioscience, USA), анти-CD27 РЕ (Beckman Coulter, France), анти-IgD FITC (Beckman Coulter, USA).
Статистическая обработка данных проводилась с расчетом среднего арифметического и ошибки среднего арифметического с использованием программы Microsoft Excel из комплекта Microsoft Office 2000. Достоверность различий сравниваемых показателей определялась по t-критерию Стьюдента.
Результаты исследования. Данные по содержанию различных популяций В-клеток памяти приведены в табл. 1 и 2.
Таблица 1. Характеристика CD19+ В-клеток памяти в периферической крови женщин с ЗРП
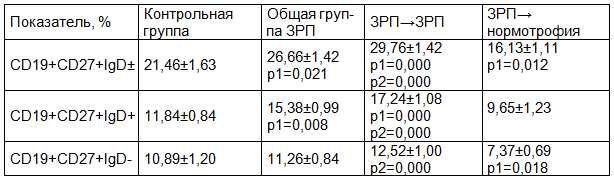
Примечания: p1 - достоверность различий показателей женщин с ЗРП по сравнению с показателями группы контроля; p2 - достоверность различий показателей женщин с ЗРП по сравнению с показателями группы женщин, родивших детей без ЗРП.
Анализируя особенности содержания основных пулов клеток памяти, было установлено, что в общей группе женщин с ЗРП, уровень CD19+CD27+IgD± периферических В-лимфоцитов был достоверно выше, чем в группе контроля (p=0,021). Это повышение было обусловлено повышенным содержанием «непереключенных» CD19+CD27+IgD+ периферических В-клеток памяти в группе женщин с диагнозом ЗРП, по сравнению с контрольными параметрами (p=0,008). В группе женщин, с подтвержденным диагнозом ЗРП у новорожденных, содержание CD19+CD27+IgD± В-клеток также было существенно выше по сравнению с аналогичным параметром группы контроля (p=0,000), что сопровождалось повышенным уровнем пула «непереключенных» В-лимфоцитов памяти, в сравнении с аналогичным показателем контрольной группы (p=0,000). Содержание CD19+CD27+IgD- В-лимфоцитов в группе беременных, с подтвержденным диагнозом ЗРП у новорожденных, хотя и имело тенденцию к повышению, существенно не менялось по сравнению с контрольными параметрами (p>0,05).
Как видно из представленных в табл. 1 данных, в группе женщин с установленным диагнозом ЗРП при беременности, но родивших детей-нормотрофов, характер дифференцировки периферических В-клеток памяти был иным, и определялся снижением уровня CD19+CD27+IgD± В-лимфоцитов, по сравнению с таковым в группе контроля (p=0,012). Изменения в содержании общего пула В-клеток памяти в основной группе беременных женщин, но родивших детей-нормотрофов, были обусловлены существенным снижением количества «переключенных» CD19+CD27+IgD- В-лимфоцитов памяти по сравнению с контрольными параметрами (p=0,018). Уровень периферических CD19+CD27+IgD+ В-лимфоцитов в группе женщин, родивших детей без признаков ЗРП, хотя и имел тенденцию к снижению, существенно не отличался от такового в группе контроля (p>0,05). Поскольку изменения содержания CD19+CD27+IgD± В-лимфоцитов зависели от исхода беременности, максимальные различия в уровне данного параметра наблюдались между группами женщин, родивших детей с признаками ЗРП и без них (p=0,000). Набольшее различие по уровню «непереключенных» CD19+CD27+IgD+ и «переключенных» CD19+CD27+IgD- В-лимфоцитов памяти также наблюдалось между группами женщин, родивших детей с диагнозом ЗРП и без него (p=0,000 в обоих случаях).
Таблица 2. Особенности содержания периферических CD19+ В-клеток памяти в зависимости от тяжести ЗРП при рождении
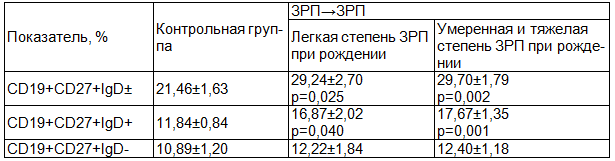
Примечание: p - достоверность различий показателей женщин с ЗРП по сравнению с показателями группы контроля.
Исследование основных пулов CD19+ В-клеток памяти в периферической крови женщин в зависимости от тяжести ЗРП новорожденного показало, что содержание CD19+CD27+IgD± В-лимфоцитов было практически одинаковым в группах женщин, родивших детей с легкой ЗРП и с ЗРП умеренной и тяжелой степени (p>0,05). Оно было достоверно выше по сравнению с аналогичными параметрами группы контроля (p=0,025 и p=0,002 соответственно). Уровень «непереключенных» CD19+CD27+IgD+ В-лимфоцитов памяти в группах женщин с легкими проявлениями ЗРП у новорожденных, а также с умеренными и тяжелыми проявлениями ЗРП у родившихся детей (p>0,05), был одинаково повышен по сравнению с таковым при неосложненной беременности (p=0,040 и p=0,001соответственно).
Обсуждение результатов. Проведенные исследования показали, что в третьем триместре беременности, осложненной задержкой роста плода, наблюдались выраженные изменения характера дифференцировки В-клеток памяти, которые были разнонаправлеными в зависимости от наличия или отсутствия ЗРП у детей при рождении, и не зависели от выраженности симптомов ЗРП у новорожденных. Беременные женщины, с подтвержденным диагнозом ЗРП у детей при рождении, имели повышенный уровень общего пула CD19+CD27+IgD± В-клеток памяти в периферической крови, за счет повышенного уровня «непереключенных» CD19+CD27+IgD+ В-лимфоцитов. Группа женщин, имевших при беременности диагноз ЗРП, но родивших детей-нормотрофов, характеризовалась сниженным содержанием CD19+CD27+IgD± В-клеток памяти, за счет сниженного уровня «переключенных» CD19+CD27+IgD- В-лимфоцитов. Поскольку для ЗРП характерно повышенное поступление антигенов плода в организм матери [7], выявленные изменения могут быть обусловлены чрезмерной стимуляцией В-звена иммунитета антигенами плодового происхождения, что может усиливать процессы дифференцировки В-клеток до клеток памяти. Известно, что при повторном поступлении антигена «непереключенные» В-клетки памяти мигрируют в герминативные центры, где они проходят процессы досозревания [22, 29], что, вероятно, приводит к формированию de novo плазматических клеток и «высокоспецифичных» переключенных В-клеток памяти, а также способствует хронической активации В-звена иммунной системы при ЗРП. Содержание CD19+CD27+IgD- В-лимфоцитов в крови беременных женщин, родивших детей с ЗРП, существенно не менялось, хотя и имело тенденцию к повышению. Известно, что «переключенные» В-клетки памяти при повторном поступлении антигена способны быстро дифференцироваться в эффекторные плазматические клетки [17, 22, 24], продуцирующие высокоспецифичные антитела класса G. Чрезмерная продукция плазматических клеток, вероятно, способствует развитию реакции антителозависимой клеточной цитотоксичности, направленной против тканей плаценты и плода. Литературные данные, а также неопубликованные результаты наших собственных исследований свидетельствуют, что в периферической крови женщин при ЗРП отмечалось повышенное содержание плазматических клеток [11]. Можно предположить, что в группе женщин, родивших детей с ЗРП, содержание периферических CD19+CD27+IgD- В-клеток существенно не повышалось, поскольку, пул «переключенных» В-лимфоцитов был активно вовлечен в процесс дальнейшей дифференцировки до конечных ее этапов - формирования клеток-антителопродуцентов. Представляется вполне вероятным, что патологическая активация В-звена иммунитета в группе женщин, родивших детей с ЗРП, обусловлена совокупностью процессов формирования В-лимфоцитов памяти в результате непосредственного влияния антигенов плодового происхождения, и в результате процессов досозревания «непереключенных» В-лимфоцитов в герминативных центрах.
Выявленное нами изменение характера дифференцировки периферических В-клеток памяти у женщин, не зависело от выраженности проявлений ЗРП у новорожденных и характеризовалось одинаково повышенным уровнем общего пула CD19+CD27+IgD± В-клеток, за счет повышенного содержания CD19+CD27+IgD+ «непереключенных» В-лимфоцитов как в группе легкой ЗРП, так и умеренной и тяжелой ЗРП при рождении. Можно предположить, что выраженность проявлений ЗРП при рождении, зависит от длительности возникновения патологического процесса. Это предположение хорошо согласуется с нашими собственными данными о существенном повышении плазматических клеток в периферической крови лишь в группе женщин с умеренными и тяжелыми проявлениями ЗРП у новорожденных (неопубликованные данные). Кроме того, у беременных, имевших легкую ЗРП при рождении, возможно, срабатывают дополнительные иммунные механизмы, препятствующие активному созреванию В-лимфоцитов памяти в плазматические клетки; не исключено участие цитокинов и ростовых факторов.
Оценивая характер дифференцировки В-клеток памяти в периферической крови женщин, имевших при беременности диагноз ЗРП, но родивших детей-нормотрофов, было выявлено, что содержание основных пулов В-клеток памяти существенно отличалось и от такового группы женщин, родивших детей с ЗРП, и от такового группы контроля, что, по-видимому, носит компенсаторный характер. У женщин с неподтвержденным диагнозом ЗРП, сниженный уровень CD19+CD27+IgD± В-клеток памяти был обусловлен существенным снижением пула CD19+CD27+IgD- В-лимфоцитов. Вероятно, при сохранных компенсаторных возможностях плаценты или их эффективного восстановления после лечения ЗРП, антигенная нагрузка на организм матери уменьшается. В результате, продукции новых клонов В-клеток памяти не происходит, а уже имеющиеся, интернализуются из кровотока и активно реализуются в динамике иммунного ответа.
Таким образом, при беременности осложненной ЗРП, отмечались изменения в характере дифференцировки В-клеток памяти, которые были разнонаправлены в зависимости от наличия ЗРП у новорожденных. При рождении детей с ЗРП, беременные женщины имели одинаково повышенный уровень CD19+CD27+IgD± В-лимфоцитов в периферической крови за счет существенно повышенного содержания CD19+CD27+IgD+ В-клеток как в группе с легкой ЗРП, так и ЗРП умеренной и тяжелой. Женщины с диагнозом ЗРП при беременности, но родившие детей-нормотрофов, имели сниженный уровень CD19+CD27+IgD± В-лимфоцитов, что было обусловлено сниженным содержанием CD19+CD27+IgD- В-клеток, что, вероятно, носило компенсаторный характер.
