Хронический гепатит В (ХГВ) относится к числу неуклонно прогрессирующих заболеваний с исходом в цирроз печени. В условиях широкого распространения ХГВ и недостаточной эффективности противовирусной терапии остается актуальным вопрос о прогнозировании естественного течения болезни. Спонтанное исчезновение HBsAg при естественном течении ХГВ регистрируется в зависимости от региона и по данным разных авторов лишь у 0,4 – 12% больных [4, 16, 18, 20, 21]. По данным К.В. Жданова и др., в России частота элиминации HBsAg у HBeAg-негативных больных составляет 11% – при генотипе D (5 лет наблюдения) и 12% при других генотипах [1].
В настоящее время ведется активный поиск предикторов прогрессирования ХГВ. В качестве прогностических критериев исследуется комплекс клинико-анамнестических данных, результаты иммуноферментного анализа (ИФА), динамика HBV ДНК [3, 11].
Изменение титров HBsAg в ходе естественного течения болезни является наиболее изученным фактором. Исследования, проведенные в т. ч. в нашей клинике, показали связь высоких тиров HBsAg с активной репликацией HBV [22]. Поэтому контроль за титром HBsAg представляется перспективным фактором оценки прогноза естественного течения ХГВ. Особенную значимость количественная оценка HBsAg приобретает при отсутствии HBV ДНК в крови, что наблюдается у 6,4% больных ХГВ [26]. У них в гепатоцитах сохраняется ковалентно замкнутая кольцевая ДНК [15].
Широко обсуждается роль HBeAg-статуса больного в характере течения ХГВ. С одной стороны, частота развития цирроза печени выше у HBeAg-негативных больных, чем у HBeAg-позитивных [28]. С другой стороны считается, что HBeAg-сероконверсия является благоприятным прогностическим признаком, свидетельствующим об окончании активной репликации HBV и, следовательно, о благоприятном прогнозе [23].
Целью работы явилась оценка значимости клинико-анамнестических и вирусологических параметров в качестве факторов, определяющих прогноз естественного течения ХГВ.
Материалы и методы. В исследование включены 82 больных ХГВ (52 мужчины и 30 женщин). Средний возраст составил 36,3±16,6 лет. Диагноз устанавливался клинико-анамнестически и верифицировался обнаружением маркеров ХГВ (HBsAg, HBeAg или a/HBeAg, a/HBcor IgМ и a/HBcor IgG). При этом 9 больных были HBeAg-позитивны, прочие 73 – HBeAg-негативны.
Исследовалась прогностическая значимость пола, возраста больных в момент инфицирования, путей заражения (оценка возможной массивности инфицирования), длительности болезни, наличия сопутствующих заболеваний желчевыводящих путей и привычных интоксикаций. Диагностика заболеваний желчевыводящих путей и привычных интоксикаций проводилась клинико-анамнестически, подтверждалось данными УЗИ и повышением уровня α-амилазы и γ-глутамилтранспептидазы.
Тяжесть течения ХГВ определялась комплексом астенических и диспептических симптомов, объединяемых в синдром малой печеночной недостаточности (МПН). Оценивалась частота повышения уровня АлАт, частота высокого цитолиза (повышение АлАт более чем в 5 раз от верхней границы нормы), наличие структурных изменений печени (по данным УЗИ и/или эластографии печени).
Активность репликации HBV оценивалась по уровню вирусной нагрузки методом ПЦР в реальном времени, а также по наличию или отсутствию HBeAg. Традиционно низкой считалась вирусная нагрузка менее 4000 коп/мл, высокой – более 4000 коп/мл [28].
Для определения достоверности различий использовались точный критерий Фишера и критерий хи-квадрат Пирсона.
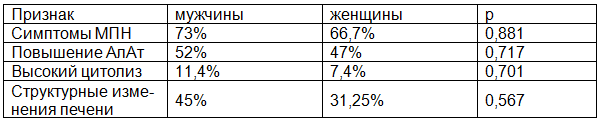
Результаты исследования. Результаты первого этапа анализа приведены в табл. 1. По всем параметрам заболевание протекает несколько тяжелее у мужчин. Несмотря на отсутствие достоверных различий, эти данные, полагаем, заслуживают внимания.
Таблица 1. Сравнительная характеристика течения ХГВ у мужчин и женщин
Влияние возраста в момент инфицирования на тяжесть течения ХГВ оказалось более существенным. Частота выявления МПН у больных с разным возрастом в момент инфицирования представлена на рис. 1. При инфицировании в возрасте до 20 лет МПН выявлена у 57,14% больных, а при инфицировании после 40 лет – у 89,47% больных (р=0,024).
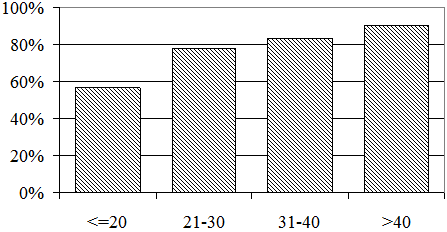
Рис. 1. Частота признаков МПН при инфицировании в разном возрасте.
Полученные данные, по-видимому, отражают общие закономерности течения вирусных гепатитов у больных, инфицированных в разном возрасте [25]. Аналогичная динамика отмечена и в отношении частоты повышения АлАт. Как показано на рис. 2, частота повышения АлАт при увеличении возраста в момент инфицирования нарастает от 44% до 58% (р=0,278). Высокие показатели цитолиза, напротив, значительно чаще регистрируется в группе больных, инфицированных в возрасте 21 – 30 лет – 23,1% (рис. 2). По-видимому, это связано с наибольшей активностью иммунно-опосредованного цитолиза в данном возрасте [2].
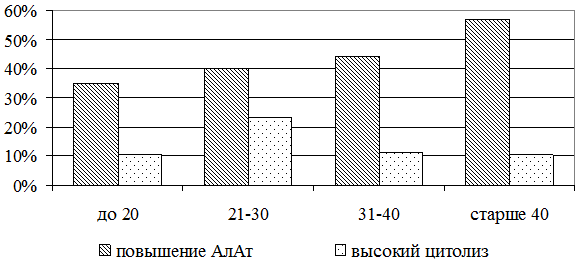
Рис. 2. Частота повышения АлАт и высокого цитолиза при инфицировании в разном возрасте.
Отмеченная закономерность получила дополнительное подтверждение при анализе структурных изменений печени (рис. 3). Как видно из рисунка, наиболее часто они выявлялись у больных, инфицированных в возрасте 31 – 40 лет, а реже всего – при инфицировании в возрасте до 20 лет: 67% и 23,53% больных соответственно (р=0,131).
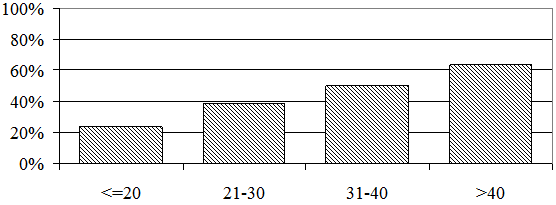
Рис. 3. Частота структурных изменений печени при инфицировании в разном возрасте.
Считается, что при инфицировании половым путем или при единичных медицинских манипуляциях доза инфекта невелика; высокая инфицирующая доза соответствует инфицированию при гемотрансфузиях или внутривенном введении наркотиков. В наших исследованиях подтверждена зависимость характеристики течения болезни от инфицирующей дозы. Так, у больных, получивших высокую инфицирующую дозу, МПН выявлялась чаще, чем у больных с низкой инфицирующей дозой: 67% и 54,17% соответственно (р=0,672). При высокой инфицирующей дозе значительно чаще определялся и повышенный уровень АлАт (83% по сравнению с 47% при малой дозе инфекта; р=0,052). Выраженный цитолиз регистрировался при большой и малой исходной дозе инфекта соответственно у 25% и 13% больных (р=0,583). Наиболее существенной оказалась зависимость частоты выявления структурных изменений печени от исходной инфицирующей дозы. Так, при малой дозе вируса нарушения структуры печени определялись лишь у 11,11% больных. В группе больных с высокой исходной дозой вируса частота структурных изменений печени была значительно выше: 75% (р=0,095).
Проведенный анализ показал, что с увеличением продолжительности болезни частота выявления симптомов МПН снижается: при длительности до 5 лет симптомы МПН выявлены у 71,05% больных, свыше 5 лет – у 63,33% (р=0,678). Частота повышения уровня АлАт при длительности заболевания до 5 лет была значительно выше, чем при длительном течении ХГВ: 61% и 37% соответственно (р=0,008). Это, вероятно, связано с уменьшением активности иммунной системы и иммунноопосредованного цитолиза гепатоцитов.
Структурные изменения печени выявлялись чаще у больных с длительностью ХГВ до 5 лет, чем у больных, инфицированных более 5 лет назад: 45,45% и 34,78% соответственно (р=0,670). Этот парадоксальный на первый взгляд результат, возможно, связан с тем, что выраженность структурных изменений печени определяется не длительностью инфицирования, а всем комплексом рассмотренных факторов.
Как и следовало ожидать, наличие привычных интоксикаций значительно утяжеляет течение ХГВ. В нашем исследовании симптомы МПН выявлялись у 88% больных, употреблявших наркотики либо злоупотреблявших алкоголем. При отсутствии привычных интоксикаций признаки МПН выявлены достоверно реже – у 60% больных (р=0,015). Повышение уровня АлАт при наличии привычных интоксикаций также регистрировалось чаще, чем при их отсутствии: 62,5% и 43% соответственно (р=0,046). Наибольшее влияние наркотиков и алкоголя выявлено в отношении структурных изменений печени. Так, при отсутствии привычных интоксикаций структурные изменения печени выявлены лишь у 14,29% больных. С другой стороны, наличие привычных интоксикаций сопровождалось увеличением частоты структурных изменений печени до 62,5% (р=0,002).
HBsAg является наиболее доступным для анализа маркером. Ранее в наших исследованиях было установлено, что титры HBsAg во многом определяются HBeAg-статусом больного. В данной работе при исследовании роли титра HBsAg больные были разделены на 3 группы: в первую группу вошли больные с титром HBsAg до 1/128 включительно, во вторую группу вошли больные с титрами HBsAg в диапазоне 1/256 – 1/1024, в третью группу – больные с титром HBsAg 1/2048 и выше. С ростом титра HBsAg частота регистрации МПН возрастала (рис. 4) и составила в 1 группе 55,56%, во 2 группе – 65,38%, в 3 группе – 88%. Различия между 1 и 3 группами оказались статистически достоверными (р=0,031).
Далее выявлена зависимость частоты повышения уровня АлАт от титра HBsAg (рис. 5). В 1 группе она составила 35% во 2 группе – 55%, в 3 группе – 57% (р1,3=0,114). При дополнительном исследовании частоты высокого цитолиза (рис. 5) различия оказались более существенными (5,6% больных 1 группы, 7,7% больных 2 группы, 19,2% 3 группы, р=0,634).
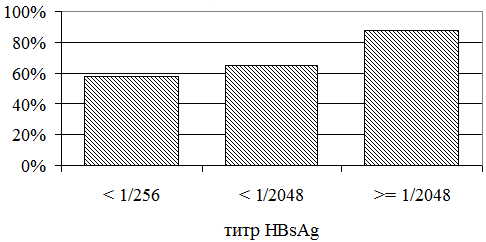
Рис. 4. Частота признаков МПН при разных титрах HbsAg.
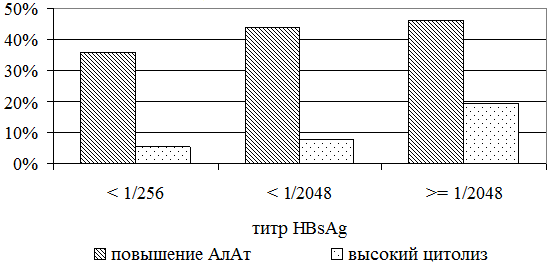
Рис. 5. Частота повышения АлАт и высокого цитолиза при разных титрах HbsAg.
Структурные изменения печени выявлены у 60% больных с низким титром HBsAg, 37,5% больных 2 группы и 33% больных с высоким титром HBsAg (р=0,422 для 1 и 2 групп, р=0,243 для 1 и 3 групп).
Важным этапом исследования был анализ течения ХГВ при разной активности репликации HBV. Известно, что HBeAg является сывороточным маркером активности репликации HBV. Этот факт был подтвержден и в нашем исследовании. Среди больных с низкими титрами HBsAg лишь 1 больной (5,3%) был HBeAg-позитивным. В группе больных со средними титрами HBsAg также лишь у 1 больного выявлен HBeAg (3,6%). В группе с высокими титрами HBsAg HBeAg-позитивными оказались 7 больных (18,9%). В связи с этим нам показалось важным оценить течение ХГВ у HBeAg-позитивных и HBeAg-негативных больных.
Прежде всего отметим, что МПН регистрировалась у 77,78% HBeAg-позитивных и 68,85% HBeAg-негативных больных (р=0,714). Частота повышения АлАт также оказалась различной: 80% у HBeAg-позитивных больных и 38% у HBeAg-негативных (р=0,005). Высокий цитолиз, отражающий эффективный иммунный ответ, также регистрировался чаще у HBeAg-позитивных больных, чем у HBeAg-негативных: 22,2% и 9,8% соответсвенно (р=0,272). Структурные изменения печени зарегистрированы у 50% HBeAg-позитивных больных и 40% HBeAg-негативных (р=1). Приведенные данные демонстрируют смену этапов иммунопатогенеза в ходе естественного течения ХГВ: с переходом заболевания в интегративную фазу интенсивность иммуноопосредованного цитолиза снижается, что проявляется уменьшением частоты ферментных обострений. В то же время длительное персистирование вируса приводит к прогрессированию фиброза.
Различия в течении ХГВ при высоком и низком содержании HBV ДНК подтвердили закономерности, выявленные при анализе течения болезни в зависимости от уровня HBsAg и HBeAg-статуса больных. При содержании HBV ДНК выше 4000 коп/мл частота регистрации повышенного уровня АлАт была выше, чем при низкой вирусной нагрузке (45% и 19% соответсвтенно, р=0,157). В то же время структурные изменения печени чаще регистрировались при низкой вирусной нагрузке (40%) сравнительно с высокой (20%), р=0,628.
Обсуждение. Полученные данные требуют определенных комментариев. Благоприятное течение ХГВ у женщин, по-видимому, обусловлено цитопротективным действием эстрогенов [10]. У мужчин тяжесть течения ХГВ дополнительно возрастает из-за высокой частоты привычных интоксикаций. Так, в нашем исследовании все больные, употреблявшие наркотики, были мужчины, они составили большинство и в группе злоупотреблявших алкоголем (65,38%).
Представляет интерес выявленная связь активности цитолиза и возраста больных в момент инфицирования. Поскольку цитолиз при ХГВ имеет иммунноопосредованный характер, можно предположить, что естественная гибель гепатоцитов (апоптоз), усиливающаяся с возрастом, сочетается с цитолизом, индуцированным антигенами вируса гепатита В. В результате происходит плавное нарастание частоты подъема АлАт.
Наибольшая частота высокого цитолиза (уровень АлАт выше 5 норм) при инфицировании в возрасте 21 – 30 лет отражает напряженный иммунитет у больных этой группы. При инфицировании в старшем возрасте выраженный цитолиз встречается реже, что отражает, по-видимому, возрастное снижение напряженности иммунитета.
Нами установлена зависимость тяжести течения ХГВ от продолжительности болезни. Само по себе увеличение длительности болезни не сказывается существенно на утяжелении клиники ХГВ и темпе развития структурных изменений печени.
Существенное значение имеет прием гепатотоксичных веществ. Наличие привычных интоксикаций не только утяжеляет течение ХГВ, повышая частоту МПН, но и способствует прогрессированию фиброза печени с исходом в цирроз.
На современном этапе дискутируется прогностическое значение вирусной нагрузки при ХГВ [7, 17, 27]. Согласно полученным нами данным, исходная доза вируса оказывает существенное влияние на естественное течение болезни. При массивном инфицировании в организм попадает большее количество штаммов вируса, что предопределяет высокую вирусную нагрузку в дальнейшем и, соответственно, более тяжелое течение ХГВ.
Выявленное нами существенное и статистически достоверное увеличение частоты МПН при нарастании титра HBsAg может быть объяснено, если рассматривать патологический процесс на клеточном уровне. Метаболизм клетки, инфицированной вирусом гепатита В, перестроен и направлен на синтез компонентов вируса (в том числе HBsAg), а не на выполнение обычных функций. Высокий титр HBsAg в крови означает, что значительный процент гепатоцитов инфицирован, а часть из них постоянно разрушается иммунной системой. В результате мы и наблюдаем симптомокомплекс МПН. Аналогичным образом можно объяснить и нарастание частоты повышения АлАт при нарастании титра HBsAg.
Экспрессируемый на мембранах гепатоцитов HBsAg стимулирует иммунный ответ организма. Логично предположить, что выделение большого количество HBsAg приводит к более напряженному иммунному ответу. Именно эту закономерность отражают полученные нами данные об увеличении частоты высокого цитолиза при нарастании титра HBsAg.
Одним из наиболее интересных результатов исследования было выявленное снижение частоты структурных изменений печени при высоких титрах HBsAg и, напротив, частое выявление изменений печени у больных с низкими титрами HBsAg. По-видимому, высокие титры HBsAg чаще выявляются у больных на ранних стадиях ХГВ, когда наиболее высока репликативная активность вируса, а после HBeAg-сероконверсии синтез HBsAg снижается. Показано, что у 0,4 – 2% европейских пациентов может происходить даже спонтанное исчезновение HBsAg [16]. Действительно, при последующем анализе группы у больных с низким титром HBsAg (до 1/256) длительность заболевания была большей, чем в группе больных с высокими титрами HBsAg.
Полученные нами данные позволяют считать, что симптомы МПН присутствуют до и после HBeAg-сероконверсии, незначительно убывая при переходе заболевания в интегративную фазу. Поскольку наличие HBeAg говорит о высокой репликативной активности вируса, то большая частота повышения АлАт и высокого цитолиза в группе HBeAg-позитивных больных выглядит вполне логично. Однако и после HBeAg-сероконверсии возможны биохимические обострения ХГВ, что подтверждают результаты нашего и зарубежных исследований [17, 27]. Эти обострения часто проходят бессимптомно, но приводят в итоге к развитию цирроза печени.
Структурные изменения печени у HBeAg-позитивных больных определялись несколько чаще, чем у HBeAg-негативных, однако оценивать эти данные следует с осторожностью. Нельзя с уверенностью утверждать, что выявленные структурные изменения печени сформировались у HBeAg-негативных больных уже после HBeAg-сероконверсии. Известно, что на момент установления диагноза HBeAg-негативного ХГВ выраженные гистологические изменения печени выявляются более чем у 50% больных, а умеренные и минимальные встречаются редко [5, 9, 13, 24].
Существует мнение, что уровень АлАт и HBeAg-статус больного не связаны достоверно с уровнем вирусной нагрузки [8]. Однако в нашем исследовании показано, что при высокой виремии частота повышения уровня АлАт более чем в 2 раза превышает таковую при низкой вирусной нагрузке. Это представляется логичным, поскольку без цитолиза гепатоцитов невозможен выход вирусных частиц в кровь, а значит, интенсивность цитолиза должна в определенной мере коррелировать с уровнем виремии.
По результатам проведенного анализа не было выявлено увеличения частоты структурных изменений печени у больных с высокой вирусной нагрузкой. Возможно, это связано с выявлением высокой виремии на ранних этапах болезни. С течением времени происходит HBeAg-сероконверсия, вирусная нагрузка снижается, но именно в этот период обычно определяются структурные изменения печени. Поэтому высокая вирусная нагрузка считается независимым фактором риска развития цирроза печени [19]. В связи с этим необходимо дальнейшее исследование проблемы для окончательного решения вопроса о прогностической роли виремии.
Проведенное исследование позволило установить комплекс факторов, способствующих более тяжелому течению ХГВ: это мужской пол, старший возраст в момент инфицирования, высокая исходная вирусная нагрузка, высокая репликация вируса (HBeAg-позитивный ХГВ), высокий титр HBsAg, высокое содержание HBV ДНК. Каждый их них сам по себе не имеет решающего значения. Вместе с тем, сочетание этих факторов определяет неблагоприятный прогноз течения заболевания. Сочетание женского пола, молодого возраста в момент инфицирования, низкой инфицирующей дозы, отсутствия привычных интоксикаций, низких титров HBsAg и отсутствия HBeAg , напротив, позволяет прогнозировать доброкачественное течение болезни. Комплексная оценка всех прогностически значимых факторов позволяет дифференцированно подходить к системе наблюдения и обоснованию показаний для ПВТ.
