Введение. Существуют убедительные доказательства того, что повреждение ДНК является неспецифическим побочным эффектом окислительного стресса, вызванного воспалением [1,2]. В результате накопления мутаций и нарушений экспрессии генов развиваются злокачественные заболевания, диабет, патологии органов зрения, ослабевает способность к регенерации [3,4,5]. Таким образом, задача поиска путей компенсации патологических последствий эндогенного повреждения ДНК является актуальной. Одним из путей ее решения является использование микронутриентов, компенсирующих дефицит природных коферментов и обладающих антиоксидантной активностью [6].
Универсальным источником адаптогенных веществ, оптимизирующих метаболизм хозяина является симбионтная кишечная микрофлора. Многочисленные исследования подтвердили эффективность использования пробиотиков в акушерстве, гинекологии, стоматологии, дерматологии, ревматологии, при заболеваниях опорно-двигательного аппарата, туберкулезе, сахарном диабете и т.д. [7-10]. Пробиотические и синбиотические препараты широко применяютсяются также для профилактики и лечения аллергических заболеваний, обладают противовоспалительной активностью [11,12].
Столь широкий спектр терапевтической активности пробиотических препаратов можно объяснить действием ряда механизмов, среди которых не последнее место занимает их способность снижать генотоксичность активных форм кислорода.
Задачей данной работы была оценка способности ряда доступных и активно применяющиеся пробиотических и симбиотических препаратов подавлять генотоксичность 1,4-диоксид 2,3-хиноксалиндиметанола, широко используемого в России для лечения инфекционных заболеваний. Мутагенность данного вещества зарегистрирована для широкого круга про- и эукариотических объектов. Показано, что он действует по механизму активации выработки активных форм кислорода (АФК) [13].
Материалы и методы. Фармпрепараты биологически активные добавки (БАД) для исследования приобретали в розничной аптечной сети. Японский традиционный пробиотический продукт Натто приобретали в розничной торговой сети. Их характеристика дана в табл. 1.
Таблица 1. Характеристика исследованных препаратов

Примечание: КОЕ – колониеобразующая единица.
Суспензии жидких препаратов разбавляли деионизированной водой. Конечные концентрации препаратов в ячейках планшета люминометра рассчитывали как объемные доли, которые составляли 10-10-10-1 относительно неразбавленных препаратов.
Сухие препараты бактерий рода Bacillus регидратировали в физрастворе (0,9% р-р NaCl), сухие препараты, содержащие молочнокислые бактерии, регидратировали в молоке. При внесении сухих препаратов в жидкую среду суспензию доводили до концентрации 3·108 клеток/мл.
В качестве позитивного контроля использовали α-токоферол, эмульгированный в физрастворе (0,9% р-р NaCl) с 0,1% твин-80.
Способность препаратов супрессировать генотоксичность, вызываемую окислительным стрессом, оценивали по способность снижать уровень повреждения ДНК бактерий-биосеносоров вызванного введением эндогенного генератора АФК - 1,4-диоксид 2,3-хиноксалиндиметанола (диоксидина) в концентрации 2,25∙10-5 М.
В работе использовали генетически модифицированный штамм E.coli, содержащий плазмиду, несущую оперон luxCDABE, поставленный под контроль промотора ColD - E.coli MG1655(pColD-lux). Люминесцентный биосенсор с промотором pColD реагирует усилением свечения на наличие в клетке факторов, вызывающих повреждение ДНК [14].
Культуры биосенсоров выращивали в среде Луриа-Бертани (LB) [15] с добавлением ампициллина (100 мкг/мл) при 37оС до ранней или средней логарифмической фазы. Ночную культуру разбавляли свежей средой до плотности 0,01 единица Мак-Фарланда (концентрация 3·106 клеток/мл) для Rec-штамма и 0,1 единица Мак-Фарланда (концентрация 3·107 клеток/мл) для ColD-штамма, измерения проводились при помощи денситометра DEN-1B («Biosan»). Затем суспензию подращивали в течение 2 ч. Аликвоты этой культуры (по 90 мкл) переносили в ячейки планшета для люминометрии, добавляли в них по 10 мкл тестируемого препарата и по 10 мкл 1,4-диоксид 2,3-хиноксалиндиметанола (кроме контрольных ячеек). В контрольные ячейки добавляли 10 мкл деионизированной воды либо, в соотвествующих вариантах опыта, 10 мкл молока.
Измерение люминесценции проводили на микропланшетном люминометре LM–01T (Immunotech, Чехия) при 370С в течение 2 часов с интервалом между измерениями 10 мин согласно инструкции к прибору. Все расчеты проводили с использованием величины интенсивности люминесценции в единицах прибора, измеренной на 90 минуте после введения 1,4-диоксид 2,3-хиноксалиндиметанола в суспензию биосенсора.
Фактор индукции SOS ответа (Is) вычисляли по формуле:
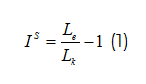
где Lk – интенсивность люминесценции контрольной пробы;
Le– интенсивность люминесценции опытной пробы.
Показатель протекторной активности (А, %) вычисляли по формуле:
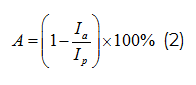
где Ia – фактор индукции SOS-ответа исследуемым воздействием в присутствии протектора;
Ip- фактор индукции SOS-ответа исследуемым воздействием.
Для значения протекторной активности были подсчитаны доверительный интервал
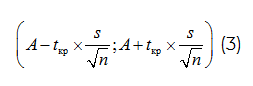
tкр определяется по таблице распределения Стьюдента;
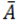 – среднее значение показателя протекторной активности;
– среднее значение показателя протекторной активности;
s – среднее квадратичное отклонение показателя протекторной активности, вычисляемое по формуле:
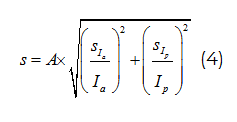
Среднее квадратичное отклонение факторов индукции SOS-ответа вычисляли по формуле:
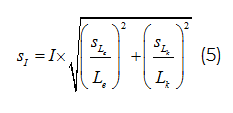
где индексы e и k относятся к опыту и контролю, соответственно.
Расчеты доверительных интервалов проводились для р=0,05.
Результаты и обсуждение. На рис. 1 представлена типичная кривая динамики биолюминесценции SOS-lux-биосенсора в присутствии 1,4-диоксид 2,3-хиноксалиндиметанола и/или протектора. Как видно на рисунке SOS ответ развивается через 50 минут после введения индуктора. Очевидно это время необходимо для накопления достаточного количества повреждений ДНК. Введение протектора снижает интенсивность свечения культуры биосенсорного штамма, что свидетельствует об ослаблении генотоксического эффекта. В качестве позитивного контроля мы использовали α-токоферол в концентрациях 10-2 – 10-11 М. Максимальная протекторная активность была отмечена для концентрации 10-6 М (рис. 2).
На рис. 3 представлена зависимость доза/SOS-ответ для 1,4-диоксид 2,3-хиноксалиндиметанола. Как можно видеть из представленных данных, наиболее эффективная индукция свечения характерна для концентрации 2,25·10-5 М, которая и была использована для дальнейших исследований. Генотоксичность больших концентраций маскируется подавлением свечения бактерий.
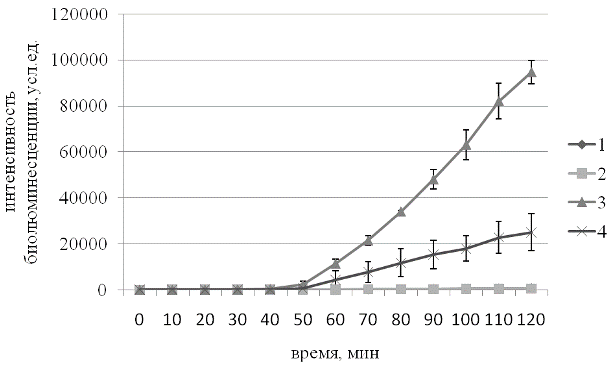
Рис. 1. Интенсивность биолюминесценции штамма E.coli MG1655 pColD-lux при обработке 1,4-диоксид 2,3-хиноксалиндиметанолом в концентрации 2,25*10-5 без протектора и в присутствии препарата «Натто», культивированного в среде, в относительной концентрации 10-11: 1 – контроль, 2 – контроль с протектором, 3 – 1,4-диоксид 2,3-хиноксалиндиметанол, 4 – 1,4-диоксид 2,3-хиноксалиндиметанол с протектором.
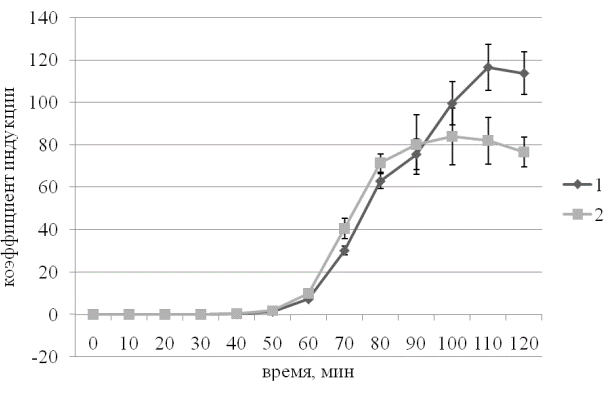
Рис. 2. Индукция биолюминесценции штамма E. coli MG1655 pColD-lux при обработке 1,4-диоксид 2,3-хиноксалиндиметанолом в концентрации 2,25*10-5 без протектора и в присутствии α-токоферола в концентрации 10-6 М.
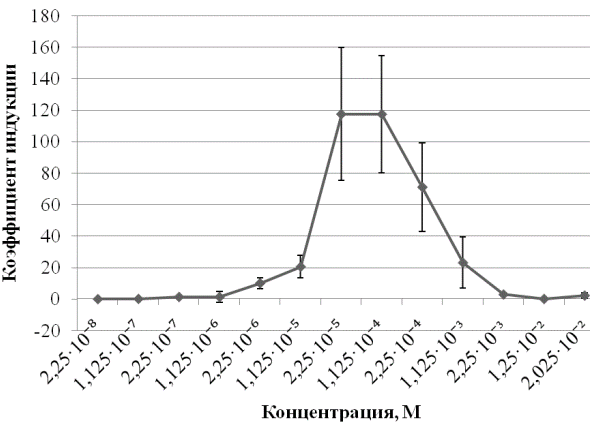
Рис. 3. Индукция биолюминесценции штамма E. coli MG1655 pColD-lux разными дозами 1,4-диоксид 2,3-хиноксалиндиметанола.
Итоговые данные по сравнительной эффективности препаратов представлены в табл. 2 и на рис. 4.
Таблица 2. Протекторная активность исследованных препаратов

Примечание: * - максимально активная концентрация.
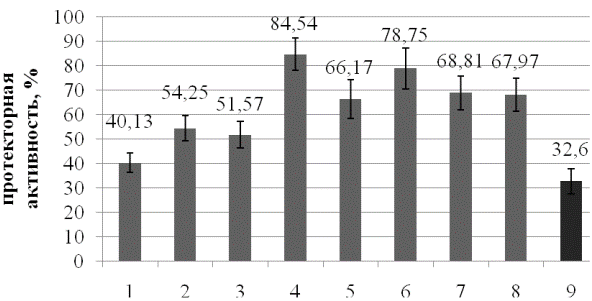
Рис. 4. Сравнительная эффективность препаратов по максимальной протекторной активности от генотоксического действия 1,4-диоксид 2,3-хиноксалиндиметанола. Цифрами от 1 до 8 показаны номера исследованных препаратов, цифрой 9 - α-токоферол.
Как можно видеть из представленных данных, изученные препараты в широком диапазоне концентраций проявляют в основном слабую (менее 50%) либо среднюю (около 50%) протекторную активность. Высокой (более 50%) протекторной активностью обладают препараты «5», «4», «6». Наименьшую протекторную активность проявляет пребиотический препарат «1».
Все исследованные препараты превосходят по антигенотоксической активности известный природный антиоксидант – α-токоферол.
Как и следовало ожидать, более эффективными оказались более многокомпонентные препараты, представляющие собой смесь пробиотических микроорганизмов, субстратов для них и продуктов их жизнедеятельности.
Препараты проявляют максимальную эффективность в разных участках диапазона концентраций от 10-11 до 10-1 объемных долей.
Отметим что наиболее высокий показатель зарегистрированной в наших экспериментах антигенотоксической активности характерен для наиболее низкой концентрации препарата «4», что подтверждает тезис о максимальной эффективности данного препарата.
Данные о наличии у пробиотических препаратов антигенотоксической и антимутагенной активности встречаются в литературе с 90-х годов прошлого века [16]. Показано, что вещества, выделяемые пробиотическими микроорганизмами способны снижать генотоксичность таких соединений, как 4-нитрохинолин-1-оксид, N-метил-N-нитро-нитрозогуанидин, 2-амино-3,4-диметилимидазо[4,5-f]хинолин, полиароматические углеводороды, афлатоксины и др. [17-19], а также защищать ДНК клеток хозяина от прооксидантного действия ионизирующего и ультрафиолетового излучений [20,21]. Вопрос о связи антимутагенной активности пробиотических бактерий с выработкой конкретных антиоксидантов практически не изучен. Тем не менее, способность лакто- и бифидобактерий вырабатывать вещества, инактивирующие АФК, подтверждена экспериментами [22-24].
Авторы аналитического обзора [25] выдвинули предположение о том, что пробиотические микроорганизмы способны вырабатывать вещества, активирующие естественные механизмы антиоксидантной защиты клеток хозяина. Отметим также, что пробиотические и симбиотические препараты, независимо от своих антиоксидантных свойств, являются одним из эффективных и, что важно, безопасных «инструментов» для профилактики и коррекции патобиохимических последствий аллергических заболеваний [26]. Таким образом, представляется разумным строить стратегию «антимутагенной терапии» с помощью пробиотических препаратов, учитывая их антиоксидантные свойства.
Отметим, что для антиоксидантов в целом характерна способность конвертировать антиоксидантный эффект в прооксидантный в зависимости от «биохимического фона» [27]. В многокомпонентных смесях продуктов жизнедеятельности микроорганизмов, таких, как препарат «4», дифференцировать эффект отдельных компонентов представляется затруднительным. Следует учитывать также возможность антагонистического взаимодействия биосенсорного штамма с пробиотическими микроорганизмами. В практическом плане необходимо провести поиск способности препарата и его отдельных компонентов усиливать генотоксичность 1,4-диоксид 2,3-хиноксалиндиметанола на клетках человека. Данные вопросы будут предметом наших дальнейших исследований.
Заключение. Таким образом, можно заключить, что большая часть изученных пробиотиков в широком диапазоне концентраций проявляют антигенотоксическую активность. Наиболее эффективным протектором можно считать препарат «4» («Линекс»). Протекторный эффект составил 84,54%. Наименее эффективным протектором из ряда изученных препаратов можно назвать препарат «1» («Хилак Форте»).
Работа выполнена при финансовой поддержке Министерства Образования РФ и Министерства здравоохранения РФ, проект № 4.5835. 2011, соглашение № 8108.
