Введение. Хронический вирусный гепатит С (ХГС) – одна из наиболее актуальных медико-социальных проблем современного общества, так как заболевание характеризуется длительным бессимптомным течением с манифестацией патологического процесса на поздних стадиях. Приблизительно 150-160 миллионов человек в мире инфицировано вирусом гепатита С и имеют высокий риск развития осложнений, таких как цирроз печени и гепатоцеллюлярная карцинома [1, 2].
В настоящее время большинство исследований направлено на изучение ХГС с клинико-иммунологических позиций: ведущая роль в развитии инфекционного процесса при вирусном гепатите С принадлежит состоянию иммунной системы организма и механизмам «ускользания» вируса от системы иммуно-биологического надзора. Иммунный ответ при хроническом гепатите С является поликлональным и мультиспецифичным: наибольшая роль отводится Т-клеточному иммунному ответу [3]. Однако в последнее время внимание исследователей уделяется определяющему значению цитокинового профиля. Т-лимфоциты хелперы (Тх) дифференцируются на 2 группы, в зависимости от эффектов выделяемых ими цитокинов: Тх 1 типа продуцируют интерферон- γ (ИФН- γ), интерлейкин-2 (ИЛ-2), фактор некроза опухоли- α (ФНО-α), стимулируя цитотоксичность Т-лимфоцитов и Т-клеточный иммунный ответ, который ассоциируется с защитным антивирусным эффектом, Тх 2 типа вырабатывают ИЛ-6, ИЛ-10, ИЛ-4, обеспечивая гуморальный иммунный ответ, активация которого, в свою очередь, может вести к утяжелению течения заболевания и переходу его в хроническую форму [4, 8]. Цитокины принимают участие в контроле вирусной репликации, реализации воспалительного процесса и играют важную роль в повреждении печени, активируя цитотоксические эффекторные механизмы. Нарушение баланса продукции цитокинов клетками Тх 1 типа и Тх 2 типа играет ведущую роль в процессе хронизации вирусной инфекции. Ключевая роль в формировании иммунного ответа в месте локализации возбудителя и общей реакции организма на патоген принадлежит каскаду иммунных реакций, опосредованных действием цитокинов. По функциональной активности цитокины можно разделить на провоспалительные (ФНО-α, ИФН-γ, ИЛ-1β, ИЛ-6, ИЛ-8) и противовоспалительные (ИЛ-4, ИЛ-10, ФНО-β ) [5,6]. По данным ряда авторов, нарушение баланса между продукцией провоспалительных и противовоспалительных цитокинов играет определяющее значение в иммунных механизмах поражения печени и формировании хронической персистирующей вирусной инфекции [7].
Цель исследования: изучение некоторых особенностей цитокинового профиля больных ХГС на фоне интерферонотерапии.
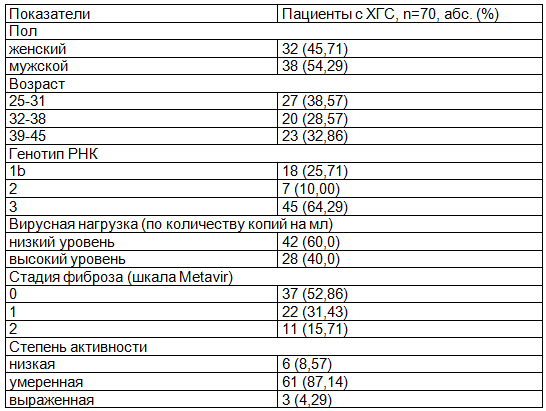
Материалы и методы. Под наблюдением находилось 70 человек, проходивших стационарное лечение в гепатологическом отделении центра инфекционных болезней ГБУЗ АО "Архангельская областная клиническая больница" г. Архангельска за период с 2013 по 2015 г. по поводу хронического вирусного гепатита С. Мужчины составили 54,3%, женщины 45,7%. Возраст обследованных находился в интервале от 25 до 45 лет, средний возраст 35,0±1,0 лет (табл. 1). Верификация диагноза проводилась с помощью обнаружения специфических серологических маркеров вируса гепатита С (HCV) методом полимеразной цепной реакции (анти-HCV, анти-HCV core IgM, анти-HCV core IgG, анти-HCV NS3, NS4, NS5). Диагноз хронического вирусного гепатита С ставился в соответствии с современными требованиями, с учётом классификации хронических гепатитов Лос-Анджелес, 1994 г. [9], МКБ 10 пересмотр [10].
Группа больных в количестве 33 человек (47,14%) получала комбинированную противовирусную терапию (ПВТ) пегилированным интерфероном ИНФ-α2 в комбинации с рибавирином, по дозам и длительности лечение соответствовало генотипу вируса и массе больного [10], остальные 37 (52,86%) больных получали базисную терапию.
Группу контроля составили 30 здоровых доноров в возрасте от 25 до 45 лет, средний возраст 35,0±1,0 лет. Женщин было 60,0% (18 человек), мужчин – 40,0% (12 человек). Обследование проводилось однократно, в ходе профилактического осмотра. От всех обследованных получено добровольное информированное согласие на участие в исследовании.
Таблица 1. Характеристика пациентов с ХГС
Кровь для иммунологического анализа получали путем пункции локтевой вены в строго стерильных условиях на 2-е сутки пребывания в стационаре. Взятие крови осуществляли в утренние часы (8-9 часов) строго натощак. Для иммунофенотипирования кровь объёмом 2,5-3 мл забирали в одноразовые вакутейнеры (BD Vacutainer), содержащие динатриевую соль ЭДТА.
Иммунологические исследования проводились на базе Центральной научно-исследовательской лаборатории Северного Государственного Медицинского Университета с использованием наборов реагентов для иммуноферментного анализа (ЗАО «Вектор Бест», Россия) с чувствительностью от 0 до 5 пг/мл и динамическим диапазоном 0-1000 пг/мл в соответствии с инструкциями по применению тест-систем и оборудования - Иммуноферментный планшетный анализатор «Reader 2020» (пр-во Швеция).
Статистическая обработка полученных результатов проводилась с использованием пакета программ для статистической обработки данных STATA (Stata Corp, TX, USA). Применялись статистические методы описательной статистики, корреляционного анализа, вычисляли среднюю арифметическую (M), среднюю ошибку арифметической (m). Также описание выборки проведено с помощью подсчёта медианы (Ме) и интерквартального размаха в виде 25 и 75 процентилей (С25 и С75). Учитывая отсутствие нормального распределения уровней цитокинов, был использован непараметрический критерий Манна-Уитни. Различия считались статистически значимыми при p<0,05.
Результаты и их обсуждение. При исследовании цитокинового профиля у больных ХГС отмечался достоверно повышенный уровень провоспалительных цитокинов, по сравнению с показателями здоровых лиц (табл. 2). Наибольшее различие обнаружено в уровнях провоспалительных цитокинов ИЛ-6 и ИЛ-8: их среднее значение у больных ХГС более чем в 8 раз превышало показатели контрольной группы. Также повышенными по сравнению с контролем были уровни других провоспалительных цитокинов: ИЛ-1β более, чем в 3 раза; ФНО-α более, чем в 5 раз; ИФН- γ в 2 раза. Высокий уровень провоспалительных цитокинов можно объяснить длительным воздействием HCV на организм человека, что ведёт к повышенной активации макрофагально-моноцитарных клеток и способствует поддержанию воспалительного процесса в печени больных. Обратная закономерность отмечена в отношении уровня противовоспалительных цитокинов, таких как ИЛ-4 и ИЛ-10 (снижение по сравнению с контролем в 2,7 раз), что может свидетельствовать о дисбалансе цитокиновой системы в пользу преобладания продукции провоспалительных цитокинов, что приводит к затяжному, распространённому и интенсивному воспалению печеночной ткани.
Таблица 2. Цитокиновый профиль у больных ХГС и у здоровых лиц, пг/мл (M±m)
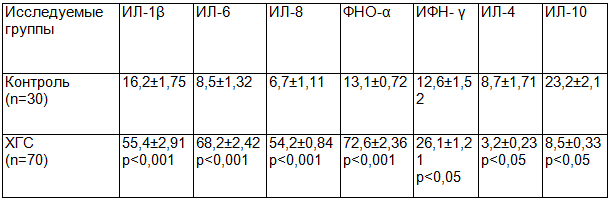
Примечание: p – статистическая значимость различий по сравнению с контрольной группой.
Исходя из распределения количества РНК вируса гепатита С, больные были разделены на две подгруппы: с низким уровнем вирусной нагрузки (менее 200*104 копий РНК/мл) n=42 и высоким уровнем вирусной нагрузки (более 200*104 копий РНК/мл) n=28. Содержание РНК вируса гепатита С в сыворотке крови характеризовалось: Ме =106,6 *104 копий РНК/мл, С25=1,77*104 копий РНК/мл, С75=178,2*104 копий РНК/мл. Минимальное содержание РНК вируса = 0 копий РНК/мл, максимальное - 381*105 копий РНК/мл (табл. 3).
Таблица 3. Распределение количества РНК вируса гепатита С в крови больных в зависимости от степени вирусной нагрузки (Ме, С25 - С75)

Примечание: p – статистическая значимость различий по сравнению с группой больных ХГС с низкой вирусной нагрузкой.
При оценке состояния спонтанной цитокиновой секреции отмечалась повышенная активность мононуклеарных клеток к выработке провоспалительных цитокинов и угнетение активности к синтезу противовоспалительных цитокинов вне зависимости от степени вирусной нагрузки, по сравнению с контрольной группой (рис. 1).
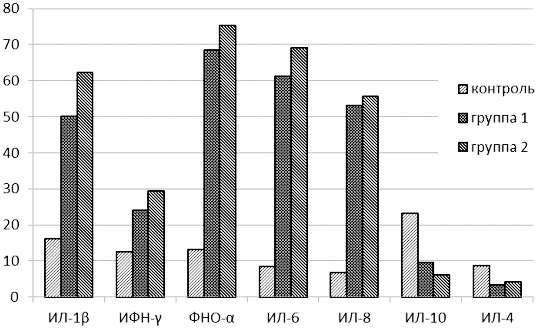
Рис. 1. Уровень синтеза цитокинов в крови больных ХГС с разной степенью вирусной нагрузки, по сравнению с контрольной группой, пг/мл. Примечание: группа 1 – низкая степень вирусной нагрузки, группа 2 – высокая степень вирусной нагрузки.
Исходя из полученных результатов, представленных графически, можно отметить, что уровни провоспалительных цитокинов ИЛ-1β и ФНО-α статистически значимо были выше у больных ХГС, имеющих высокую вирусную нагрузку (p<0,001). Это может отражать способность данных цитокинов быть основными медиаторами иммунного воспаления, острофазного ответа на уровне всего организма и впоследствии обеспечивать местную воспалительную реакцию и деструкцию клеток печени. В уровнях синтеза других провоспалительных цитокинов (ИНФ-γ, ИЛ-6, ИЛ-8) не наблюдалось статистически значимых различий в зависимости от степени вирусной нагрузки (p>0,05), хотя их значительное превышение показателей контрольной группы имеет высокую статистическую значимость (p<0,001). В данном случае можно предположить, что эта особенность является отражением наличия хронического воспаления печени, вне зависимости от количества циркулирующей в крови РНК вируса. Рассматривая уровни противовоспалительных цитокинов в зависимости от степени вирусной нагрузки можно отметить более высокие показатели ИЛ-10 у лиц с низким уровнем вирусной нагрузки (p<0,05). Возможно, именно более высокий уровень ИЛ-10, действие которого направлено на активацию противовоспалительных механизмов ингибирует синтез провоспалительных цитокинов в группе с низкой степенью вирусной нагрузки [8]. При сравнении показателей ИЛ-4 у лиц с высокой и низкой степенью вирусной нагрузки, статистически значимых различий выявлено не было.
На фоне проводимого лечения (после 3-х месяцев от начала соответствующей терапии) можно отметить достоверные различия в уровнях про- и противовоспалительных цитокинов в обеих группах, по сравнению с состоянием до лечения (табл. 4).
Таблица 4. Цитокиновый профиль у больных ХГС, в зависимости от проводимой терапии, пг/мл (M±m)
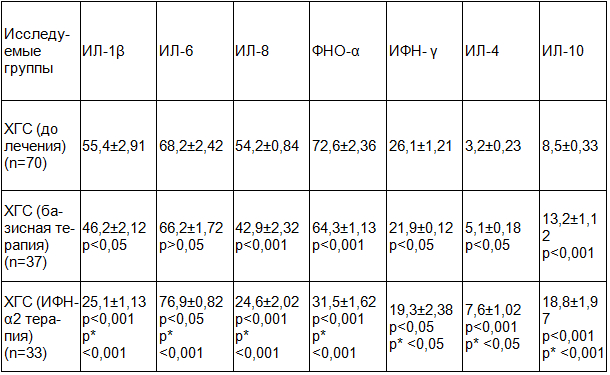
Примечание: p - статистическая значимость различий по сравнению с показателями до лечения, p* - статистическая значимость различий в сравниваемых группах.
Изменение баланса цитокинов на фоне проводимой интерферонотерапии может отражать некоторые механизмы ингибирующего действия ИНФ-α2 на вирус гепатита С. [11]. Можно отметить достоверное (p<0,001) снижение концентраций таких провоспалительных цитокинов, связанных с проявлениями некробиотических и мезенхимально-воспалительных процессов, как ИЛ-1β, ИЛ-8, ФНО-α на фоне лечения ИНФ-α2, что говорит о ведущей роли данных цитокинов в патогенезе ХГС. Изменение уровня ИФН- γ в процессе лечения у больных обеих групп имело статистически не значимые различия и было менее информативным. Интересные данные получены по результатам измерения уровней ИЛ-6: на фоне интерферонотерапии наблюдалось достоверное повышение его концентрации. По своей природе ИЛ-6 является типичным провоспалительным цитокином, однако может оказывать и противовоспалительное действие, ограничивая синтез других провоспалительных цитокинов (ФНО-α, ИЛ-1β), что отражает реципрокные взаимоотношения между различными группами цитокинов [11]. При оценке показателей провоспалительных цитокинов на фоне проведения базисной терапии, можно также отметить их снижение, однако, оно является менее выраженным и достоверным по сравнению с показателями на фоне интерферонотерапии. Это может свидетельствовать о постоянном наличии процесса хронического воспаления печени и недостаточной эффективности базисной терапии.
Динамика сывороточных показателей противовоспалительных цитокинов ИЛ-4 и ИЛ-10 проявляется в их повышении, более достоверном (p<0,001) при лечении препаратами ИНФ-α2, по сравнению с показателями до лечения. Это может свидетельствовать о том, что введение интерферона может активировать синтез противовоспалительных цитокинов.
Исследование профиля провоспалительных и провоспалительных цитокинов в сыворотке крови больных ХГС может иметь важное диагностическое и прогностическое значение и требует дальнейшего изучения.
Выводы:
- Особенностью цитокинового профиля больных хроническим гепатитом С является дисбаланс между уровнями провоспалительных цитокинов ИЛ-1β, ИЛ-6, ИЛ-8, ФНО-α, ИФН-γ и противовоспалительных ИЛ-4, ИЛ-10, что может свидетельствовать о дезинтеграции воспалительного процесса в печени и длительном хроническом течении заболевания.
- При исследовании цитокинового статуса в зависимости от степени вирусной нагрузки установлено, что наименее выраженные изменения выявляются при низкой степени вирусной нагрузки: низкий уровень вирусной РНК оказывает слабое влияние на развитие иммунного ответа. Высокая степень вирусной нагрузки в наибольшей степени ведёт к повышению уровней провоспалительных цитокинов ИЛ-1β и ФНО-α, что говорит об их ведущей роли в механизмах иммунного воспаления.
- Применение препаратов интерферона α у больных хроническим гепатитом С приводит к снижению уровня провоспалительных цитокинов, что свидетельствует об эффективности интерферонотерапии в качестве иммунокоррегирующей.
