Введение. Проблема туберкулёза остаётся чрезвычайно важной в современной медицине, несмотря на достигнутый прогресс в борьбе с этим инфекционным заболеванием. На долю России приходится более трети (38%) всех впервые выявленных больных и рецидивов туберкулёза в Европейском регионе Всемирной организации здравоохранения (ВОЗ). Хотя отмечается улучшение некоторых показателей по туберкулёзу с 2008 года в Российской Федерации, эффективность лечения остаётся неудовлетворительной. В первую очередь это связано с проблемой множественной лекарственной устойчивости (МЛУ) возбудителя, которая приобрела в последнее время глобальное значение [1,3,9].
По данным ВОЗ доля пациентов с туберкулёзом с МЛУ mycobacterium tuberculosis (МБТ) среди впервые выявленных больных варьирует от 0 до 28.3%, среди ранее леченых пациентов – от 0 до 61.6%. Около 60% среди всех больных туберкулёзом с МЛУ МБТ приходится всего на три страны мира: Китай, Индию и Россию. Регистрируется неуклонный рост доли туберкулёза с МЛУ возбудителя у впервые выявленных пациентов с 6.7% в 1999 г. до 17.1% в 2010 г. В Российской Федерации распространение МБТ с МЛУ у впервые выявленных больных по разным регионам составляет 5.9-18.7%, среди контингентов противотуберкулёзных диспансеров – 23.2-50.0% [1,3,8,9].
Лабораторное подтверждение туберкулёзной этиологии заболевания является одной из главных составляющих в верификации диагноза туберкулёза. Проблемы в этой области известны и связаны в первую очередь с медленным ростом возбудителя, сложностью его выделения из различного клинического материала и, как следствие, длительностью получения результатов определения лекарственной чувствительности к противотуберкулёзным препаратам (ПТП). В условиях, когда существенно увеличилось количество случаев заболевания, вызванных Mycobacterium tuberculosis , устойчивых к основным препаратам, в том числе к сочетанию изониазида и рифампицина, - множественная лекарственная устойчивость, решение этих проблем становится первоочередной задачей [2,7].
Современная микобактериологическая диагностика туберкулёза и микобактериозов осуществляется в трёх направлениях: ускоренное выявление в диагностическом материале микобактерий, проведение видовой идентификации и определение лекарственной чувствительности к ПТП.
В последнее десятилетие особое место в диагностике туберкулёза заняли современные молекулярно-генетические технологии, которые являются наиболее быстрыми, высокочувствительными и специфичными [2,6].
Молекулярно-генетические методы определения лекарственной устойчивости основаны на выявлении мутаций в геноме микобактерии туберкулёза. При резистентности к изониазиду обнаружены мутации в генах каtG, inhA, ahpC, kasA, при устойчивости к рифампицину – в гене rpoB. Использование данных методов позволяет в течение 2-3 дней определять устойчивость к определённым генам и корректировать режим химиотерапии. Эти методы позволяют также определить видоспецифичность МБТ и провести дифференциальную диагностику с нетуберкулёзными микобактериозами [5,7].
В структуре больных туберкулёзом лёгких следует выделить особую группу, у которой, несмотря на новые методы обнаружения возбудителя, выявить МБТ не удаётся, и диагноз ставится исключительно по клинико-ренгенологическим данным. Эти пациенты без бактериовыделения, как правило, с ограниченными формами туберкулёза, проходят курс лечения без идентификации МБТ и определения теста лекарственной чувствительности.
Цель исследования. Изучение частоты встречаемости лекарственной устойчивости возбудителя у больных без бактериовыделения с ограниченными формами туберкулёза лёгких.
Материалы и методы. Под наблюдением находились 52 пациента, которые на период с 2012 по 2013 г. проходили курс химиотерапии по стандартным режимам в условиях лёгочно-терапевтического и лёгочно-хирургического отделений Воронежского областного клинического противотуберкулёзного диспансера им. Н.С. Похвисневой.
По материалам 52 историй болезни пациентов проводился анализ формы лёгочного процесса, длительность лечения в терапевтическом отделении, характер операции в хирургическом отделении и оценка результатов устойчивости возбудителя из операционного материала, определённых методом полимеразной цепной реакции в режиме реального времени (ПЦР real time).
Результаты и обсуждение. В исследуемой группе находилось 37 мужчин и 15 женщин. Мужчин в возрасте от 35 до 55 лет было 75%, 24% пациентов принадлежали возрастной группе от 18 до 30 лет и только 1% больных на момент исследования было больше 55 лет. Среди женщин наблюдалась аналогичная ситуация: наибольшее количество (53%) пришлось на возраст от 35 до 50 лет, 33% пациентов находились в возрастных рамках от 18 до 30 лет, и 14% больных было больше 55 лет.
Анализ рентгенархивов до операции показал, что у подавляющего числа пациентов (83%) туберкулёзный процесс локализовался в первом и втором сегментах лёгкого, полисегментарное поражение наблюдалось в 10% случаев, и только у 7% больных заинтересован был шестой сегмент лёгкого. Деструкция лёгочной ткани зафиксирована на момент начала химиотерапии в 27% случаев (меньше чем у трети пациентов). Размер наибольшего очага в поражённом лёгком до 1.0 см наблюдался у 10% исследуемых, наибольшего фокуса от 1.0 до 2.5 см – у 59.6%, и фокус размерами больше 2.5 см – у 30.4% (рис. 1).
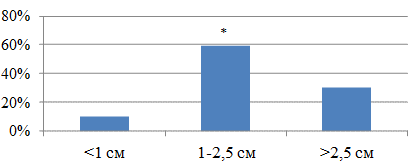
Рис. 1. Частота встречаемости очагов и фокусов различных размеров у больных туберкулёзом лёгких без бактериовыделения по рентгенологическим данным: здесь и далее * p<0.05 – достоверные различия с другими величинами.
Всем пациентам при поступлении в стационар проводился анализ мокроты как стандартными методами (посев на твёрдые и жидкие питательные среды ), так и молекулярно-генетическими методами с помощью тест-системы GeneXpert. До операции у 15% больных наблюдался микророст культуры МБТ по данным посева на твёрдые питательные среды. 46 пациентов прошли тестирование системой GeneXpert, и только у 4% из них выявлена дезоксирибонуклеиновая кислота (ДНК) МБТ в мокроте, которая оказалась чувствительна к рифампицину. У остальных больных тест на ДНК МБТ был отрицательным. 6 пациентам молекулярно-генетическое исследование мокроты не проводилось по техническим причинам (рис. 2).
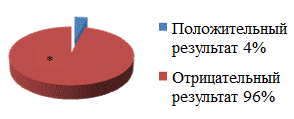
Рис. 2. Чувствительность метода GeneXpert при исследовании мокроты у больных без бактериовыделения или с микроростом культуры МБТ.
Больным на момент исследования режим химиотерапии был назначен эмпирически без определённого спектра чувствительности МБТ. В лёгочно-терапевтическом отделении 1 режим химиотерапии (РХТ), интенсивную фазу, получали 37 пациентов. 2 Б РХТ и 2 А РХТ были назначены двум больным, которые пролечились около трёх месяцев. 13 пациентов из исследуемой группы химиотерапию не получали. Диагноз туберкулёза и режим химиотерапии были утверждены им после оперативного вмешательства. Длительность интенсивной фазы до операции варьировала: 54% больных лечились до операции больше трёх месяцев, 30% - от двух до трёх месяцев и только 16% пациентов химиотерапию получали не больше двух месяцев. В целом 75% больных получали до операции тот или иной курс лечения противотуберкулёзными препаратами, из них больше половины (84%) находились в лёгочно-терапевтическом отделении свыше 60 койко-дней.
На фоне химиотерапии отсутствие динамики туберкулёзного процесса наблюдалось в 69% случаев, положительная динамика в виде рассасывания очагов и уменьшения размеров фокусов зафиксирована у 23% пациентов. Обращает на себя внимание, что положительная рентгенологическая картина выявлена у трёх больных, оказавшихся после операции с МЛУ туберкулёзом лёгких. Отрицательная динамика процесса обнаружена в 8% случаев и не связана с инфицированностью МЛУ МБТ (рис. 3).

Рис. 3. Эффективность режимов химиотерапии до операции.
Пациенты в исследуемой группе были с ограниченными формами туберкулёза лёгких. Лечение им назначалось впервые, до поступления в стационар химиотерапия никогда не проводилась. Только двое из них в прошлом имели судимость, а контакт с больными МЛУ туберкулёзом лёгких зафиксирован в 7.6% случаев. Среди пациентов с отсутствием динамики на фоне лечения только у половины впоследствии выявлен возбудитель с МЛУ.
84% больных находились до операции в стационаре больше двух месяцев и получали режим химиотерапии без определения чувствительности МБТ к лекарственным препаратам. Все пациенты на определённом этапе лечения были прооперированы. В подавляющем большинстве выполнены сегментраные резекции, лобэктомия произведена у одного больного. Послеоперационных осложнений не выявлено. Инфильтративный туберкулёз гистологически подтверждён в 90% случаев, туберкулома – в 6%, остальные формы туберкулёза пришлись на диссеминированный и очаговый.
Интраоперационно всем больным проводилось молекулярно-генетическое исследование на обнаружение ДНК МБТ в операционном материале методом ПЦР real time. Чувствительность метода составила 92.3% (рис. 4).
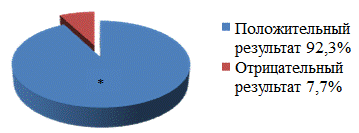
Рис. 4. Чувствительность метода ПЦР real time в операционном материале.
МЛУ МБТ после операции зафиксирована в 36.5% случаев, монорезистентность к изониазиду – в 9.6%. Таким образом, коррекция лечения в послеоперационном периоде потребовалась у 46.1% пациентов, а более чем у трети больных - кардинальная смена режима химиотерапии (назначение 4 РХТ) с удлинением сроков пребывания в стационаре и соответственно повышением стоимости лечения.
Больные с ограниченными формами туберкулёза лёгких без бактериовыделения после 2-3 месячного курса химиотерапии по 1РХТ признаются противотуберкулёзной службой эффективными по прекращению бацилловыделения и часто трудоспособными. Такие пациенты переводятся в 3 группу диспансерного учёта с клиническим излечением, несмотря на то, что более чем у трети из них имеется скрытая МЛУ и соответственно высок риск рецидива туберкулёза. Всё это способствует распространению МЛУ туберкулёза в популяции людей, а также повышает экономические затраты на лечение.
Выводы
1. Учитывая данные эпидемиологического анамнеза, клиническую и рентгенологическую картину заболевания у больных туберкулёзом лёгких без бактериовыделения или с микроростом культуры возбудителя, предположить инфицированность МБТ с МЛУ невозможно. Необходимо доказать наличие у больного МБТ, а также обязательно определить спектр лекарственной чувствительности с помощью современных молекулярно-генетических методов.
2. МЛУ МБТ после операции зафиксирована в 36.5% случаев, монорезистентность к изониазиду – в 9.6%. Коррекция лечения в послеоперационном периоде потребовалась у 46.1% пациентов, а более чем у трети больных – кардинальная смена режима химиотерапии (назначение 4 РХТ) с удлинением сроков пребывания в стационаре и соответственно повышением стоимости лечения.
3. Проведённый анализ показал высокую специфичность и чувствительность метода ПЦР real time для обнаружения ДНК МБТ в операционном материале по сравнению с выявлением возбудителя в мокроте больного любыми способами.
4. Для повышения клинической эффективности лечения больных туберкулёзом лёгких без бактериовыделения необходима ранняя верификация диагноза туберкулёза, своевременное выявление возбудителя с МЛУ. Это возможно при оперативном вмешательстве с интраоперационном определением лекарственной чувствительности МБТ.
