Введение
Лактоферрин является полифункциональным белком из семейства трансферринов, обладающим антибактериальным, противовирусным, антиканцерным, противогрибковым, противопаразитарным, антиоксидантным и регенеративным свойствами. Лактоферрин представлен в молоке человека и других млекопитающих молоко [1].
Ограниченная доступность человек молока и очищенного лактоферрина была главным препятствием для (клинических) исследований о потенциальных нутрицевтиках и фармацевтическом применении чЛФ. Чтобы преодолеть это ограничение, возможность крупномасштабного производства функционального рекомбинантного человеческого лактоферрина (rhLF) изучалась в различных системах экспрессии [2].
В ряде работ исследованы способы получения рекомбинантного лактоферрина помощью микроскопических грибов Aspergillus [3-5], трансгенного риса [6], также куриных яиц [7]. Продемонстрирована способность получать лактоферрин из молока трансгенных коров [8], коз [9], мышей [10,11]. Тем не менее, до сих пор предложенные технологические решения обладают рядом недостатков, таких как низкий выход целевого продукта, высокая себестоимость, низкая биодоступность и пр., что делает поиск новых способов его получения актуальной задачей.
Гибкость метаболизма и высокая способность микроорганизмов к адаптации, высокая скорость роста, простота культивирования, изученность генетики, разработанные методы направленного создания штаммов с заданными свойствами - преимущества, делающие микробный синтез получения лактоферрина перспективным.
Целью данного исследования является получение штамма E. coli, осуществляющего продукцию лактоферрина человека при цитоплазматической экспрессии, и подбор параметров его культивирования.
Объекты и методы исследования
Реактивы: этилендиаминтетрауксусная кислота (ЭДТА), додецилсульфат натрия (SDS), борная кислота, натрия гидроксид, акриламид, N,N,N’,N’-тетраметилэтилендиамин (ТЕМЕД), персульфат аммония, глицин, кумаси R-250, перхлорат натрия, бромфеноловый синий, глицерин, Tween 20, трис, кислота соляная, 0,1% DS-Na, хлористый натрий (Invitrogen, США), LB-среда (Gibco BRL, США), раствор PBS, бычий сывороточный альбумин компании (Силекс, Россия), TRITON X-100, мочевина, 2-меркаптоэтанол, лактоферрин, ампициллин, (Sigma, США), набор QuickClean (Sigma, США), набор выделение «ДНК из агарозных гелей» (Силекс, Россия). Ферменты: ДНК- полимеразы Taq u pfu, T4 ДНК-лигаза, эндонуклеазы рестрикции XhoI и EcoRI, рибонуклеаза (Силекс, Россия). Среда LB (1% NaCl, 0,5% дрожжевой экстракт, 1% триптон) (Gibco BRL, США). Маркеры: ДНК на 1kb и белковые на 10-250кДа (Сибэнзим, Россия). Индукторы: лактоза (Профифарм, Россия), ИПТГ (изопропил-β-D-тиогалактопиранозид) (Almabion, Россия).
Штамм E. coli BL21 DE3 fhuA2 [lon] ompT gal (λ DE3) [dcm] ∆hsdS λ DE3 = λ sBamHIo ∆EcoRI-B int::(lacI::PlacUV5::T7 gene1) i21 ∆nin5 (Novagen, USA).
Вектор вектор pT7-FLAG™-2 (Sigma, США) использован для экспрессии гена лактоферрина.
Синтез мРНК. мРНК лактоферрина человека (LTF lactotransferrin [Homo sapiens]) синтезирована компанией Евроген (Россия) исходя из последовательности базы данных GenBank (23268458), в которой были проведены незначащие нуклеотидные замены, позволяющей лучше экспрессироваться в бактериях. Синтез осуществляли таким образом, чтобы структурная часть мРНК, кодирующая лактоферрин, на своих концах содержала сайты рестрикции XhoI и EcoRI для последующей амплификации и клонирования в вектор pT7-FLAG -2, а также непосредственно за кодирующей последовательностью был расположен участок, соответствующий гексагистидиновой последовательности. В результате индуцируемой экспрессии клонированного гена будет синтезироваться лактоферрин, содержащий дополнительную гексагистидиновую последовательность в С-концевой области полипептидной цепи, позволяющую осуществлять последующую аффинную чистку белка на Ni-NTA-агарозе.
Клонирование гена в вектор pT7-FLAG -2
Стандартные способы ДНК были использованы для строительства рекомбинантной плазмиды. Ферменты приобретены от Силекс (Россия) и использованы согласно рекомендации производителя. Наборы Sigma (США) и Силекс (Россия) использованы для выделения плазмиды и элюирования ДНК из агарозного геля. Компетентные клетки E. coli получены согласно методу с использованием хлористого кальция [12]. Амплифицировали ген посредством ПЦР (Режим: первоначальный нагрев (95˚- 3 мин), 30 циклов: денатурация (95˚- 30 с), отжиг (60˚- 30 с), элонгация (72˚ - 1 мин) и синтез 72˚ - 1 мин. Реакцию проводили в амплификаторе Терцик (ДНК-технология, Россия). Положительные клоны подвергали скринингу путем выделения плазмиды и выполнения ПЦР.
Культивирование штамма-продуцента Е. coli. Проводили трансформацию клеток E.coli выбранной плазмидой.
Затем переносили петлей 5-10 колоний в 5 мл жидкой LB, содержащей 100 мкг/мл ампициллина (в случае трансформирования плазмидой рТАС) / канамицина и 50 мкл 50% глюкозы и поставили на ночь при 37˚С. 1 мл ночной культуры перенесли в 100 мл свежей питательной среды, содержащей 1 мл 50% глюкозы, 100 мкг/мл ампициллина / канамицина и продолжили культивировать перемешивая при 37˚С, контролируя оптическую плотность при 600 нм. При достижении OD600 0,6-0,8 100 мл культуры были перенесены в 3 л среды LB, содержащей 30 мл 50% глюкозы, 100 мкг/мл канамицина. Затем вновь продолжили культивировать при 37˚С, а при достижении OD600 0,6 снизили температуру культивирования до 23 и добавили 1ммоль ИПТГ.
После культивирования культуру центрифугировали. Полученные клетки ресуспендировали в 50 ммоль PBS буфере (pH 8,0), содержащем 200 ммоль NaCl. Добавляли ингибиторы протеаз в полученную суспензию. Клетки разрушали с помощью ультразвука на ультразвуковом гомогенизаторе Scienta-IID (China) 3 раза в режиме: 30 с. (2 с. озвучивания, 2 с перерыв) с перерывом в 1 мин на ледяной бане. После озвучивания суспензию центрифугировали при 5800 g в течение 30 мин при 4 ˚С.
Осадок промывали 0,5% Triton X-100, 2 мМ ЭДТА, 0,1 М трис-HCl. Затем осадок промывали от Triton X-100 водой, в результате были получены тельца включения лактоферрина.
Солюбилизация. В исследованиях использовали солюбилизацию мочевиной. 400 мг образца (влажного веса) телец включения лактоферрина были растворены в 10 мл 6 М мочевины (в течение 20 ч при 30˚С и затем центрифугировали. Растворимый лактоферрин присутствует в каждой надосадочной жидкости. Каждый супернатант анализировали с помощью электрофореза в агарозном геле.
Белковый электрофорез по Лэммли. Для разделения белков использовали ПААГ (10% - разделяющий и 5% - концентрирующий гель) с 0,1% DS-Na при 16 - 20 мА. Гель окрашивали раствором Кумаси R250. Анализ данных электофореза проводили с помощью программы TotalLAb.
Результаты и их обсуждение
Экспрессия ltf штаммом E. coli BL21DE3/рТ7-ltf
Амплифицированный фрагмент мРНК ltf-His tag расщепляли по концам ферментами XhoI и EcoRI и лигировали в pT7-FLAG™-2 вектор (вниз по течению от промотора) (рис. 1).
Полученная рекомбинантная плазмида pT7-ltf использована для трансформации E.coli BL21 (DE3) компетентных клеток. Выражение ltf проверено c помощью электрфореза в ПААГ и ELISA. Чтобы подтвердить клон проведено секвенирование, а выравнивание полученной нуклеотидной последовательности стандартными методами (Blast, GenBank) показал, что она была 100% идентична на аминокислотном уровне со стандартной ltf.
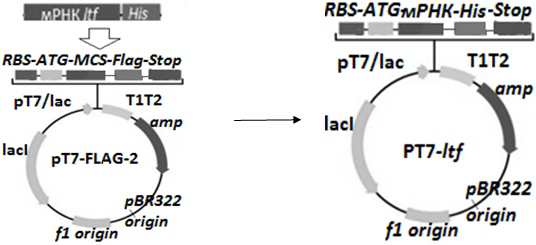
Рис. 1. Строительство рекомбинантной плазмиды pT7-ltf. мРНК гена ltf синтезирован и клонирован вниз по течению от промотора в векторе экспрессии pT7-FLAG™-2, который также содержит ген устойчивости к ампициллину.
Уровень экспрессии целевого белка (~78-80 кДа) составил 22% от всего клеточного белка, как показывает электрофорез в 10% ПААГ в присутствии SDS (рис. 2).
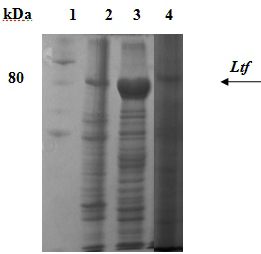
Рис. 2. Экспрессия гена ltf в E.coli BL21DE3 / рТ7- ltf: 1 - маркеры; 2 - лизат штамма BL21DE3 / рТ7- ltf после индукции; 3- растворимые белки; 4- препарат после солюбилизации.
Получен штамм, продуцирующий рекомбинантный лактоферрин как в растворимой форме, так и в виде телец включения. Фракция целевого белка от обшего растворимого белка составила 65%. Получение лактоферрина было также проведено из телец включения.
Подбор условий культивирования
Для определения возможности увеличения уровня экспрессии рекомбинантного лактоферрина, проведено несколько однофакторных экспериментов по исследованию влияния различных факторов на производство целевого белка.
В качестве тестируемых параметров выбраны следующие:
- концентрация клеток (индукционный период);
- тип и концентрация индуктора;
- температура культивирования;
- постиндукционный период.
Концентрация клеток (индукционный период).
Тестирование проводилось при различной клеточной концентрации при OD 540 нм от 0,4 до 1.
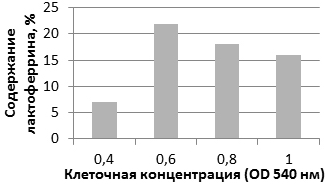
Рис. 3. Эффект воздействия клеточной концентрации на синтез лактоферрина.
Концентрация лактоферрина меняется в широких пределах. Наибольший выход лактоферрина получен при ранней индукции, концентрации клеток OD 540 нм - 0,6, что можно увидеть на рис. 3.
Эффект концентрации и типа индуктора
Используемая система экспрессии лактоферрина требует добавления индуктора ИПТГ для обеспечения транскрипции клонированного гена в плазмиде и инициации трансляции лактоферрина. В вектор экспрессии с промотором T7lac, окончательная ИПТГ концентрация должна быть оптимизирована из-за ее большого вклада в рекомбинантную экспрессию белков и серьезного вреда для роста клеток. Вследствие того, что ИПТГ является достаточно дорогостоящим соединением, проведено изучение влияние его концентрации на эффективность экспрессии и возможность эффективной замены другим соединением - лактозой. Для этого штамм E. coli BL21(DE3)/ рТ7-ltf выращивали при температуре 37 °С, индуктор вносили в концентрациях от 0,2 до 2 мМ.
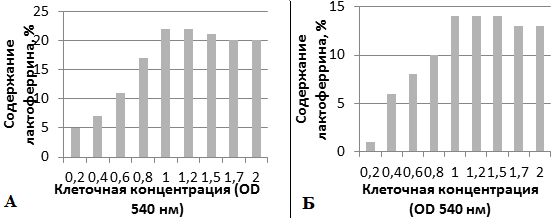
Рис. 4. Эффект воздействия концентрации индуктора на синтез лактоферрина (процентное содержание от общего клеточного белка) при культивировании при 37 °С и 24 ч постиндукционном периоде: А - ИПТГ; Б – лактоза.
Рис. 4А показывает, что концентрация индуктора оказывает сильное влияние на синтез лактоферрина. Увеличение концентрации лактоферрина замечено за счет увеличения концентрации ИПТГ от 0,2 до 1 ммоль. Максимальное процентное содержание 22% лактоферрина достигнуто при концентрации 1-1,2 мМ. С 1,5 мМ ИПТГ замечено снижение синтеза лактоферрина вследствии замедления роста бактерий при высоких концентрациях ИПТГ.
Рис. 4Б иллюстрирует эффективность использования лактозы в качестве индуктора синтеза лактоферрина. Увеличение концентрации лактоферрина замечено за счет увеличения концентрации лактозы от 0,2 до 1,5 мМ. Максимальное процентное содержание 14% лактоферрина достигнуто при концентрации 1-1,5 мМ. С 1,7 мМ замечено снижение синтеза лактоферрина вследствие замедления темпов роста штаммов. Как показывает рисунок 4 использование лактозы позволяет добиться на 8% меньше лактоферрина, чем при использовании ИПТГ.
Температура культивирования
Хорошо известно, что температура культивирования значительно влияет на производство рекомбинантного белка, особенно при получении растворимого белка. Так, с целью получения максимального выхода белка в растворимой форме, осуществляли подбор температуры культивирования бактерий. Исследована экспрессия лактоферрина в клетках BL21 (DE3) / pТ7-ltf при различных температурных режимах. После индукции культивирование рекомбинантного штамма проводили при различных температурах (37°С, 23°С, 15°С). Концентрацию лактоферрина замеряли в культуральной среде после разрушения и после солюбилизации. Эффект показан на рис. 5.
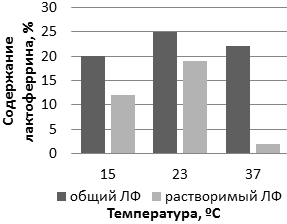
Рис. 5. Эффект воздействия температуры культивирования на синтез лактоферрина (процентное содержание от общего клеточного белка) при культивировании при 37 °С и 24 ч постиндукционном периоде.
Результаты показали, что культивирование штамма BL21 (DE3) / pТ7-ltf при 23°С позволяет получать растворимый белок-мишень в наиболее высоких концентрациях до 19% от клеточного белка. При культивировании при 37°С преимущественно весь лактоферрин нарабатывается в виде телец включения (всего 2% растворимого против 22% общего лактоферрина).
Таким образом, можно сделать вывод, что культивирование штамма при 23°С является наиболее целесообразным.
Постиндукционный период
Оптимальное время экспрессии определяется путем анализа образцов, взятых после 2, 4, 6, 8, 10 и 12 ч с момента индукции. Общий продукт слияния (растворимые и нерастворимые формы) от общего клеточного белка был проанализирован (рис. 6).
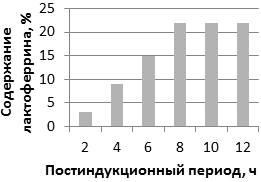
Рис. 6. Эффект воздействия продолжительности постиндукционного периода на синтез лактоферрина (процентное содержание от общего клеточного белка).
Процент продукта достиг своего максимума через 8 ч после индукции.
Полученные результаты показали, что наибольшее количество лактоферрина достигнуто при культивировании при 23°С при ранней индукции 0,6 OD клеток 1-1,2 мМ ИПТГ и культивированием после индукции с 8 ч.
На рис. 7 показаны кривые роста биомассы и накопления лактоферрина при подобранных оптимальных условиях культивирования.
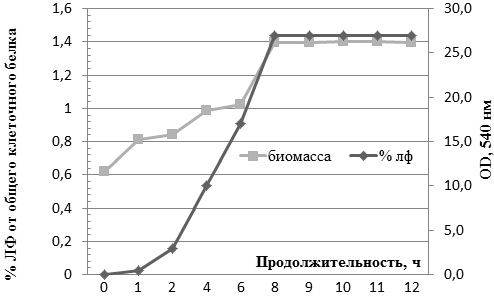
Рис. 7. Кривые культивирования штамма E. coli BL21DE3 / рТ7-ltf и процентного содержания лактоферрина к общему белку штамма.
Как показывает рис. 7, рост концентрации лактоферрина наблюдается после часа с момента начала индукции, после которых наблюдаем стремительный рост до 8 ч с момента начала индукции. С 8 ч (с момента начала культивирования) концентрация лактоферрина постоянна и находилась на уровне 26-27% от общего содержания белка штамма.
Заключение
Полученный штамм E. coli позволяет получать рекомбинантный лактоферрин как в растворимой форме, так и в форме телец включения. В результате оптимизации параметров культивирования штамма максимальный выход целевого белка (в том числе в растворимой форме) получен при культивировании при 23°С при ранней индукции 0,6 OD клеток 1-1,2 мМ ИПТГ (либо 1 мМ лактозы, однако при этом производство лактоферрина будет снижено на 8%) и культивированием после индукции в течение 8 ч. Таким образом, оптимизация позволила увеличить первоначальную производительность штамма на 15-16% общего лактоферрина и на 89% растворимого.
