Введение. Респираторные нарушения занимают ведущее место в структуре перинатальной патологии новорожденных, особенно недоношенных детей. Дыхательная недостаточность, возникшая в раннем неонатальном периоде, является наиболее частой причиной смертности и формирования хронических заболеваний легких [5,10]. Оценка характера течения воспалительного процесса в тканях легкого, бронхов и причины его вызывающие является актуальной задачей детской пульмонологии. Для этого используют преимущественно инвазивные методы диагностики: бронхографию, бронхоскопию с исследованием бронхоальвеолярного лаважа, бронхобиопсию. Но не все из этих методов широко применимы в педиатрии, особенно в периоде новорожденности. В связи с этим, в последнее время растет интерес к использованию неинвазивных методик, к которым относится сбор конденсата выдыхаемого воздуха (КВВ) для получения образцов из нижних отделов дыхательных путей [1, 2, 4, 7]. Ведущим патогенетическим механизмом развития и прогрессирования значительного числа болезней лёгких является воспаление дыхательных путей, которое сопровождается дисбалансом в системах оксиданты-антиоксиданты и протеолиз-антипротеолиз, а также высвобождением различных биомаркеров [9,11,12]. Большая часть этих соединений может быть использована в качестве биомаркеров различных воспалительных заболеваний органов дыхания. Особый интерес представляют исследования, свидетельствующие о важной роли NО в патогенезе воспалительного и иммунного процессов в легочной ткани.
Цель исследования: оценить состояние нитроксидергической системы в конденсате выдыхаемого воздуха у новорожденных детей с различной респираторной патологией.
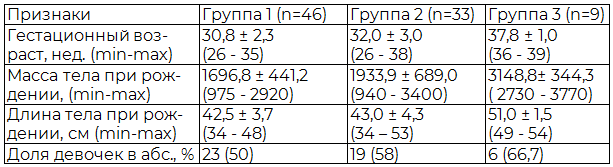
Материалы и методы исследования. В исследование включено 88 новорожденных детей, рожденных в перинатальном центре г.Читы в период с 2007 по 2009 гг. Дети обоего пола (40 мальчиков и 48 девочек), рожденные на сроке гестации 26-39 недель (в среднем 32,2±3,3), с весом от 940 г до 3770 г (1934,2 ±684,5), длинной от 34 см до 54 см (43,4 ± 4,7 см), возраст женщин 16 - 42 года (средний возраст 28,2 лет). Из 88 новорожденных – 11 двоен. Все новорожденные в неонатальном периоде имели тяжелую дыхательную недостаточность, требующую респираторной поддержки в режиме заместительной искусственной вентиляции легких (ИВЛ).
В ходе работы дети разделены на 3 группы: 1 группа (n = 46) - недоношенные с респираторным дистресс-синдром новорожденного (РДСН); 2 группа (n = 33) – дети с внутриутробной пневмоний; 3 группа (n = 9) - дети клинического контроля, новорожденные с транзиторным тахипноэ новорожденных (ТТН). Характеристика исследуемых групп представлена в табл. 1.
Таблица 1. Распределение больных по сроку гестации, массе тела, длине при рождении и полу (М±SD)
Из исследования исключались новорожденные с пороками развития лёгких, сердца, желудочно-кишечного тракта, дети с гемолитической болезнью новорожденного, дети от матерей с сахарным диабетом. Проведена анамнестическая характеристика течения беременности и родов, дана клиническая симптоматика в раннем неонатальном периоде, оценены результаты инструментальных методов исследования (электрокардиограмма (ЭКГ), эхокардиография (ЭхоКГ) с доплерографией, нейросонография (НСГ), рентгенография грудной клетки). С целью оценки функции воспалительных процессов в легочной ткани у новорожденных детей было проведено исследование стабильных метаболитов оксида азота: нитритов NO2-, нитратов NO3- и их суммарное значение NOx в конденсате выдыхаемого воздуха. Сбор конденсата выдыхаемого воздуха (КВВ) проводили из влагосборника дыхательного контура аппарата ИВЛ в 1-2 сутки жизни и хранили до исследования в замороженном состоянии. Метаболиты NО в пробах определяли спектрофотометрическим методом с использованием реактива Грисса, с восстановлением нитратов до нитритов по методике Е.А. Запрудновой. Статистическая обработка полученных данных проводилась с использованием компьютерных программ «Statistica-6.0», Microsoft Exсel 2010 в соответствии с принципами доказательной медицины (Гланц С., 1999, Реброва О.Ю., 2002).
Проверку на нормальность распределения статистических показателей проводили путем построения гистограмм в программе «Statistiсa 6.0», а также с использованием критерия Колмогорова-Смирнова. При соответствии данных нормальному распределению значения количественных признаков представляли в виде M±SD, где М – среднее значение количественного признака, SD – стандартное отклонение среднего. Различия между группами выявлялись при помощи критерия Х2.. При ненормальном распределении количественных признаков данные представляли в виде Me (25-75 перцентили), где Ме – медиана. Использовались методы непараметрической статистики с применением U-критерия Манна–Уитни (сравнение двух независимых переменных). Различия считались статистически значимыми при р<0,05.
Материалы и методы исследования. Анализ анамнеза состояния здоровья женщин показал высокий уровень заболеваемости беременных. Из экстрагенитальной патологии женщин, отмечено преобладание заболеваний почек и мочевыводящих путей (гломерулонефрит, хронический пиелонефрит, цистит, мочекаменная болезнь) у 37 женщин (42%), у 28 женщин (31,8%) беременность протекала на фоне железодефицитной анемии легкой и среднетяжелой степени. Из заболеваний сердечно-сосудистой системы можно было отметить артериальную гипертензию (30,6%), в меньшей степени артериальную гипотензию у 7 (7,9%) беременных женщин. Статистической разнице соматической патологии среди исследуемых групп у беременных женщин не обнаружено. У каждой третьей беременной женщины (32,9 %) течение гестоза разной степени тяжести, наиболее выраженные нарушения, в виде гестоза среднетяжелой или декомпенсированной формы отмечались у беременных женщин 1-ой и 2-ой групп (в 19,5 % и 21,2% случаях соответственно), что усугубляло тяжесть состояние плода и приводило к преждевременным родам.
При проведении УЗИ во время беременности хроническая фето-плацентарная недостаточность (ХФПН) субкомпенсированой формы отмечалась у женщин 1- ой группы исследования в 76,0 % и в 75,7% 2- ой группы женщин, у 5 женщин (55,5%) 3 –ей группы. Декомпенсированная форма ХФПН была во всех 3- х группах с разной частотой (17,3%, 18,1%, 22,2% соответственно). При анализе внутриутробного состояния плода выявлено в 92% случаях наличие хронической внутриутробной гипоксии плода (ХВУГП), так в 1-ой группе ХВУГП встречалась в 91,3 %, во 2- ой группе – 96,6%, и наконец, в 3- ей группе пациентов в 77,7% случаях. Состояние при рождении у всех новорожденных детей было оценено как тяжелое или очень тяжелое. Тяжесть состояния обусловлена развитием дыхательной недостаточности 2–3-й степени, что потребовало респираторной поддержки с рождения.
В группе детей с РДСН тяжелая асфиксия при рождении отмечалась в 27,3 % случаях, умеренная асфиксия в 72,7%случаях. Средняя оценка по шкале Апгар на первой минуте в данной группе детей составила 5,3 ± 1,6 баллов (от 1 до 7 балла), в последующем к 5 минуте жизни тяжелая асфиксия сохранялась у 2 – х детей (9,0%), в остальных случаях оценка по шкале составила 6,2 ±1,1 (от 3 до 7 балла). Дети 2- ой группы исследования имели асфиксию разной степени выраженности при рождении. Умеренная асфиксия встречалась в 77,0%, тяжелая в 22,9%. На 1- ой минуте жизни оценка по Апгар 5,4 ±1,6 (от 1 до 7 балла), к 5 минуте жизни увеличилась до 6,0 ± 1,9 (от 2 до 8 баллов). Однако, несмотря на проводимые реанимационные мероприятия, в данной группе детей тяжелая асфиксия сохранялась и на 5 минуте жизни у 8 детей (24,2%).
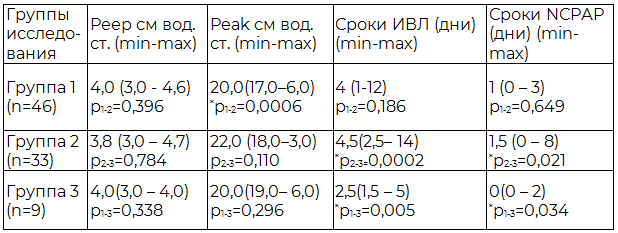
У детей 3–ей группы при рождении тяжелая асфиксия в 44,4 % случаях, оценка по шкале Апгар на первой минуте жизни составила 4,8 ± 2,0 (от 1 до 7 балла). На фоне проведения первичной реанимационной помощи быстро удалось получить положительный эффект и оценка по Апгар к 5 минуте жизни составляет 6,6 ± 1,1 (от 4 до 8 баллов). В связи с нарастанием дыхательной недостаточности все исследуемые новорожденные после рождения в впервые часы жизни переведены на ИВЛ. В группе детей с клиникой тяжелого РДСН длительность ИВЛ в среднем составляла 4,5 ± 2,5 дня (от 1 до 12 дней), со средними параметрами вентиляции: давление на выдохе (реер) 3,9 ± 0,3 см вод. ст. (от 3 до 4,6 см вод. ст.), давление на вдохе (peak) 20,4 ± 2,2 см вод. ст. (от 17 до 26), концентрация кислорода во вдыхаемой смеси больше или равной 40% требовали 27% детей, 73% нуждались в кислороде менее 40%. В последующем новорожденные находились на назальных канюлях в средние сроки 1,3 ± 0,9 дней (от 0 до 3 дней), затем оксигенотерапия через назальную маску в сроках 1,5 ± 2,1 дней (максимум 10 дней).
Группа сравнения недоношенных детей с клиникой пневмонии нуждались в ИВЛ от 2,5 до 14 дней, в среднем сроки вентиляции составили 5,1 ±2,6 дней, со следующими параметрами: реер 3,8 ±0,4 см вод. ст., peak 23,3 ± 3,6 см вод. ст., с концентрацией кислорода больше или равной 40% в 34% случаях, остальные детей (66%) имели потребность в кислороде менее 40%. Затем новорожденные после интубации нуждались во вспомогательной вентиляции, длительность неинвазивного спонтанного дыхания под постоянным положительным давлением на выдохе в среднем составило в данной группе 1,5 ± 1,4 дней, максимум 8 дней, затем оксигенотерапия еще 1,8±1,4 дней через лицевую маску. Третья группа исследования, новорожденные с ТТН, так же как и предыдущие группы детей нуждались в проведении ИВЛ с первых часов жизни. При анализе параметров вентиляции отмечено, что в данной группе давление на выдохе в среднем было 3,7 ±0,3 см вод. ст., на входе 21,4 ± 2,2 см вод. ст., с потребностью в кислороде равном или менее 40% у всех исследуемых детей.
Сроки проведения аппаратной ИВЛ в данной группе в среднем составила 2,6 ± 1,0 дней, с последующей ранней экстубацией и переводом на неинвазивные методы респираторной терапии. Сроки назального СРАР (NСРАР) в данной группе была в среднем 0,5 ±0,7 дней, что по сравнению с вышеперечисленными группами было меньше, почти в 2 раза, длительность получения кислорода через маску сохранялась в среднем 2,0±1,2 дня (табл. 2).
Таблица 2. Сроки и параметры оксигенотерапии (Ме (25-75 перцентили))
Примечание: здесь и далее *р - различия между группами выявлялись при помощи критерия Манна-Уитни.
В ряде случаев у недоношенных детей при проведении респираторной терапии отмечалось осложнение в виде синдром утечки воздуха: пневмоторакс – у 5 детей, в том числе у 1 ребенка пневмоторакс в сочетании с пневмомедиастинумом, чаще данный вид осложнений был в 1-й группе (3 ребенка) с клиникой РДСН. Состояние детей после рождения было тяжелое, дети находились в отделении реанимации, проводилась интенсивная терапия и комплекс лабораторных и инструментальных исследований. На рентгенограммах органов грудной клетки у детей с клиникой РДСН чаще всего была снижена пневматизация легочных полей, обогащение легочного рисунка, «воздушная бронхограмма». Новорожденные 2-й группы исследования имели клинику тяжелой неонатальной пневмонии, чаще с внутриутробным периодом инфицирования, что на рентгенограммах отражалось наличием 2-х сторонней бронхопневмонии, усиление легочного рисунка, наличием инфильтративных теней.
Рентгенологическая картина ТТН проявлялась усилением сосудистого рисунка и признаками гипераэрации легких. Контроль гемодинамике у новорожденных детей осуществлялся при проведении динамической ЭхоКГ с допплерографией. В группе детей с РДСН отмечено умеренное повышение давления в легочной артерии по Kitabatake, средние показатели составляли 28,8 ± 9,1 мм.вод. ст., в группе детей с неонатальной пневмонией данный показатель статистически не отличался от предыдущей группы и составил 28,7 ± 10,7 мм.вод. ст. В то время, как в 3-й группе показатель давления повышался до 31,7 ±11,1 мм рт. ст., однако, статистической разницы не отмечено.
В группах новорожденных детей изменения со стороны сердечно-сосудистой системы представлены персистенцией фетальных коммуникаций. Функционирующее открытое овальное окно (ФОО) отмечалось у детей 1-й группы в 65,3%, во 2-й группе в 73,5% и 3-й группе детей 77,7%, открытый артериальный проток (ОАП) чаще был в группах недоношенных детей, с частотой 26,9% и 20,7% соответственно. В дальнейшем у всех детей артериальный проток в динамике спонтанно закрылся. Очевидно, наличие этих изменений связано с сохраняющейся транзиторной легочной гипертензией, вследствие развития дыхательных нарушениях у новорожденных. Дети с клиникой РДСН довольно часто, в 26,9% случаях имели проявления транзиторной дисфункцию миокарда, в виде снижения сократительной способности миокарда, диастолической дисфункции обеих желудочков, что требовало назначения кардиометаболической терапии данной категории детей.
Анализируя ЭГК у новорожденных, чаще всего изменения в группах недоношенных детей, в виде нарушения реполяризации, метаболические нарушения (гипокальцемия и в 53,8% и 41,5% случаях соответственно), единичные случаи нарушения ритма (синусовая тахикардия) во 2–й группе у 2 детей. У всех новорожденных детей течение дыхательной недостаточности сочеталась с перинатальным поражением центральной нервной системы (ЦНС): гипоксически-ишемического, гипоксически- геморрагического, токсико-метаболического и/или инфекционного генеза. В раннем неонатальном периоде у детей 1 и 2 групп наблюдалось преимущественно гипоксически-геморрагическое поражение ЦНС (в форме внутрижелудочкового кровоизлияния (ВЖК) 1–3-й ст., с развитием перивентрикулярного отека на ++ или +++), которое встречалось в 30,7% и 50,9% случаев соответственно.
В 3 группе новорожденных в 66,6% встречался гипоксически-ишемический вариант перинатального поражения ЦНС, частота ВЖК в этой группе составляла 11,1%. В раннем неонатальном периоде поражение ЦНС проявлялось синдромом угнетения, судорожным синдромом и синдромом вегето-висцеральных дисфункций. В последующем в группах недоношенных детей сформировалась перивентрикулярная лейкомаляция (ПВЛ) с частотой 46% в группе детей с РДСН и в 16,9% детей с неонатальными пневмониями. Из сопутствующих заболеваний чаще всего встречались коньюгационная гипербилирубинемия и анемия. Все дети получали инфузионную, антибактериальную, гемостатическую терапию. Основная часть исследуемых детей (около 70%) в раннем неонатальном периоде нуждалась в назначении обезболивающей, седативной и кардиотонической терапии. В связи с морфофункциональной незрелостью и дефицитом сурфактанта в легких недоношенным детям 1 и 2 групп с заместительной целью после рождения был введен экзогенный сурфактант «Куросурф» эндотрахеально. Терапию получили 32 (69,5%) недоношенных детей 1-й группы и 20 (60,6%) новорожденным 2-й группы исследования. В тоже время, как дети 3- ей группы данный препарат не получали. Статистической разницы по введению «Куросурфа» между 1 и 2 группами недоношенных детей не отмечено.
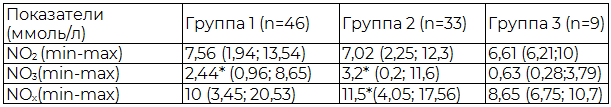
Для изучения показателей метаболитов оксида азота в организме и, в частности, в бронхолегочной системе детей, подверженных респираторной терапией, определяли нитраты и нитриты в КВВ (табл. 3).
Таблица 3. Содержание метаболитов оксида азота в КВВ у новорожденных детей (Ме, 25-75 перцентили)
По этическим причинам не представлялось возможным собрать КВВ у здоровых новорожденных детей, в работе Н.Н. Третьяковой (2010) имеются данные показателей метаболитов оксида азоту 17 здоровых детей 4-6 лет.
Согласно данным у детей старшего возраста уровень нитритов в КВВ составляет 0,54 ммоль/л (0, 42; 1,55), нитратов 2,69 ммоль/л (1,96 – 4,94) суммарное значение 3,42 ммоль/л (2,49 – 5,58). В нашем исследовании мы отметили, что содержание метаболитов оксида азота в КВВ как у доношенных, так и у недоношенных новорожденных было значительно выше, чем у здоровых детей более старшего возраста. Так уровень NO2 у новорожденных детей находящихся на ИВЛ, по поводу разных причин был в среднем в 13,8 раз выше, чем у здоровых детей без респираторной поддержке. Внутри исследуемых групп статистической разнице между группами новорожденных детей по уровню NO2 не нашли. Показатель нитратов в КВВ у недоношенных детей с РДСН и пневмонией статистически отличался от группы детей с ТТН, в сторону увеличения в среднем в 4,4 раза. Суммарное значение NOx у детей на аппаратной вентиляции так же отличалось в сторону увеличения (за счет нитратов) у детей недоношенных, статистическая разница была отмечена между детьми с пневмонией и ТТН.
Обращает на себя внимание различное соотношение нитритов и нитратов при сравнении детей новорожденных и более старшего возраста. У новорожденных в КВВ преобладает фракция нитритов (соотношение NO2 / NO3 3:1), а у детей 4-6 лет превалируют нитраты (соотношение NO2 / NO3 1:4,9). При расчете отношения внутри исследуемых групп отмечено, что в группах новорожденных детей не зависимо от респираторной патологии преобладают нитриты, при анализе отношения NO2 / NO3 в группах недоношенных детей (1 и 2 группы) данное соотношение составляет 3,0 – 2,1: 1, в то время как в группе доношенных детей (3 группа) показатель представлен 10:1. У недоношенных детей (1 и 2 группы) с различной респираторной патологии: РДСН либо пневмония, статистически значимо преобладали нитраты в КВВ, в сравнении с доношенными детьми с клиникой транзиторного тахипноэ.
Известно, что роль оксида азота в организме заключается в поддержании базального тонуса сосудов, а также в регуляции стрессорных и адаптивных ответов организма. Увеличение продукции NO, как правило, обнаруживается при действии кратковременных и умеренных стрессов. Один из защитных эффектов NO на уровне целого организма связан с его способностью, увеличивать активность антиоксидантных ферментов в клетке. Тот факт, что у детей первых дней жизни отмечались высокие уровни метаболитов оксида азота вне зависимости от характера бронхолегочной патологии, может свидетельствовать о неспецифичности локальной гиперпродукции NO у новорожденных. Известно, что эндогенная продукция NO увеличивается под действием провоспалительных цитокинов (γ-интерферона, фактора некроза опухолей α), а также при системной гипоксемии.
Таким образом, повышенное содержание метаболитов оксида азота в конденсате выдыхаемого воздуха у недоношенных детей, с одной стороны, является защитным механизмом, а с другой, служит маркером воспаления. Известно, что при воспалении происходит активизация индуцибельной NO-синтетазы в клетках эпителия респираторного тракта и эозинофилах, лимфоцитах, нейтрофилах. Кроме активации клеток иммунной системы, сам оксид азота является прооксидантом и токсичен для вирусов, бактерий и паразитов, а также участвует в деструкции собственных клеток. Эти факторы, несомненно, присутствуют у новорожденных с тяжелой дыхательной недостаточностью как инфекционного, так и неинфекционного генеза. Важно отметить, что синтез больших количеств NO и других активных соединений азота, обеспечивающих цитотоксические и бактериостатические свойства макрофагов, способствует ограничению распространения инфекции в легких. Теоретически повышение метаболитов NO на уровне аэрогематического барьера в начальных стадиях РДСН можно рассматривать как компенсаторную функцию системы легочной микроциркуляции на фоне легочной вазоконстрикции, направленную на восстановление кровотока.
Выводы
1. Во всех исследуемых группах высокая частота экстрагенитальной и гинекологической патологии женщин. Осложненное течение беременности, с развитием гестоза среднетяжелой или декомпенсированной формы и хронической внутриутробной гипоксии чаще встречались у беременных, гестационный возраст детей которых не превышал 32 недели.
2. Тяжелая асфиксии в родах, дыхательная недостаточность с продленной ИВЛ была в группах недоношенных детей.
3. Изменения со стороны сердечно – сосудистой системы, в виде транзиторной дисфункции миокарда статистически значимо отмечались у детей с РДСН.
4. Тяжесть состояния недоношенных детей усугублялась наличием патологии центральной нервной системы преимущественно гипоксически-геморрагическое поражение (ВЖК), с последующим достоверным формирование ПВЛ в группе детей с РДСН.
4. У доношенных и у недоношенных новорожденных с легочной патологией в респираторном тракте отмечается повышенная продукция метаболитов NO, преимущественно за счет фракции нитритов, в сравнении со здоровыми детьми более старшего возраста.
