Актуальность. Среди приобретенных заболеваний почек у детей нефротический синдром представляет одну из наиболее сложных диагностических и терапевтических проблем в связи с тем, что к этой форме относится наибольшее число рецидивирующего течения болезни. Нефротический синдром у детей – это результат различных состояний, среди которых чаще всего встречается нефротический синдром с минимальными изменениями. В большинстве случаев нефротического синдрома у детей в биоптате почки определяются минимальные изменения и поэтому более 90% детей хорошо реагируют на терапию стероидами. Не отвечающие на стероидную терапию дети относятся к группе со смешанной гистологической картиной, которая часто состоит из болезни минимальных изменений (БМИ), мезангиальнопролиферативного гломерулонефрита (МПГН) и фокальносегментарного гломерулосклероза (ФСГС) [20]. Существуют множество исследований, посвященных гистопатологическому спектру нефротического синдрома. По данным Loreto Gesualdo у детей младше 15 лет среди первичных гломерулонефритов основной патологией была Болезнь минимальных изменений (БМИ), которая встречалась в 23,3% случаях, а доля Фокально Сегментарного Гломерулосклероза (ФСГС) составила 16,9% [16]. В Испании среди причин нефротического синдрома мезангиально пролиферативный нефрит составил (МПГН) 66,7%, БМИ встречалась в 34,5% случаях, а ФСГ - у 16,9% больных с нефротическим синдромом [21]. Но по результатам других исследований, при биопсии было обнаружено, что БМИ диагностировалась в 60-85% случаях. Вместе с тем, последнее время литературные данные отражают рост случаев ФСГС у детей. Учитывая развитие стероидной резистентности при ФСГС у детей с нефротическим сидромом многие авторы в своих исследованиях отражают недостаточную эффективность стероидной терапии, что приводило к развитию признаков почечной недостаточности [10].
Известно, что большинство пациентов с нефротическим синдромом, в основе которого лежит БМИ, хорошо реагируют (до 98% пациентов) на терапию преднизолоном длительностью 4-6 недель [21]. На практике сложилось известное положение об эффективности стероидной терапии при нефротическом синдроме, т.е. подразумевали БМИ при наличии отчетливого положительного ответа на первоначальное лечение детей преднизолоном в течение 4-6 недель. При этом нефробиопсию рекомендовали только тем детям, у которых отмечалась стероидная резистентность. Сообщения из многих стран об увеличении частоты случаев ФСГС привело к пересмотру имеющихся показаний к нефробиопсии при нефротическом синдроме у детей. Поэтому развитие возможных клинических признаков ФСГС (гипертензия, гематурия, тяжелая протеинурия и почечная недостаточность) для детских нефрологов является основанием для проведения нефробиопсии [4, 8, 10].
Включение кортикостероидов в комплексную терапию изменило степень летальности при нефротическом синдроме у детей в сторону уменьшения [2]. Глюкокортикоиды применяются в лечении почти всех морфологических вариантов нефротического синдрома у детей [13]. Только у 10% детей с нефротическим синдромом развивается резистентность к стероидной терапии, которая в 50% случаях приводит к развитию хронической почечной недостаточности [11].
При исследовании Masahiro Hiraoka et al более 80% детей при дебюте нефротического синдрома хорошо реагировали на стероидную терапию, проведенной по схеме ISKDC [17].
Соболева М.К отмечала хороший ответ к стероидам у 82% пациентов, а стероидную зависимость - у 14%, а стероидную резистентность у – 4% [1].
Sajid Bhatti et al при исследовании 200 пациентов обнаружили чувствительность к стероидам в 70% случаев, стероидную резистентность - в 15% [22]. Хотя преднизолон считается основным препаратом для лечения нефротического синдрома, среди нефрологов мира до сих пор нет согласия по выбору адекватного режима стероидной терапии для больных с нефротическим синдромом. Резистентные к стероидам дети составляет самую сложную для нефрологов группу больных [14]. А у 80% резистентных к стероидам больных отмечались только частичные ремиссии или вообще не было рецидивов [5]. Наличие множества исследований по лечению резистентного стероидам нефротического синдрома у детей указывает на продолжение дискуссий по разработке стандартного протокола лечения этого состояния [6, 7, 9, 15, 18, 19, 27].
Целью данного исследования явилась оценка эффективность пульс терапии метилпреднизолоном и циклофосфамидом с дальнейшим приемом преднизолона внутрь при лечении стероидно резистентной формы нефротического синдрома на основании оценки полученных данных при нефробиопсии у детей.
Материалы и методы исследования. Исследование проведено в отделении детской нефрологии клиники ТашПМИ в 2005 – 2011 гг. Все 248 детей, поступившие в клинику с дебютом нефротического синдрома получили преднизолон внутрь в дозе 60мг/м2/поверхность тела/ в сутки в каждый день в течение 6 недель с последующим приемом по 40 мг через день в течение 6 недель. Резистентность стероидам подтвердили при сохранении клинико-лабораторных показателей нефротического синдрома после 6 недель ежедневного приема преднизолона [27]. 34 ребенка со стероидно резистентным нефротическим синдромом были включены в основную группу исследования. Дети с резистентным стероидам нефротическим синдромом, но с клинико- лабораторными признаками вторичного гломерулонефрита не были включены в исследование. В основной группе девочек было 21 (61.8%), мальчиков 13 - (38.2%). Соотношение по полу составило 1,6:1. Средний возраст детей составил 4,34 лет. Результаты лечения детей основной группы сравнивали с результатами лечения контрольной группы. Контрольную группу составили 35 детей с резистентным стероидам нефротическим синдромом.
Нефробиопсия производилась детям под общей анестезией, перкутанным способом под контролем ультразвукового сканера. Ультразвуковой контроль осуществляли аппаратом ультразвука «HITACHI EUB-405» с использованием линейного датчика 3.5 MHz. Биопсийную иглу 14G (производство “Baxter”, США) направляли к паренхиме почки с помощью встроенной в ультразвуковом аппарате проводниковой программы для игл. Полученные биоптаты после фиксации и препарирования были осмотрены под световым микроскопом (изготовление препаратов и микроскопия производилась в Республиканском патологоанатомическом центре). Всем детям основной и контрольной группы проведена нефробиопсия. Микроскопия биоптатов позволяла нам определить следующие морфологические варианты нефротического синдрома: БМИ, ФСГС и МПГН. Нефротический синдром диагностировали при наличии генерализованного отёка, альбумина сыворотки <25г/л, холестерина сыворотки >5,7 ммоль/л и протеинурии более 3+. Критериями ремиссии являлось отсутствие белка в моче или 1+ по методу «dipstick» в сочетании другими клинико-лабораторными симптомами улучшения. Пульс терапию метилпреднизолоном в дозе 30 мг/кг/в сутки проводили ежедневно в течение 5 дней. Дети основной группы принимали преднизолон внутрь в дозе 1мг/кг через день в течение одного года.
Пульс-терапию циклофосфамидом проводили в дозе 750 мг/м2 на поверхность тела. Эту же дозу циклофосфамида вводили ежемесячно в течение одного года.
У детей обеих групп проводили наблюдение с целью контроля белка в моче, артериального давления, анализов крови, функции почек и наличие инфекций, также регистрировали время начала и длительность ремиссии. У всех детей креатинин, альбумин и холестерин сыворотки, скорость клубочковой фильтрации определяли в начале и в конце первого, второго и третьего года наблюдения. В течение 3 летнего наблюдения в основной группе другие иммуносупрессоры (хлорамбуцил, азатиоприн, циклоспорин А или микофенолат) кроме циклофосфамида не применяли. Дети контрольной группы в первом месяце лечения получили метилпреднизолон, 30 мг/кг в сутки ежедневно в течение 5 дней, преднизолон внутрь применяли 1 мг/кг в сутки ежедневно в течение 4 недель, с последующим снижением дозы в течение 8 недель и отменой приема. В контрольной группе для цитостатической терапии был применен хлорамбуцил и азатиоприн.
Результаты и обсуждение. У детей основной группы во время лечения циклофосфамидом свойственные данному препарату побочные эффекты как лейкопения, гипертензия и геморрагический цистит не отмечалось ни у одного пациента. Но отмечали 11 случаев инфекций после проведенной цитостатической терапии циклофосфамидом. У 3 из них были серьезные инфекции: 1 септицемия и 2 пневмонии. Другие случаи инфекционных заболеваний включали в себя инфекции верхних дыхательных путей и инфекции кожных покровов. Почти у всех больных после введение циклофосфамида отмечалась тошнота и рвота, которая была устранена введением метоклопрамида в возрастных дозировках.
В контрольной группе частота побочных эффектов цитостатической терапии было выше по сравнению с основной группой исследования. Лейкопению как осложнение терапии хлорамбуцилом обнаружили у 11 детей (31,4%). Инфекционных осложнений наблюдали у 18 (51.4%) но частота осложнений стероидной терапии (48%) было достоверно выше у детей группы исследования (17%).
Результаты проведенных биопсий у детей основной группы показали следующее: БМИ определили у 12 детей (35,3%), МПГН у 12 (35,3%) и ФСГС - у 10 детей (29,4%). В контрольной группе БМИ определили у 14 детей (40%), МПГН у - 10 (28.6%) и ФСГС - у 11 детей (31,4%). Результаты нефробиопсий показывают, что частота гистологических вариантов при резистентном к стероидам нефротическом синдроме не отличаются в основной и контрольной группах исследования.
Количество больных основной группы достигших ремиссии к концу 1 года лечения составляло 15 (44%) (9 больных с БМИ, и 6 с МПГН). У этих детей до конца третьего года наблюдения рецидивов нефротического синдрома не наблюдалось. К концу второго года в основной группе один больной с ФСГС достиг ремиссии, но этому ребенку было рекомендовано прием преднизолона в дозе 0,5 мг/кг через день во втором и третьем году для поддержания ремиссии. К концу третьего года в основной группе 16 больных (47%) находились в состоянии полной ремиссии.
Частота ремиссии среди больных контрольной группы была значительно ниже в сравнении с основной группой. В контрольной группе к концу первого года лечения ремиссию достигли только 8 (22,8%) больных (7 больных с БМИ, и 1 с МПГН). Во втором году 2 больных с МПГН достигли ремиссии к концу третьего года 10 больных (28.6%) и находились в состоянии полной ремиссии.
Состояние ремиссии в группе исследования и контроля к концу третьего года в периоде 3х летного наблюдения показано в табл. 1 и 2.
Таблица 1. Результаты лечения к концу 3-года в соответствии гистологической картиной почки в основной группе исследования
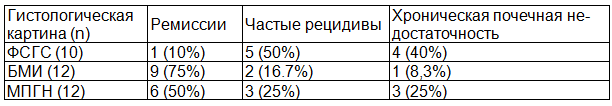
Таблица 2. Результаты лечения к концу 3-года в соответствии гистологической картины почки в контрольной группе исследования
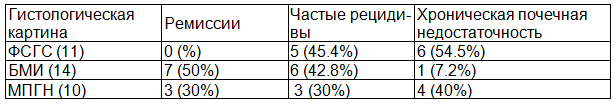
Результаты лечения резистентного стероидам нефротического синдрома в контрольной группе короткими курсами преднизолона и пероральных цитостатиков показывает неэффективность их при лечении гистологических вариантов как МПГН и ФСГС.
Все дети основной и контрольной группы исследования во втором и третьем году наблюдения принимали ингибитор АПФ - эналаприл из-за его антипротеинурического эффекта.
По данным ISKDC у 80% детей с нефротическим синдромом дебют заболевания отмечался в возрасте 6 лет, а ФСГС в 8 лет [12]. Однако в нашем исследовании средний возраст детей с ФСГС составил 4,34 лет. Полученный нами результат совпадает с данными литературы о росте ФСГС у детей младшего возраста.
В нашем исследовании при резистентном стероидам нефротическом синдроме гистологические варианты как БМИ и МПГН встречались с одинаковой частотой (35,3%). В нашем исследовании случаи ФСГС было больше (29,4%) по сравнению с результатами других исследований. Случаи гипертензии (23,5%), гематурии (20,6%) и почечной недостаточности (11,8%) в нашем исследовании встречались также чаще, чем описано в литературе [26]. Случаи гипертензии, гематурии и почечной недостаточности были выявлены во время дебюта нефротического синдрома.
По данным результатов исследования проведенная Bajpai et al. частота ремиссии после проведенного лечения с циклофосфамидом и преднизолоном при БМИ было меньше чем у группы детей с ФСГС, а в нашем исследовании частота ремиссии превалирует у детей с БМИ [3].
Полученные результаты позволяет нам судить, что правильно выбранная стероидная и цитостатическая терапия для лечения резистентного стероидам нефротического синдрома у детей имеет большое значение на дальнейшее течение заболевания. Преимуществами приема преднизолона длительно через день, являются меньшая частота рецидивов, торможение развития ФСГС и почечной недостаточности. Назначение короткого курса преднизолона при резистентной стероидам нефротического синдрома имеет недостатки, такие как большая частота рецидивов, высокий риск развития ФСГ и почечной недостаточности.
Таким образом, из полученных результатов можно сделать следующие выводы:
1) Мы отмечали более высокую частоту развития резистентной стероидам нефротического синдрома (27,8%).
2) Применение пульс-терапии с метилпреднизолоном и циклофосфамидом имеет положительный эффект у 47% больных с резистентной стероидам нефротическом синдромом.
3) Терапия резистентной стероидам нефротического синдрома с внутривенным введением метилпреднизолона и последующим пероральным приемом преднизолона в течение 1 года с ежемесячным однократным внутривенным введением циклофосфамида в течении 1 года показала высокую эффективность при гистологических вариантах как БМИ и МПГН.
4) Учитывая малую эффективность стероидной и цитостатической терапии при лечении ФСГС, для лечения данного состояния нужно рассматривать другие активные методы терапии.
