Хроническая болезнь почек (ХБП) имеет широкое распространение среди населения различных стран. В соответствии с данными эпидемиологических исследований признаки повреждения почек или умеренное/выраженное снижение скорости клубочковой фильтрации выявляются у каждого десятого в общей популяции. В течение последнего десятилетия заболеваемость ХБП возросла на 30% [17, 21].
По данным исследований NHANES II и III распространенность ХБП среди взрослого населения США достигает около 13%, причем большинство пациентов относятся к первым трем стадиям ХБП [21]. По данным ряда российских исследований распространенность ранних стадий ХБП достигает 36% среди лиц старше 60 лет [3]. Такой рост распространенности поражений почек обусловлен вовлечением их в патологический процесс при широком спектре заболеваний внутренних органов (гипертоническая болезнь, сахарный диабет и т.д.) [10, 12].
В настоящее время нарушение функции почек расценивается как фактор ускоренного развития патологии сердечно-сосудистой системы. У пациентов с ХБП кардиальный риск повышается в 20 раз по сравнению с основной популяцией. Известно, что в патогенезе сердечно-сосудистых осложнений при дисфункции почек большое значение имеет нарушение функции эндотелия [6,9,19]. Среди механизмов прогрессирования гломерулярных поражений почек также большое значение придают нарушению функции эндотелия [9]. В соответствии с современными представлениями, эндотелиальная дисфункция (ЭД) – это нарушение продукции эндотелиальных факторов, при котором эндотелий не в состоянии обеспечить гемореологический баланс крови, что приводит к нарушению функций органов и систем [4]. Роль ЭД в формировании и прогрессировании ХБП представляется закономерной, но изучена еще недостаточно. Нарушение функционального состояния эндотелия как локально в почке, так и в системном русле выявляется уже на ранних стадиях ХБП, что способствует развитию дезадаптивного ремоделирования сердца и сосудов, быстрому прогрессированию атеросклероза [10,22]. Усугублению ЭД при патологии почек способствует целый ряд факторов: накопление уремических токсинов, оксидативный стресс, дислипидемия и т.д. Дисфункция эндотелия вызывает вазоконстрикцию, гиперкоагуляцию, что ведет к нарушению микрореологии крови, капиллярно-трофической недостаточности, ишемии почечной ткани, развитию фиброза в клубочках и тубулоинтерстиции [13].
Также доказана роль оксидативного стресса в развитии ЭД и ХБП [15]. Существует мнение о существовании оксидативного стресса и несостоятельности антиоксидантной защиты в условиях уремии [2]. При снижении эффективности антиоксидантной защиты организма повышается способность свободных радикалов инактивировать NO путем образования пероксинитрита – высокотоксичного вещества, являющегося вазоконстриктором [19]. В последние годы особое внимание уделяется роли процессов свободнорадикального окисления в повреждении эритроцитов и прогрессировании анемии при ХПН. Таким образом, эндотелиальная дисфункция и оксидативный стресс рассматриваются как ведущие факторы прогрессирования ХБП.
Нарушение реологических свойств крови способствует компенсаторному усилению напряжения сдвига в остаточных функционирующих нефронах с развитием внутриклубочковой гипертензии и гиперфильтрации, что способствует дальнейшему прогрессированию ХБП [4, 5, 16].
Вклад эффектов сосудистого эндотелия и реологических нарушений в прогрессирование ХБП в клинических условиях оценен недостаточно, в связи с чем уточнение роли этих механизмов на разных стадиях течения ХБП важно как с научных позиций, так и в практическом отношении для определения новых путей торможения прогрессирования ХБП.
Цель исследования – представить характеристику функции эндотелия, реологических свойств крови и свободнорадикальных процессов у больных с ХБП.
Материалы и методы. Обследовано 97 человек с ХБП, проходивших обследование и лечение в нефрологическом отделении ОБУЗ ИвОКБ г. Иваново. Среди пациентов преобладали женщины (65 человек). Средний возраст обследованных составил 50,4±3,1 лет. Критерии включения в исследование: ХБП I-V стадий у пациентов хроническими воспалительными заболеваниями почек (хроническим пиелонефритом, хроническим тубулоинтерстициальным нефритом) при отсутствии клинико-лабораторных признаков обострения заболевания в течение последних 6 месяцев, пациенты ХБП 5 стадии, получающие заместительную почечную терапию программным гемодиализом (ПГД). Диагноз был верифицирован на основании осмотра больных, результатов лабораторных и инструментальных методов исследования. Стадию ХБП устанавливали в соответствии с рекомендациями Национального Почечного Фонда США [23]. Скорость клубочковой фильтрации рассчитывали по формуле MDRD [17]. Критерии невключения: гипертоническая болезнь, сахарный диабет, застойная сердечная недостаточность, ишемическая болезнь почек, острые воспалительные заболевания, хронические заболевания легких и органов желудочно-кишечного тракта в стадии обострения, диффузные заболевания соединительной ткани, злокачественные новообразования.
По стадиям ХБП пациенты распределились следующим образом: ХБП 1-2 ст. - 20 человек (средний возраст 51,6±4,1 лет), ХБП 3 ст. – 20 человек (средний возраст 58,4±1,9 лет), ХБП 4 ст.- 17 человек (средний возраст 48,5±3,1 лет), ХБП 5 ст. до начала ПГД - 20 человек (средний возраст 47,6±3,4 лет), лица с ХБП 5 ст. при проведении ПГД - 20 человек (средний возраст 45,8±3,1 лет). Среди обследованных пациентов 90% имели артериальную гипертензию различной степени, 10% пациентов были нормотензивными.
Кроме общеклинического обследования всем больным определяли показатели функции эндотелия, перекисного окисления липидов (ПОЛ), антиоксидантной активности и реологии крови. Исследования выполнялись в утренние часы, натощак, с исключением курения, употребления крепкого чая, кофе, чрезмерных физических нагрузок, приема всех лекарственных препаратов [7]. Для оценки эндогенной продукции оксида азота в плазме крови пациентов определялись суммарная концентрации нитрит- и нитрат-ионов (NOx) и L-цитруллина (LC). Для определения NOx плазма крови депротеинизировалась с помощью этанола, нитраты восстанавливались до нитритов в реакции с хлоридом ванадия. Содержание нитритов в плазме крови оценивалось по методике Грисса спектрофотометрически при длине волны 540 нм [7]. Для определения концентрации LC в плазме крови был использован метод, основанный на реакции остатков LC с диацетилмоноксимом в присутствии разбавленной серной кислоты и хлористого железа. Оптическая плотность полученного окрашенного комплекса измерялась на спектрофотометре при длине волны 464 нм [11].
Подсчет десквамированных эндотелиоцитов (ДЭ) крови проводился по методу J. Hladovec [20].
Регистрацию вязкостных характеристик цельной крови, плазмы проводили на ротационном вискозиметре «конус-конус» АКР-2 [1]. Вязкость крови определялась при разных скоростях сдвига, что соответствует нелинейному поведению крови в артериальном русле (200с-1) и в венозном отделе (от 10с-1), вязкость плазмы исследовалась на скорости сдвига 100с-1 [1]. Гематокрит и гемоглобин определяли общепринятыми методами. Процесс сборки линейных агрегатов оценивали с помощью автоматического агрегометра эритроцитов МА1, разработанного на основе метода H. Schmid-Schonbein [24]. Определялась степень агрегации автоматически для двух интервалов времени – 5 сек и 10 сек (М5 и М10). Для оценки процесса агрегации во времени рассчитывали временной параметр, который равен отношению степеней агрегации в разных временных интервалах: RT0=М10/М5. Медленный процесс агрегации эритроцитов, связанный с формированием крупных многомерных образований, оценивали прямым оптическим методом в камере Горяева с вычислением показателя агрегации (ПА), среднего размера агрегата (СРА) и процента неагрегированных эритроцитов (ПНА) [25]. Архитектонику эритроцитов изучали методом фазово-контрастной микроскопии. Клетки идентифицировали по классификации Г.И. Козинца [5]. Соотношения патологических и нормальных форм эритроцитов рассчитывали по индексу трансформации (ИТ), индексу обратимой трансформации (ИОТ), индексу необратимой трансформации (ИНОТ) [5].
Интенсивность ПОЛ и антиоксидантную активность (АОА) плазмы оценивали с помощью биохемилюминесцентного анализа на приборе БХЛ-07 [18]. Использовали следующие параметры: S – площадь под кривой интенсивности индуцированного ПОЛ, или общая мощность ПОЛ, мВ*с; tg2 – тангенс угла максимального наклона кривой фотолюминесценции к оси времени, характеризующий АОА [18]. Концентрация малонового диальдегида (МДА) в плазме крови определялась с помощью реакции с тиобарбитуровой кислотой фотоколориметрическим методом [14].
Группу контроля составили практически здоровые лица (n=30), сопоставимые по полу и возрасту с пациентами исследуемой группы.
Статистическая обработка полученных результатов проводилась в пакете прикладных программ «Statistica – v.6.0 for Windows» с использованием описательной статистики, t-критерия Стьюдента, корреляционного анализа.
Полученные результаты и их обсуждение. В результате проведенного исследования было установлено, что изменения показателей, отражающих функцию эндотелия, имеют разнонаправленный характер в зависимости от стадии ХБП. Значительное уменьшение концентрации NOx и LC плазмы было выявлено у пациентов с ХБП 1-3 ст. по сравнению с контролем (Табл.1), что свидетельствует о снижении продукции NO и наличии выраженной ЭД. Её развитие усиливает агрегацию и адгезию форменных элементов, снижает антикоагулянтную активность эндотелия, увеличивает вязкость крови [13]. По мере прогрессирования ХБП концентрации NOx и LC, а также количество ДЭ в плазме больных значимо возрастали, достигая максимума у больных с ХБП 5 стадии. В данной ситуации гиперпродукцию NOx и LC следует расценивать как декомпенсацию системы NO-эндотелий [8]. На фоне лечения ПГД концентрации NOx и LC плазмы у пациентов значительно снижались и приближались к нормальным значениям (табл.1), что отражает стабилизацию системы NO-эндотелий. На нестойкость стадии компенсации данной системы при проведении ПГД указывает количество ДЭ. Так, из табл. 1 видно, что число ДЭ у больных на фоне лечения ПГД не достигает снижения, сопоставимого с контрольной группой.
Таблица 1. Показатели эндотелиальной функции у пациентов в зависимости от стадии ХБП (M±m)
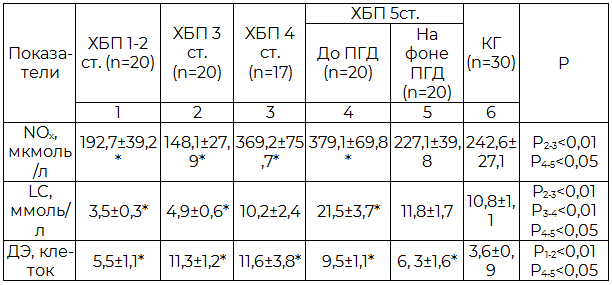
Примечание: здесь и далее * – различия с группой контроля достоверны (P<0,05), NOx – суммарная концентрация нитрит- и нитрат-ионов в плазме крови, LC – концентрация цитруллина в плазме крови, ДЭ – количество десквамированных эндотелиоцитов в плазме крови, КГ – контрольная группа, ПГД – программный гемодиализ.
Для больных ХБП характерно отклонение от нормы основных показателей реологического состояния крови. Установлено прогрессивное снижение уровня гемоглобина и гематокрита у пациентов ХБП, начиная с 4 ст., что связано с угнетением эритропоэза и развитием анемии по мере прогрессирования почечной недостаточности. У больных с ХБП 1-3 ст. наблюдалось умеренное повышение вязкости цельной крови при высоких и низких скоростях по сравнению с контролем, однако, начиная с 4 ст., вязкость цельной крови снижается, что вероятно связано с прогрессированием анемии (табл. 2). При всех стадиях ХБП у больных прослеживалась тенденция к повышению вязкости плазмы. На фоне проведения ПГД нормализации макрореологических параметров крови у пациентов не отмечено (табл. 2).
Таблица 2. Макрореологические показатели крови у пациентов в зависимости от стадии ХБП (M±m)
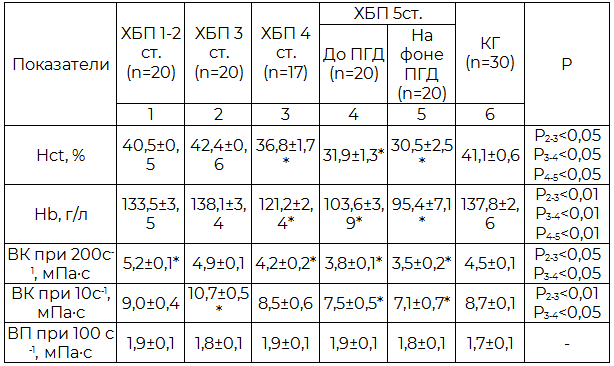
Примечание: Hct – гематокрит, Hb – гемоглобин, ВК - вязкость крови, ВП – вязкость плазмы.
Изменения микрореологических показателей проявлялись усилением агрегации эритроцитов, изменением их формы и свойств. У обследованных пациентов на всех стадиях ХБП наблюдалось достоверное усиление агрегации эритроцитов, что проявилось увеличением степени агрегации (ПА, М5, М10), средних размеров агрегатов (СРА), ускорением сборки линейных агрегатов (RT0) и уменьшением доли неагрегированных эритроцитов (ПНА) по сравнению с контрольной группой (табл. 3). Максимальная выраженность агрегации эритроцитов отмечена при ХБП 1-3 ст. (табл.3). Начиная с 4 ст., преобладала тенденция к снижению интенсивности процессов агрегации у больных, что наиболее четко прослеживалось по динамике изменений показателей автоматической агрегации (М5, М10) (табл.3). Проведение ПГД значимо не повлияло на процессы агрегации эритроцитов у пациентов с ХБП. Кроме того, у 35% больных, находящихся на лечении ПГД, появились патологические глыбчатые агрегаты, имеющие крупные размеры и большую силу сцепления между клетками, что не позволяет им проходить по сосудам микроциркуляторного русла. Это приводит к резкому снижению уровня микроциркуляции [16].
Таблица 3. Микрореологические показатели крови у пациентов в зависимости от стадии ХБП (M±m)
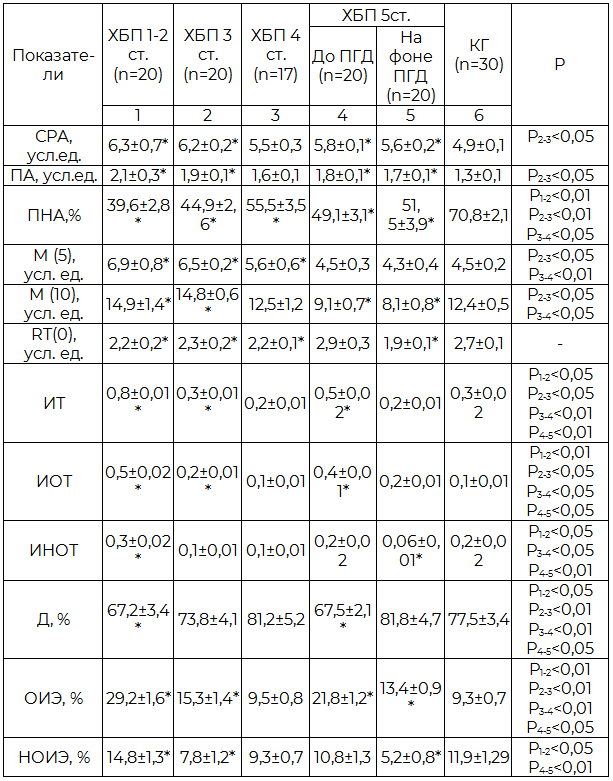
Примечание: ПА – показатель агрегации, ПНА – процент неагрегированных эритроцитов; М(5) – степень агрегации через 5 секунд, М(10) – степень агрегации через 10 секунд, RT(0) – коэффициент, отражающий скорость сборки линейных агрегатов, ИТ – индекс трансформации, ИОТ – индекс обратимой трансформации, ИНОТ – индекс необратимой трансформации, Д – дискоциты, ОИЭ – обратимо измененные эритроциты, НОИЭ – необратимо измененные эритроциты
У пациентов при ХБП 1-3 и 5 стадий обнаружены нарушения цитоархитектоники эритроцитов в виде уменьшения процентного содержания дискоцитов и значительного увеличения количества обратимо трансформированных форм клеток – эхиноцитов (табл.3). Также у пациентов с ХБП 1-2 ст. выявлено повышение процентного содержания необратимо трансформированных эритроцитов. Вышеуказанные отклонения цитоархитектоники эритроцитов подтверждаются изменением таких расчетных показателей, как ИТ, ИОТ, ИНОТ (табл. 3). На фоне лечения ПГД у обследованных наблюдалось снижение процентного содержания обратимо и необратимо измененных форм эритроцитов (p<0,05), нормализация количества дискоцитов (p<0,05).
Таким образом, изменения макрореологических параметров у больных с ХБП проявляются преимущественным повышением вязкости цельной крови на 1-3 ст. и снижением уровня гемоглобина и гематокрита на 4-5 ст., что совпадает с данными других исследователей [5,16]. Также типичными для пациентов с дисфункцией почек являются нарушения микрореологических свойств крови в виде интенсификации агрегатообразования и увеличения числа видоизмененных форм эритроцитов преимущественно на 1-2 ст. ХБП. Вышеуказанные изменения приводят ухудшению микроциркуляции и повышению риска сосудистых осложнений у данной категории больных [2,6].
По данным биохемилюминисцентного метода выявлено двукратное повышение общей мощности ПОЛ у пациентов с ХБП 4-5 ст. по сравнению с контролем (p<0,05). Также отмечено значимое увеличение концентрации МДА в плазме крови больных при 3-5 ст. ХБП (p<0,05) (табл.4). На фоне лечения ПГД общая мощность ПОЛ у пациентов продолжала увеличиваться (p<0,05). Значимое повышение АОА плазмы крови наблюдалось у пациентов с 4-5 ст. ХБП по сравнению с контрольной группой. Максимальная активность антиоксидантной системы зафиксирована у больных, находящихся на лечении ПГД (табл.4).
Все вышесказанное свидетельствует о выраженной активации процессов ПОЛ у больных ХБП 3-5 стадии с компенсаторным усилением антиоксидантной защиты, что совпадает с данными других исследователей [15,19]. На фоне лечения ПГД снижения интенсивности свободнорадикальных процессов у пациентов не происходит, однако сохраняется высокая антиоксидантная активность.
Нами были установлены корреляционные связи между: общей мощностью ПОЛ и концентрацией NOx (r=+0,73, p<0,05), общей мощностью ПОЛ и количеством ДЭ (r=+0,67, p<0,05), концентрацией МДА плазмы и средним размером агрегата (r=+0,55, p<0,05), показателем степени агрегации М5 и концентрацией NOx (r=-0,59, p<0,05). Таким образом, наличие достоверных взаимосвязей между показателями эндотелиальной функции, свободнорадикальных процессов и реологического состояния крови свидетельствуют об их взаимоусугубляющем действии.
Таблица 4. Состояние ПОЛ и АОА у пациентов в зависимости от стадии ХБП (M±m)
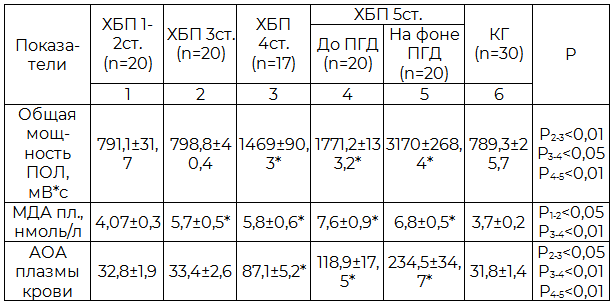
Примечание: ПОЛ - перекисное окисление липидов, МДА пл. – концентрация малонового диальдегида плазмы крови, АОА – антиоксидантная активность плазмы крови.
Выводы
1. Для больных с ХБП характерна дисфункция эндотелия, которая прогрессирует по мере увеличения стадии ХБП. Признаки декомпенсации системы NO-эндотелий наблюдаются у пациентов с 4-5 стадиями ХБП.
2. У больных с ХБП выявлены нарушения макро- и микрореологических свойств крови в виде повышения вязкости цельной крови, снижения уровня гемоглобина и гематокрита, усиления агрегационной способности эритроцитов, уменьшения числа дискоцитов и увеличения содержания обратимо трансформированных форм эритроцитов. Степень выраженности и характер гемореологических нарушений зависят от стадии ХБП. Максимальные изменения реологических свойств крови выявляются у больных при 1-2 стадиях ХБП.
3. Для больных с ХБП 3-5 стадии характерно значительное усиление интенсивности перекисного окисления липидов и антиоксидантной активности, что является проявлением оксидативного стресса.
4. Проведение ПГД способствует стабилизации системы NO-эндотелий и улучшению цитоархитектоники эритроцитов. Таким образом, ПГД следует отнести к методам коррекции эндотелиальной дисфункции и гемореологических нарушений у больных ХБП.
