Функциональное состояние почек при подагре, как главного органа выведения мочевой кислоты (МК), определяет тяжесть состояния и, в итоге, прогноз заболевания [1]. Механизмы повреждения почек при подагре и методы ее ранней диагностики изучаются. Известно, что длительное отложение кристаллов моноурата натрия в тубулоинтерстициальной ткани (ТИТ) почек приводит к ее воспалению и экспрессии различных хемокинов, цитокинов с дальнейшим развитием атрофии канальцев и фиброза интерстициальной ткани почек [2].
Есть литературные данные о том, что гиперурикемия приводит к изменениям афферетной артериолы, изменениям в структуре строения гладкомышечных клеток почечных артериол и, как следствие этого, может вызывать повышение артериального давления и/или прогрессирование артериальной гипертонии (АГ) [3]. С другой стороны, достаточно частое сочетание подагры с АГ, метаболическим синдромом (МС), инсулинорезистентностью, сахарным диабетом 2 типа может самостоятельно вносить определенный вклад в повреждения клубочкового аппарата почек.
Таким образом, в механизмах повреждения почек при подагре участвует не только ТИТ, но и клубочковый аппарат. Поэтому в диагностике уратной нефропатии важно исследование парциальных функций почек [4].
На сегодняшний день клинически доступные маркеры повреждения почек выявляют ХБП на поздних стадиях, когда окно для первичной профилактики уже закрыто. Поэтому, в последние годы активно изучаются биомаркеры, экскретирующиеся с мочой и позволяющие дифференцировать хроническое повреждение почек на самых ранних стадиях. Большинство этих маркеров представляют собой соединения, экспрессирующиеся в канальцевом аппарате почек и в повышенных количествах выделяющиеся в мочу при условии повреждения данного органа. К ним относятся ИЛ-18, КИМ-1, NGAL,VEGF-А, TGF-ß1, а также ряд ферментов, в норме обычно локализующихся в щеточной кайме проксимальных канальцев [5-8].
Особенно обращает на себя внимание биомаркер VEGF-A. Этот сосудисто-эндотелиальный фактор роста играет важную роль в поддержании стабильности эндотелия и физиологическом неоангиогенезе, а также принимает активное участие в процессах неоваскуляризации в патологических ситуациях. Во многих исследованиях, в том числе и при различных заболеваниях почек, продемонстрирована его ведущая роль в качестве маркера эндотелиальной дисфункции [9]. В нормальных условиях VEGF-А является важным индуктором микрососудистой проницаемости, высвобождение которого находится под строгим контролем. В норме он экспрессируется подоцитами, тубулярными эпителиальными клетками и эндотелиальными клетками почек [10,11].
Не менее актуально и изучение маркера TGF-ß1, так как он зарекомендовал себя в качестве маркера прогрессирования и тяжести ХБП. TGF-ß1 (трансформирующий фактор роста-1), важный фиброгенный цитокин, продуцирующийся в почках в ответ на воздействие ангиотензина-2, IL-1, а также на механическое растяжение мезангиальных и тубулярных клеток. TGF-ß1 стимулирует апоптоз подоцитов, тубулярных, эпителиальных и капиллярных эндотелиальных клеток, а также отложение экстрацеллюлярного матрикса и трансдифференциацию тубулярных клеток в миофибробласты [12].
Одним из информативных показателей функционального состояния почек является оценка почечного резерва, отсутствие которого расценивается как эквивалент имеющейся гиперфильтрации, даже при нормальных показателях скорости клубочковой фильтрации (СКФ) [13]. Внутриклубочковая гипертензия и гиперфильтрация являются ведущими факторами прогрессирования поражения почек.
В настоящее время установлена роль гиперфильтрации не только на поздних стадиях нефропатии, но и у почечных больных без нарушений функции почек вследствие патологической активации гормональных факторов. Таким образом, гиперфильтрация может рассматриваться как показатель прогрессирующего снижения резервов фильтрационной способности почек. Этот механизм считается универсальным для всех нефропатий и почечной недостаточности. К тому же выявлено, что состояние гиперфильтрации сопровождается увеличением нагрузки, как на клубочковый, так и на канальцевый аппарат почек [14].
Для выявления внутриклубочковой гипертензии предлагают использовать метод определения ФПР с белковой (глюкагоновой, допаминовой, аминокислотной) нагрузкой. На нашей кафедре данный метод модифицирован и стандартизирован, получены различные данные по ФПР как у здоровых лиц, так и у пациентов с различными нефропатиями [15,16].
Цель исследования: изучить тубулогломерулярную взаимосвязь у пациентов с подагрой.
Материалы и методы. Обследовано 66 пациентов с установленной первичной подагрой в возрасте от 30 до 77 лет, мужчин 61, женщин 7. Среди них 15 пациентов с ХБП 2-3 стадии по классификации KDIGO. МС выявлен у 41 пациента (61%), сопутствующая АГ была у 49 (72%) пациентов. Преобладала АГ 2 стадии, 3 степени.
Критерием включения являлся достоверный диагноз подагры на основании классификационных критериев, рекомендованных Американской ревматологической ассоциацией [17].
Критерии исключения: наличие первичных и других вторичных заболеваний почек, системных заболеваний соединительной ткани, функциональный класс 2-4 сердечной недостаточности, терминальной стадии ХБП, острое нарушение мозгового кровообращения, заболеваний щитовидной железы, требующих гормональной коррекции, злокачественных новообразований, сахарного диабета, бронхиальной астмы, язвенной болезни желудка в стадии обострения.
Контрольную группу составили 41 здоровый доброволец в возрасте от 17 до 50 лет (26±6,5лет), 21 мужчина, 20 женщин, без факторов риска ХБП, признаков поражения почек, МС, АГ и гиперурикемии.
У всех исследуемых оценивали демографические показатели, проводили физикальное, клинико-лабораторное обследование.
В лабораторное обследование пациентов входило определение креатинина сыворотки, МК, общего холестерина (ХЛ), триглицеридов (ТГ), маркеров раннего повреждения канальцевого аппарата почек в моче (β2-микроглобулинов, VEGF-А как маркера эндотелиального повреждения и TGF-ß1 маркера тубулоинтерстициального фиброза) иммуноферментным методом (ELISA), определение СКФ по формуле CKD-EPI, оценка ФПР в острой пробе с допамином, при этом исследовался уровень креатинина сыворотки и мочи до и после проведения пробы, объем мочи в течение часа до и после проведения пробы, рассчитывалась СКФ. ФПР определяли как разницу между исходной и стимулированной СКФ и расценивали как сохранный при значениях больше или равных 10%, истощенный – менее 10% и при отрицательных значениях.
Статистическая обработка полученных данных проводилась с использованием стандартного пакета программ STATISTICA 6.0 (непараметрические методы).
Результаты и обсуждение. Результаты обследования контрольной группы подтвердили нормальные показатели обмена веществ и функции почек: СКФ составила 103,19 [78,9;127,89] мл/мин/1,73м2, индекс массы тела (ИМТ) -21,48 [19,3;23,67] кг/м2, уровень МК в сыворотке определили как равный 326 [268; 359] мкмоль/л. Показатели липидного обмена и β2-микроглобулинов мочи были в пределах нормальных величин. Значение ФПР в острой пробе с допамином 33,3 [17,66;52,82]%, у всех здоровых почечный резерв определили как сохранный.
В исследуемой группе СКФ составила 87 [68; 101] мл/мин/1,73 м2, ИМТ - 29,5±3,88 кг/м2, уровень МК 452 [363; 509] мкмоль/л; у 51,8% пациентов он был повышен. При оценке липидного обмена выявили повышение общего холестерина до 5,65[4,77;6,49] ммоль/л и ТГ до 2,25[1,43;3,3] ммоль/л. Показатели β2-микроглобулинов мочи были в пределах нормальных величин – 0,05 [0,029; 0,148] мкг/мл.
Оценка ФПР у пациентов с подагрой. Определение ФПР показало, что у 38 (57,6%) больных подагрой резерв был сохранным, у - 28 (42,4%) истощен. При этом у пациентов без признаков ХБП ФПР определили как равный 66,67 [-9,3;121,25]%, а у больных с ХБП 2-3 стадии 1,58 [-39,5; 63,65]%, что достоверно ниже по сравнению с группой контроля, p=0,00039.
Известно, что АГ оказывает влияние на фильтрационную функцию почек. Поэтому для оценки влияния АГ на ФПР пациенты были разделены на две группы: 1А- пациенты с сопутствующей АГ и 1Б - без АГ. Характеристики указанных групп представлены в табл. 1.
Таблица 1. Клинико-лабораторная характеристика пациентов в группах 1А и 1Б
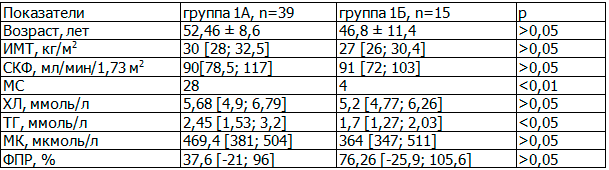
Из представленных в табл. 1 данных следует, что группы недостоверно отличались по уровню ФПР, гиперурикемии. Однако в группе 1А значительно чаще встречались пациенты с МС и был достоверно выше уровень ТГ. Мы предположили, что отсутствие достоверных различий между исследуемыми группами связано с небольшим количеством пациентов.
Далее для оценки факторов влияющих на ФПР пациенты были разделены на 2 группы: 2А - с сохранным и 2Б - с истощенным ФПР. Группы были сопоставимы по возрасту, ИМТ, СКФ и количеству пациентов с МС. Клиническая характеристика двух групп приведена в табл. 2.
Таблица 2. Клинико-лабораторная характеристика пациентов в группах 2А и 2Б
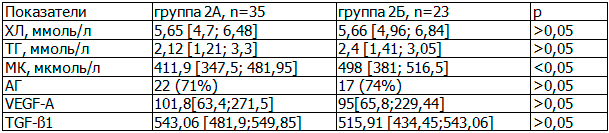
Проведенный корреляционный анализ выявил умеренную обратную связь между ФПР и МК (Sr=-0,345, p=0,018). На основании проведенного нами статистического анализа можно предположить, что АГ, ИМТ, уровни липидов крови не оказывают влияния на ФПР у больных с подагрой, но обнаружено достоверно более высокое значение МК в сыворотке у пациентов с истощенным ФПР.
Уровень VEGF-A в моче у пациентов с подагрой.
Анализ уровня экскреции с мочой VEGF-A показал, что у пациентов с подагрой он был ниже, чем у здоровых добровольцев: 97[64,6; 262,8] vs 168,18[109,8; 222,04] пг/мг, но разница не достигала статистической значимости (р=0,11). В то же время отмечено достоверное снижение уровня VEGF-A среди больных без ХБП по сравнению с пациентами с ХБП 2-3 стадии: 87[61,2;130,76] vs 276,09[113;346,32] пг/мг, р=0,02 (см. рис. 1).
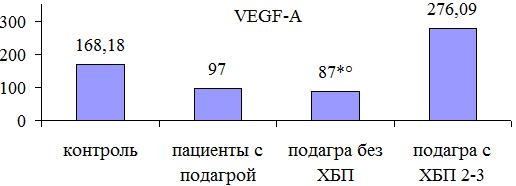
Рис. 1. Значение VEGF-A в моче у пациентов с подагрой и в группе контроля: * р<0,05 по сравнению с группой контроля; º р<0,05 по сравнению с пациентами с подагрой и ХБП 2-3 стадии.
Сравнительный анализ уровня VEGF-A среди пациентов с истощенным и сохранным почечным резервом показал, что данный маркер ниже у пациентов с истощенным ФПР: 95 [65,8;229,44] vs 101,8 [63,4;271,5] пг/мл, (р>0,05).
Установлена сильная прямая корреляция между уровнем VEGF-A и β2 микроглобулинами в моче (Rs = 0,6; p=0,0002).
Таким образом, в группе пациентов с подагрой без признаков ХБП уровень VEGF-A был самым низким, и он достоверно отличался как от группы контроля, так и от пациентов с ХБП 2-3 стадии. Можно предположить, что снижение уровня VEGF-A у пациентов с подагрой без признаков ХБП связано с повреждением тубулярных эпителиальных клеток, которые в условиях гипоксии не способны к его достаточной экспрессии.
Подобные результаты, а именно снижение VEGF-A, были получены при диабетической нефропатии [18] и хроническом гломерулонефрите [19]. В результате экспериментальных и клинических исследований было установлено, что сниженная экспрессия VEGF-A может являться признаком нарушенного ангиогенеза, потери капилляров, развития гломерулосклероза и интерстициального фиброза [19].
Уровень TGF-ß1 в моче у пациентов с подагрой. Уровень экскреции TGF-ß1 с мочой у больных подагрой был достоверно снижен по сравнению с контролем: 529,49 [478,57;546,45] vs 549,85 [526,09; 621,46] пг/мг, р=0,04. Сравнительный анализ уровня TGF-ß1 среди пациентов без ХБП и ХБП 2-3 стадии выявил наибольшее снижение его среди пациентов с ХБП (481,96 [434,45; 522,7] vs 539,67 [488,76; 549,85] пг/мл), но разница не достигла статистической значимости (p>0,05), вероятно, за счет малой выборки пациентов в группе с ХБП (см. рис.2).
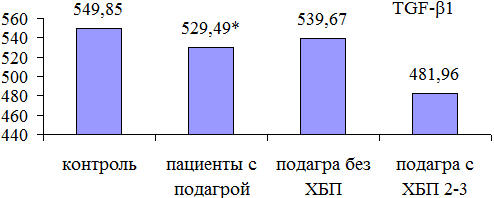
Рис. 2. Значение TGF-ß1 в моче у пациентов с подагрой и в группе контроля: * р<0,05 по сравнению с группой контроля.
Сравнительный анализ уровня TGF-ß1 среди пациентов с истощенным и сохранным почечным резервом показал, что данный маркер ниже у пациентов с истощенным ФПР: 515,91[434,45;543,06] vs 543,06[481,97;549,85] пг/мг, (р>0,05).
Мы предположили, что выявленное наибольшее снижение TGF-ß1 у пациентов с ХБП 2-3 стадии и у пациентов с истощенным ФПР предполагает связь данного маркера с тяжестью почечного повреждения.
Выводы
- У 39% пациентов с подагрой без признаков ХБП выявляется истощенный почечный резерв.
- На уровень ФПР при подагре не влияют АГ, ИМТ, уровни липидов крови, но имеется взаимосвязь с уровнем МК крови.
- У больных с подагрой без признаков ХБП выявлена наиболее значимая эндотелиальная дисфункция.
- TGF-ß1 перспективный маркер тяжести патологического процесса в почках у пациентов с подагрой.
