Геморрагическая лихорадка с почечным синдромом (ГЛПС) - острое вирусное, природно-очаговое заболевание, характеризующееся системным поражением мелких сосудов, геморрагическим диатезом, расстройствами гемодинамики и своеобразным поражением почек (интерстициальный нефрит) с развитием острой почечной недостаточности. Данное заболевание выходит на первое место среди других природно-очаговых заболеваний [8]. Наиболее высока заболеваемость ГЛПС в Китае и России [17]. Почти 90% всех зарегистрированных в РФ случаев заражения ГЛПС приходится на Приволжский Федеральный округ. Относительный показатель заболеваемости в 11 из 15 субъектов округа превышает, в среднем, 10 на 100 тыс. населения. Особенно высокие показатели отмечены в республике Башкортостан (54,7), Удмуртской республике (54,1), Республике Марий Эл (26,4), Оренбургской области (22,8), Республике Татарстан (20,0), Ульяновской области (19,0), Пензенской области (16,4), Республике Мордовия (15,6), Самарской области (12,4), Чувашской Республике (12,1) и Пермской области (10,6) [8]. В Европейской части России возбудителями инфекции являются хантавирус Пуумала, а также два генетических подтипа вируса Добрава - ДОБ-Aa и ДОБ-Ар, вызывающие заболевания ГЛПС, отличающиеся тяжестью клинического течения болезни [7]. Вирус Добрава вызывает наиболее тяжелые случаи ГЛПС, определяющие высокую летальность при данном заболевании - от 5 до 10% [14]. Случаи ГЛПС, вызванные вирусом Пуумала, в большинстве случаев имеют среднетяжелое течение. При типичном течении ГЛПС прослеживаются пять последовательно развивающихся периодов: лихорадочный, гипотензивный, олигурический, полиурический и период реконвалесценции. Лабораторными проявлениями заболевания в острой стадии являются анемия, лейкоцитоз, тромбоцитопения, повышение уровней печеночных ферментов, сывороточного уровня креатинина, а также протеинурия и гематурия [13]. В большинстве случаев отмеченные выше клинико-лабораторные проявления болезни при выздоровлении исчезают полностью. Однако в некоторых тяжелых случаях сохраняются головная боль, бессонница, потливость, геморрагический синдром и полиурия. Острое повреждение почек с развитием острой почечной недостаточности может привести к летальному исходу и встречается обычно в олигурическом периоде [16]. Лихорадочный, гипотензивный и олиурический периоды могут накладываться друг на друга при тяжелом течении инфекции, обусловливая развитие острого респираторного дистресс-синдрома, имеющего высокую летальность [12].
Особенностью течения инфекции в рамках ГЛПС являются непродолжительность виремии, преобладание иммунопатогенетических механизмов повреждающего действия на восприимчивый организм [6], что затрудняет возможность проведения этиотропной терапии и переносит основной акцент в лечебных мероприятиях на патогенетическую коррекцию возникающих нарушений. Однако патогенез ГЛПС весьма сложен и окончательно не изучен, в частности не выяснена в полной мере роль цитокинов в его развитии. Не разработаны информативные лабораторные показатели для оценки степени тяжести заболевания. Недостаточность исследования значения системы цитокинов в патогенезе ГЛПС диктует необходимость проведения дополнительных исследований в этом направлении.
Целью настоящего исследования явилось изучение особенностей продукции про- и противовоспалительных цитокинов у больных ГЛПС с различной степенью тяжести заболевания в олигурическом периоде.
Материалы и методы. В исследование включены 54 больных ГЛПС в возрасте от 22 до 59 лет, находившихся на стационарном лечении в инфекционном отделении БУ «Городская больница скорой медицинской помощи» (г. Чебоксары) в 2011-2013 г. Заболевание подтверждали выявлением специфических антител к хантавирусу ГЛПС в парных сыворотках методом непрямой иммунофлюоресценции. Осуществляли количественное определение про- и противовоспалительных цитокинов - IL-1β, IL-2, IL-6, IL-8, IL-10, TNFα, IFN-γ, RA-IL-1β в сыворотке крови методом иммуноферментного анализа (ИФА) в соответствии с инструкцией к ИФА-наборам (ООО «Цитокин», С-Петербург). Исследование проводили при поступлении больных в стационар, в олигурическом периоде инфекции. Среди обследованных - 43 мужчины (79,6%) и 11 женщин (20,4%). Тяжесть течения заболевания оценивали по следующим критериям: легкое течение - лихорадка до 38˚С, олигурия до 1000 мл/сут., микропротеинурия, микрогематурия, концентрация уровня мочевины в норме, повышение уровня креатинина до 130 мкмоль/л; среднетяжелое течение - лихорадка до 39,5˚С, головная боль, рвота, интенсивная боль в области поясницы, боли в животе, геморрагическая сыпь, олигурия до 300 мл/сут., концентрация уровня мочевины в плазме крови до 18,5 ммоль/л, креатинина - до 300 мкмоль/л; тяжелое течение - осложнения в виде инфекционно-токсического шока и острой сосудистой недостаточности, геморрагический синдром, олигурия менее 300 мл/сут. или анурия, концентрация уровня мочевины в плазме крови свыше 18,5 ммоль/л, креатинина - свыше 300 мкмоль/л [2]. Процентное распределение больных по степени тяжести оказалось следующим: легкая форма у 16,7% (9 больных), среднетяжелая - у 62,9% (34), тяжелая - у 20,4 % (11).
Статистическую обработку результатов исследования проводили с использованием компьютерной программы STATISTICA for Windows 10,0. Данные представляли в виде М±SD, где М - средняя арифметическая, SD - среднеквадратичное отклонение. При сравнении двух выборок для оценки достоверности различий применяли t-критерий Стьюдента (р). Для определения степени зависимости между изучаемыми показателями и ее направленности проводили корреляционный анализ с использованием коэффициента корреляции рангов Спирмена (rs), достоверность коэффициентов считалась приемлемой при prs<0,05.
Полученные в ходе исследования значения уровней цитокинов сравнивали с показателями региональной нормы, рассчитанными в результате исследовании сывороток 40 практически здоровых лиц Чувашской Республики [3].
Результаты исследования и обсуждение. Средние значения показателей цитокинового статуса у больных ГЛПС заметно отличались от значений региональной нормы (табл. 1).
Таблица 1. Показатели цитокинового профиля у больных ГЛПС в сравнении со здоровыми лицами
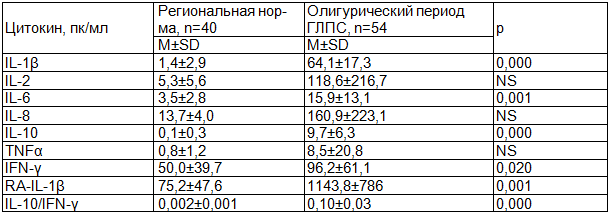
Примечание: NS - различие не достоверно (p>0,05).
Уровень первичного провоспалительного цитокина - IL-1β у больных более чем в 45 раз превышал аналогичный показатель здоровых. Параллельно с IL-1β повышался уровень рецепторного антагониста этого цитокина - RA-IL-1β. Известно, что продукция IL-1β и его рецепторов начинается локально в зоне первичного контакта с микроорганизмами, при этом активируются различные типы клеток (лейкоциты, эндотелий, макрофаги, фибробласты и др.) и формируется местная воспалительная реакция. Поэтому IL-1β считается пусковым медиатором развития воспалительной и других защитных реакций организма [9]. Вслед за первичными провоспалительными цитокинами происходит продукция вторичных провоспалительных цитокинов - IL-6 и IL-8, сопряженная с активацией клеток врожденного иммунного ответа - нейтрофилов и моноцитов. У больных ГЛПС в олигурическом периоде был повышен IL-6. В сторону повышения изменялся у больных и уровень провоспалительного цитокина с регулирующими функциями - IFN-γ. Известно, что данный цитокин оказывает стимулирующее влияние на клеточный механизм иммунного ответа. Одновременно с провоспалительными цитокинами повышалось среднее значение противовоспалительного цитокина - IL-10. Данный цитокин подавляет продукцию провоспалительных цитокинов и его продукция сопряжена с активацией гуморального иммунного ответа [15].
Цитокиновый профиль больных ГЛПС имел некоторые различия в щависимости от тяжести течения заболевания. Так, повышение продукции IFN-γ относительно референтных значений было статистически достоверным лишь при легком течении инфекции. Уровень IL-1β у больных с тяжелым течением ГЛПС отличался (в сторону повышения) относительно такового у больных легким течением заболевания (табл. 2). Отношение IL-10/IFN-γ у больных тяжелым течением ГЛПС было выше аналогичных значений групп пациентов с легким течением заболевания и со средне-тяжелым.
Таблица 2. Показатели цитокинового профиля в группах больных, различающихся степенью тяжести течения ГЛПС
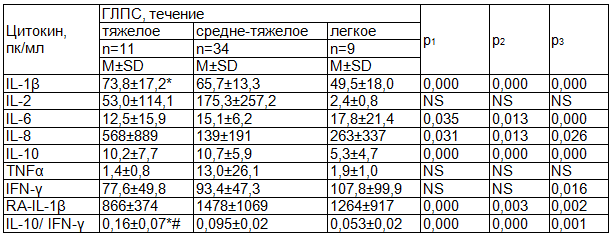
Примечания: * - достоверное различие (p<0,05) относительно показателя группы с легким течением ГЛПС, # - достоверное различие (p<0,05) относительно показателя группы со средне-тяжелым течением ГЛПС, р1, р2, р3 - степени достоверности отличия показателей в группах больных ГЛПС с тяжелым, средне-тяжелым и легким течением соответственно относительно референтных значений, NS - различие не достоверно (p>0,05).
Приведенные данные свидетельствуют о том, что из всех изучаемых показателей цитокинового статуса индекс IL-10/IFN-γ лучше всего реагирует на тяжесть течения ГЛПС. Данный индекс выбран нами не случайно. Ранее уже предпринимались попытки поиска показателей, отражающих связь между уровнями продукции различных цитокинов между собой, а также - лабораторного предиктора тяжелого течения различных инфекционно-воспалительных заболеваний [4, 5]. В результате были предложены различные индексы - IL-10/IFN-γ, RA-IL-1β/TNFα. В нашем случае индекс RA-IL-1β/TNFα не пригоден из-за отсутствия статистически значимого отличия уровня TNFα у больных ГЛПС от референтных значений. В связи с этим мы остановились на втором индексе - IL-10/IFN-γ, среднее значение которого превышало значение здоровых у больных тяжелым течением ГЛПС в 80 раз, у больных легким течением - в 3 раза и у больных со средне-тяжелым течением - в 1,7 раза.
Ранее были опубликованы данные об обнаружении при ГЛПС ряда различий в иммуно-гематологических показателях при различных формах тяжести заболевания. В частности, при тяжелом течении инфекции в олигурическом периоде отмечено увеличение содержания лейкоцитов, нейтрофилов, абсолютного числа мононуклеарных клеток, экспрессирующих Fas-рецептор апоптоза, в сочетании с уменьшением фагоцитарного числа, по сравнению с группой больных с нетяжелым течением [1]. В результате настоящего исследования выявлена позитивная связь индекса IL-10/IFN-γ с содержанием в крови лейкоцитов, сегментоядерных нейтрофилов (табл. 3). Кроме того, данный индекс прямо коррелировал с показателями, отражающими функциональное состояние почек - сывороточной концентрацией креатинина, калия и с показателем гемостазиограммы - протромбиновым временем.
Таблица 3. Статистически значимые корреляционные связи IL-10/IFN-γ с лабораторными показателями

Примечание: абс. - абсолютное значение (×109/л).
На ухудшение азотвыделительной функции почек указывало у пациентов с тяжелым течением ГЛПС повышение уровня сывороточного креатинина до 372,6±278,5 мкмоль/мл (против 140,1±56,8 мкмоль/л в группе больных с легким течением заболевания, p=0,0017). Протромбиновое время при тяжелом течении ГЛПС (32,1±4,31сек) превышало таковое при легком течении инфекции (22,3±2,3 сек, p= 0,02), что свидетельствует о нарушении свертывания крови - гипокоагуляции, обусловливающей развитие геморрагического синдрома. Данные литературы также подтверждают, что тяжелые формы ГЛПС проявляются нарушениями функции почек и свертывания крови, ухудшающими прогноз и выживаемость больных [10, 11]. Требуются дальнейшие исследования с большим числом больных в группах исследования с целью выработки количественных показателей предикторов тяжести течения ГЛПС.
Выводы
- У больных ГЛПС повышены уровни про- и противовоспалительных цитокинов: IL-1β, IL-6, IL-10, IFN-γ и RA-IL-1β.
- Для тяжелого течения ГЛПС характерны высокие уровни IL-1β и IL-10/IFN-γ.
- Наиболее информативным показателем цитокинового профиля у больных ГЛПС является индекс IL-10/IFN-γ, который можно использовать в качестве лабораторного маркера и предиктора тяжелого течения данного заболевания.
