Введение. Эпидемия хронических неинфекционных заболеваний обусловливает рост числа пациентов, страдающих хронической болезнью почек (ХБП) [1, 5]. Вклад такого распространенного заболевания, как хроническая обструктивная болезнь легких (ХОБЛ), остается неизученным. Между тем, ХОБЛ является хроническим заболеванием респираторного тракта с такими доказанными системными эффектами, как гипоксемия, хроническое воспаление, оксидативный стресс и как следствие - эндотелиальная дисфункция [3, 4]. Имеющаяся на сегодняшний день концепция факторов риска (ФР) развития и прогрессирования ХБП практически полностью совпадает с таковыми при ХОБЛ [1, 3]. Кроме того, большинство системных проявлений ХОБЛ, таких как анемия, депрессия, минерально-костные нарушения, сердечно-сосудистые осложнения, совпадают с проявлениями ХБП и могут ошибочно расцениваться исключительно как проявления ХОБЛ [4-6, 9]. Таким образом, общность факторов риска, наличие хронического системного воспаления, высокая степень атерогенеза определяют необходимость изучения маркеров почечной дисфункции у пациентов с ХОБЛ.
Цель работы: определить маркеры почечной дисфункции у больных хронической обструктивной болезнью легких.
Материалы и методы исследования. Статистические методы исследования включали пакет электронных таблиц Microsoft Excel, статистические расчеты с применением пакета программы «IBM SPSS Statistics 22». Для оценки межгрупповых различий использовался t критерий Стьюдента. Данные представлены в виде средней арифметической (М)+стандартное отклонение (SD). При анализе таблиц сопряженности использовали критерий c2 Пирсона. Анализ взаимосвязей переменных проводился методом линейного корреляционного анализа Пирсона (r) и ранговой корреляции Спирмена (rs). Достоверными считали различия при p<0,05.
Проанализировано 145 медицинских карт стационарного больного с верифицированным диагнозом ХОБЛ 1-4 степени тяжести. Большинство из них (84,1%, n=122) были лицами мужского пола (р<0,001) (средний возраст 60,7±0,9 лет), в каждом шестом случае в исследование вошли женщины (15,8%, n=23) (средний возраст 62,0±2,7 года) (р=0,585).
Диагноз ХОБЛ установлен в соответствии с рекомендациями Global Initiative for Chronic Obstructive Lung Disease (GOLD) (2014) [7]. Хроническая обструктивная болезнь легких легкой степени была зарегистрирована у 4 лиц мужского пола (2,7%), в каждом втором наблюдении (n=68, 46,9%) - умеренная степень, тяжелая степень ХОБЛ верифицирована у 40% пациентов (n=58), крайне тяжелая степень тяжести ХОБЛ была выставлена каждому десятому пациенту (10,4%, n=15).
Распределение больных производили по возрастным категориям, учитывая классификацию Всемирной организации здравоохранения: 18 - 44 года - молодой возраст, 45 - 59 лет - средний возраст, 60 - 74 лет - пожилой возраст, 75 - 89 - старческий возраст [8].
Проведен сравнительный анализ распространенности факторов риска развития и прогрессирования ХБП у больных ХОБЛ - возраст, пол, курение, артериальная гипертензия (АГ), нарушения углеводного обмена, избыточная масса тела, включая ожирение, и другие. Изучена частота сопутствующих заболеваний (ишемическая болезнь сердца (ИБС), сахарный диабет (СД), патология мочевыделительной системы (МВС)), оказывающих существенное влияние на прогноз для пациентов [15].
Всем пациентам выполнен расчет скорости клубочковой фильтрации (СКФ) по формуле Chronic Kidney Disease Epidemiology Collaboration 2009 г. в модификации 2011 г. (CKD-EPI). Расчет проведен на основании уровня сывороточного креатинина, для женщин с уровнем креатинина ≤0,7 мг/100мл по формуле 144×(0,993)Возраст×(SСг/0,7)-0,328, с уровнем креатинина >0,7 мг/100мл - 144×(0,993)Возраст×(SСг/0,7)-1,210. Для мужчин с уровнем креатинина ≤0,9 по формуле 141×(0,993)В°зраст×(SСг/0,9)-0,412, при уровне креатинина >0,9 по формуле 141×(0,993)Возраст×(SСг/0,9)-1,210 [1, 14]. Соответственно величине СКФ пациенты с ХОБЛ разделены на шесть групп: в 1-ю группу вошли пациенты с гиперфильтрацией, во 2-ю группу - с СКФ ≥90 мл/мин/1,73 м2, в 3-ю группу - с СКФ 89-60 мл/мин/1,73 м2, в 4-ю группу - с СКФ 59-45 мл/мин/1,73м2, в 5-ю группу - с СКФ 44-30 мл/мин/1,73м2 и в 6-ю группу вошли пациенты с СКФ < 30 мл/мин/1,73 м2.
Результаты исследования и их обсуждение. Оптимальный уровень СКФ в пределах 90-110 мл/мин/1,73м2 имел каждый пятый пациент (n=28, 19,3%) (средний возраст 55,9±1,8 года) (рисунок 1). В когорте обследуемых больных преобладали пациенты с умеренным снижением СКФ 89-60 мл/мин/1,73м2 (n=77, 53,1%) (средний возраст 60,0±1,2 года) (р<0,001), гиперфильтрация выявлена у 4,1% пациентов (n=6) (средний возраст 51,2±4,2 года), снижение СКФ в пределах 59-45 мл/мин/1,73м2 - у 13,1% (n=19) (средний возраст 68,8±1,9 года), СКФI 44-30 мл/мин/1,73м2 - у 8,2% (n=12) (средний возраст 67,2±2,7 года), СКФ <30 мл/мин/1,73м2 - у 2,06% (n=3) (средний возраст 65,0±9,0 года).
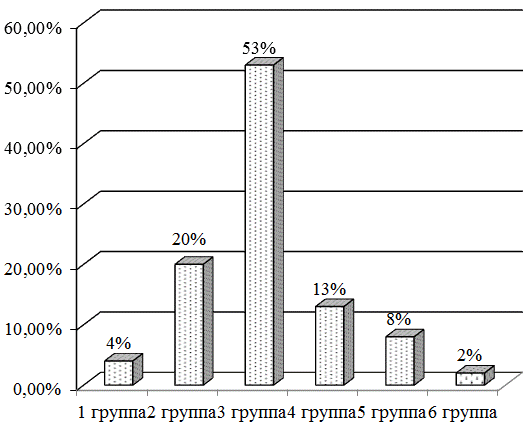
Рис. 1. СКФ у больных ХОБЛ.
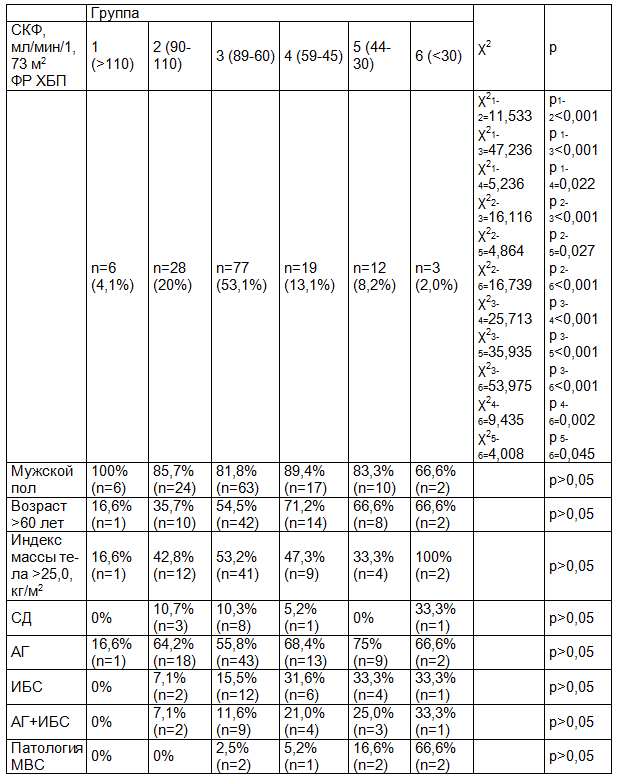
Во всех группах численно преобладали мужчины: в 1-й -100%, во 2-й -85,7%, в 3-й - 81,8%, в 4-й - 89,4%, в 5-й - 83,3% и в 6-й - 66,6% (p<0,05). Достоверных различий между группами по полу не обнаружено. Среди больных ХОБЛ преобладали лица пожилого возраста - 58,6% (n=85) (р=0,110). Количество мужчин пожилого возраста, страдающих ХОБЛ, составило 59,0% (n=72), женщин - 31,2% (n=7). При снижении СКФ ниже 60 мл/мин/1,73м2 каждый второй пациент был старше 60 лет (р=0,278) (табл. 1). Выявлена отрицательная корреляция между возрастом и СКФ (r=-0,426, p<0,05).
Частота заболеваний МВС составила 4,8% (n=7). Установленный ранее диагноз ХБП имели 2,7% пациентов с ХОБЛ (n=4).
Проведен анализ сопутствующих заболеваний, оказывающих существенное неблагоприятное влияние на прогноз как ХОБЛ, так и ХБП. Распространенность АГ среди больных ХОБЛ составила 59,3% (n=86) (р=0,083). Частота АГ во всех группах была сопоставима (р>0,05). Частота выявления АГ у мужчин составила 60,6% (n=74), у женщин - 52,1% (n=12) (χ2=0,041, p=0,840). Острое нарушение мозгового кровообращения отмечено у 6 (4,1%) пациентов, СД 2 типа - 13 (8,9%) пациентов, нарушение толерантности к глюкозе (НТГ) - 1 (0,6%) пациент. Максимальные средние значения гликемии зарегистрированы в группе СКФ 44-30 мл/мин/1,73м2 (6,3±1,1 ммоль/л). Частота сочетания АГ+ИБС была сопоставима во всех сравниваемых группах (p>0,05).
Таблица 1. Распространенность ФР ХБП в зависимости от скорости СКФ
Среднее значение индекса массы тела (ИМТ) в когорте обследуемых соответствовало избыточной массе тела, составив 26,6±0,6 кг/м2: у мужчин - 26,7±0,6 кг/м2, у женщин - 25,8±1,7 кг/м2 (р=0,566). Избыточная масса тела, ожирение обнаружены у каждого второго пациента (49,6%, n=72) (р=0,973).
Не были выявлены достоверные различия между количеством пациентов с избыточной массой тела, ожирением в группах с различной СКФ (p>0,05). Однако, ИМТ был достоверно выше в группе с СКФ<30 мл/мин/1,73м2 (р=0,05) (табл.2).
Таблица 2. Распространенность ФР ХБП в зависимости от скорости СКФ
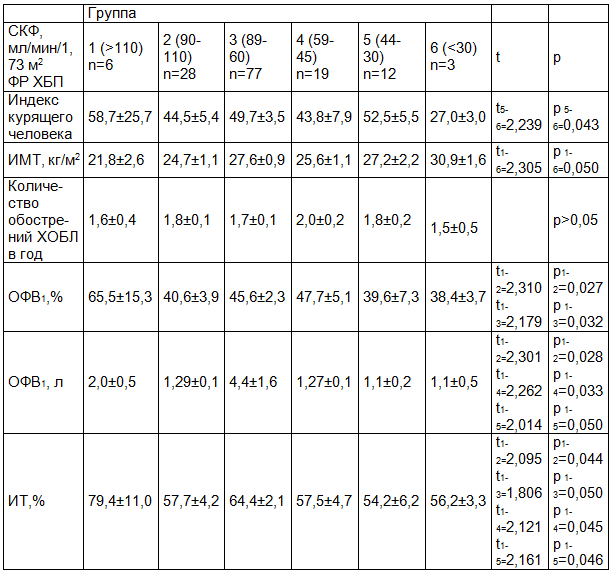
Примечание: ОФВ1 - объем форсированного выдоха за первую секунду, ИТ - индекс Тиффно.
Распространенность курения, общего фактора риска для ХОБЛ и ХБП, составила 79,3% (n=115) (р<0,001). Индекс курящего человека (ИКЧ) во всех группах был сопоставим, кроме пациентов 5-ой группы, у которых ИКЧ оказался выше пациентов со СКФ <30 мл/мин/1,73м2 (p<0,05). Среди мужчин ИКЧ был выше, чем у женщин во всех анализируемых группах (p<0,05). ИКЧ коррелировал с тяжестью ХОБЛ (r=-0,248; p<0,05). Количество обострений ХОБЛ в год составило 1,6±0,3 и не влияло на показатели СКФ.
Средний уровень креатинина в целом по выборке составил 95,9±2,8 мкмоль/л. Показатель креатинина ≥90 мкмоль/л обнаружен у 55,1% (n=80).
Во всех группах преобладали пациенты со среднетяжелой степенью ХОБЛ. В группе пациентов с гиперфильтрацией (50%, n=3), в группе пациентов с СКФ 44-30 мл/мин/1,73м2 (41,6%, n=5), а также в группе СКФ<30 мл/мин/1,73м2 (66,6%, n=2), в группе СКФ 89-60 мл/мин/1,73м2 (49,3%, n=38) чаще были зарегистрированы пациенты со среднетяжелой ХОБЛ (p<0,05). В группе с СКФ 90-110 мл/мин/1,73м2 с одинаковой частотой встречались пациенты со среднетяжелой (39,3%, n=11) и тяжелой ХОБЛ (39,2%, n=11), как и в группе с СКФ 59-45 мл/мин/1,73 м2 (47,3%, n=9) (p<0,05). Средняя величина ОФВ1 в группе обследуемых соответствовала тяжелой степени бронхиальной обструкции (45,1±1,8%): мужчины 43,8±1,9%, женщины 51,5±4,8% (р=0,114); 1,6±0,2 л: мужчины 1,7±0,3л, женщины 1,0±0,1л (р=0,315). Установлено, что нарушение функции внешнего дыхания приводит к прогрессирующему снижению СКФ: показатели ОФВ1 и ИТ были ниже в группах СКФ в пределах 90-110 мл/мин/1,73м2, СКФ 89-60 мл/мин/1,73м2, СКФ 59-45 мл/мин/1,73м2, СКФ 44-30 мл/мин/1,73м2, чем в группе пациентов с гиперфильтрацией (р<0,05). Обнаружена отрицательная корреляционная связь между СКФ и уровнем альбумина (r=-0,268, р<0,05) и альфа-1-глобулинами (r=-0,334, р<0,05). По мере увеличения уровня альбумина зарегистрировано снижение СКФ (р<0,001).
Выявлена отрицательная корреляционная зависимость средней силы между СКФ и толщиной задней стенки левого желудочка (ТЗСЛЖ) (r=-0,356, р<0,05), систолическим давлением в легочной артерии (СДЛА) (r=-0,226, р<0,05). Также выявлена положительная корреляционная зависимость между уровнем креатинина и размерами правого предсердия (ПП) (r=0,272) и ТЗСЛЖ (r=0,334, р<0,05) (табл.3). Установлено, что по мере снижения гломерулярной фильтрации нарастает гипертрофия левого желудочка (ЛЖ) (р<0,001), легочная гипертензия (р<0,05), что, вероятно, обусловлено патогенетическими механизмами (увеличением объема циркулирующей крови, активацией ренин-ангиотензин-альдостероновой системы и увеличением пред- и постнагрузки при ХБП).
Таблица 3. Лабораторно-инструментальные показатели пациентов с ХОБЛ в зависимости от величины СКФ
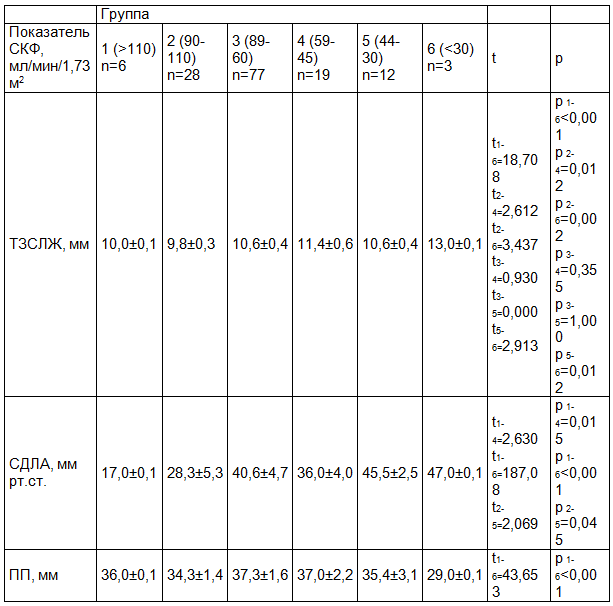
Стоит отметить, что частота АГ в анализируемом контингенте больных ХОБЛ, являющейся не только сопутствующим заболеванием, но и фактором риска ХБП, составила 59,3%, что сопоставимо с имеющимися данными других исследований по распространенности АГ среди пациентов с ХОБЛ (34-67%) [10]. Отрицательная корреляция между систолическим артериальным давлением и степенью тяжести ХОБЛ (r=-0,137), а также между СКФ и ТЗСЛЖ (r=-0,356, р<0,05), СДЛА (r=-0,226, р<0,05), достоверная положительная корреляционная зависимость между уровнем креатинина и размерами ПП (r=0,272) и ТЗСЛЖ (r=0,334, р<0,05) объяснимы в рамках «кардиоренального континуума» [11, 12]. Развивающаяся сердечная недостаточность, наряду с АГ и ИБС, могут быть основными причинами формирования ХБП у пациентов с ХОБЛ.
Также установлено, что нарушение функции внешнего дыхания приводит к прогрессирующему снижению СКФ: показатели ОФВ1 и ИТ оказались ниже в группах СКФ в пределах 90-110 мл/мин/1,73м2, СКФ 89-60 мл/мин/1,73м2, СКФ в пределах 59-45 мл/мин/1,73м2, СКФ 44-30 мл/мин/1,73м2, чем в группе пациентов с гиперфильтрацией (р<0,05). Очевидно, в прогрессирующем снижении гломерулярной фильтрации ключевым патогенетическим моментом является гипоксия, что находит отражение и в литературных данных [13].
Выводы
- У больных ХОБЛ преобладает умеренное снижение СКФ 89-60 мл/мин/1,73м2 (53,1%) (р<0,001). В каждом пятом наблюдении регистрируется оптимальный уровень СКФ 90-110 мл/мин/1,73м2 (19,3%). Каждый десятый пациент имеет снижение СКФ в пределах 59-45 мл/мин/1,73м2 (13,1%) и СКФ 44-30 мл/мин/1,73м2 (8,2%). Гиперфильтрация выявляется у 4,1% пациентов, а 2% имеют СКФ <30 мл/мин/1,73м2.
- Маркерами почечной дисфункции у больных ХОБЛ являются: пожилой возраст, курение, избыточная масса тела и ожирение, бронхиальная обструкция тяжелой степени, легочная гипертензия, гипертрофия левого желудочка.
- Обнаружение отрицательной корреляционной связи между СКФ и уровнем альбумина (r=-0,268, р<0,05) и альфа-1-глобулинами (r=-0,334, р<0,05) свидетельствуют о влиянии их на снижение гломерулярной фильтрации.
